м„ң лЎ
кіЁмҲҳм„ұ мңЎмў…(myeloid sarcoma)мқҖ кіЁмҲҳлӘЁм„ёнҸ¬к°Җ кіЁмҲҳ мҷё мЎ°м§Ғм—җ м№ЁлІ”н•ҳм—¬ м •мғҒ мЎ°м§Ғмқҳ кө¬мЎ°лҘј нҢҢкҙҙн•ҳлҠ” нҠ№м§•мқ„ к°Җ진 м§ҲнҷҳмңјлЎң нқ”нһҲ н”јл¶Җ, лҰјн”„м Ҳ, мң„мһҘкҙҖ, лјҲ, м—°мЎ°м§Ғм—җм„ң л°ңмғқн•ҳл©° 비강м—җм„ңлҠ” л§Өмҡ° л“ңл¬јм–ҙ лҰјн”„мў…мңјлЎң мҳӨ진лҗҳкё° мүҪлӢӨ[1].
кіЁмҲҳм„ұ мңЎмў…мқҖ кёүм„ұ кіЁмҲҳм„ұ л°ұнҳҲлі‘, л§Ңм„ұ кіЁмҲҳм„ұ л°ұнҳҲлі‘, кіЁмҲҳмқҙнҳ•м„ұ мҰқнӣ„кө°кіј кҙҖл Ёлҗҳм–ҙ л°ңмғқн•ҳл©°[1] нҠ№нһҲ, кёүм„ұ л°ұнҳҲлі‘ нҷҳмһҗмқҳ 2~8%м—җм„ң л°ңмғқн•ҳкі мқҙ мӨ‘ 15~35%м—җм„ңлҠ” кёүм„ұ л°ұнҳҲлі‘кіј лҸҷмӢңм—җ л°ңкІ¬лҗҳл©°, 25%м—җм„ңлҠ” кёүм„ұ кіЁмҲҳм„ұ л°ұнҳҲлі‘м—җ м„ н–үн•ҳм—¬ л°ңмғқ, 50%м—җм„ңлҠ” кёүм„ұ кіЁмҲҳм„ұ л°ұнҳҲлі‘ 진лӢЁ нӣ„ л°ңмғқн•ңлӢӨ. мқҙм—җ л°ҳн•ҙ кіЁмҲҳмқҙнҳ•м„ұ мҰқнӣ„кө°кіј м—°кҙҖлҗҳм–ҙ л°ңмғқн•ң кІҪмҡ°мқҳ м—ӯн•ҷ л°Ҹ л№ҲлҸ„лҠ” мһҳ м•Ңл Өм ё мһҲм§Җ м•ҠлӢӨ[2]. көӯлӮҙм—җм„ңлҠ” 비강мқҳ кіЁмҲҳм„ұ мңЎмў… мӨ‘ кёүм„ұ кіЁмҲҳм„ұ л°ұнҳҲлі‘кіј лҸҷмӢңм—җ л°ңмғқн•ң мҰқлЎҖ 1мҳҲ[3], мӣҗл°ңм„ұмңјлЎң л°ңмғқн•ң мҰқлЎҖ 2мҳҲ[4,5]к°Җ мһҲмңјлӮҳ кіЁмҲҳмқҙнҳ•м„ұ мҰқнӣ„кө°кіј кҙҖл Ёлҗҳм–ҙ л°ңмғқн•ң кІҪмҡ°лҠ” ліҙкі лҗң л°”к°Җ м—ҶлӢӨ.
м Җмһҗл“ӨмқҖ кіЁмҲҳмқҙнҳ•м„ұ мҰқнӣ„кө°мқҳ л°ұнҳҲлі‘м„ұ ліҖнҷ”лҘј ліҙмқҙлҠ” 51м„ё м—¬мһҗ нҷҳмһҗм—җм„ң л°ңмғқн•ң 비강мқҳ кіЁмҲҳм„ұ мңЎмў…мқ„ кІҪн—ҳн•ҳмҳҖкё°м—җ л¬ён—Ңкі м°°кіј н•Ёк»ҳ ліҙкі н•ҳлҠ” л°”мқҙлӢӨ.
мҰқ лЎҖ
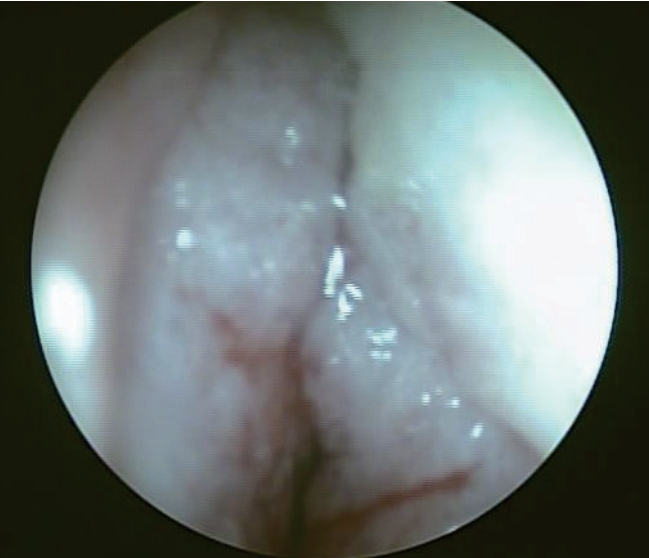
51м„ё м—¬мһҗ нҷҳмһҗк°Җ 2к°ңмӣ” м „л¶Җн„° мӢңмһ‘лҗҳм–ҙ м җм°Ё мӢ¬н•ҙм§ҖлҠ” м–‘мёЎ мҪ”л§үнһҳмқ„ мЈјмҶҢлЎң лӮҙмӣҗн•ҳмҳҖлӢӨ. нҷҳмһҗлҠ” лҘҳл§ҲнӢ°мҠӨ кҙҖм Ҳм—ј, кі нҳҲм••, кі м§ҖнҳҲмҰқ, мІҷ추кҙҖ нҳ‘м°©мҰқ, мһҗк¶Ғ к·јмў…мқҙ мһҲм—Ҳмңјл©° лӮҙмӣҗ 2л…„ м „ кіЁмҲҳмқҙнҳ•м„ұ мҰқнӣ„кө°, кіЁмҲҳмҰқмӢқм„ұ м§Ҳнҷҳ, кіЁмҲҳ섬мң мҰқмңјлЎң 진лӢЁлҗҳм—Ҳкі лӮҙмӣҗ 2к°ңмӣ” м „ лІ”нҳҲкө¬к°җмҶҢмҰқмқҳ м•…нҷ”, л§җмҙҲ нҳҲм•Ў лҸ„л§җ кІҖмӮ¬м—җм„ң лҜём„ұмҲҷм„ёнҸ¬к°Җ ліҙм—¬ мӢңн–үн•ң кіЁмҲҳ кІҖмӮ¬м—җм„ңлҠ” л°ұнҳҲлі‘м„ұ ліҖнҷ”лҘј ліҙмҳҖм§Җл§Ң кёүм„ұ кіЁмҲҳм„ұ л°ұнҳҲлі‘мқҳ 진лӢЁ кё°мӨҖм—җ лҜём№ҳм§Җ лӘ»н•ҳм—¬ н–Ҙнӣ„ кіЁмҲҳ кІҖмӮ¬лҘј мһ¬мӢңн–үн•ҳкё°лЎң н•ҳкі мҲҳнҳҲ л“ұмқҳ лҢҖмҰқм Ғ м№ҳлЈҢлҘј н•ҳл©° 추м Ғ кҙҖм°° мӨ‘мқҙм—ҲлӢӨ. нҷҳмһҗмқҳ м „мӢ м Ғ мғҒнғңлҠ” мҮ м•Ҫн•ҳмҳҖкі , лӘёнҶөм—җлҠ” 2к°ңмӣ” м „л¶Җн„° лӮҳнғҖлӮң мһҗмғүмқҳ нҷҚл°ҳм„ұ кІ°м Ҳмқҙ мһҲм—ҲлӢӨ. 비лӮҙмӢңкІҪ кІҖмӮ¬м—җм„ңлҠ” л¶Ҳк·ңм№ҷн•ң кІҪкі„мқҳ н‘ңл©ҙкіј 비көҗм Ғ лӢЁлӢЁн•ң мў…л¬јмқҙ м–‘мёЎ м „л№„к°•мқ„ мҷ„м „нһҲ л§үкі мһҲлҠ” мҶҢкІ¬мқҙ кҙҖм°°лҗҳм—ҲлӢӨ. мҡ°мёЎ 비강м—җм„ңлҠ” мў…л¬јмқҙ 비мӨ‘кІ©м—җм„ңл¶Җн„° нҢҪмңӨлҗҳм–ҙ мһҲм—Ҳкі , мўҢмёЎ 비강м—җм„ңлҠ” 비мӨ‘кІ©, 비강м Җ, 비강 мҷёмёЎ м „л°ҳл¶Җм—җм„ң мў…л¬јмқҙ нҳ•м„ұлҗҳм–ҙ мһҲм—ҲлӢӨ(Fig. 1). лӮҙмӣҗ лӢ№мӢң лІ”нҳҲкө¬к°җмҶҢмҰқмқҖ мқҙм „ліҙлӢӨ нҳём „мқ„ ліҙмҳҖм§Җл§Ң(л°ұнҳҲкө¬ 1890/ОјL, нҳҲмғүмҶҢ 8.0 g/dL, нҳҲмҶҢнҢҗ 136000/ОјL) л§җмҙҲ нҳҲм•Ў лҸ„л§җ кІҖмӮ¬м—җм„ң лҜём„ұмҲҷм„ёнҸ¬к°Җ 3%лЎң кҙҖм°°лҗҳм—ҲлӢӨ. 비л¶Җ비лҸҷ м „мӮ°нҷ”лӢЁмёөмҙ¬мҳҒм—җм„ңлҠ” 비мӨ‘кІ©, м–‘мёЎ мӮ¬кіЁлҸҷмқҳ м—°мЎ°м§Ғ мқҢмҳҒмқ„ ліҙмқҙлҠ” мў…м–‘мқҙ ліҙмҳҖкі , м–‘мёЎ мғҒм•…лҸҷмқҳ м җл§үмқҳ 비нӣ„к°Җ кҙҖм°° лҗҳм—ҲмңјлӮҳ кіЁлҜёлһҖмқҖ лӘ…нҷ•н•ҳм§Җ м•Ҡм•ҳлӢӨ(Fig. 2).
нҷҳмһҗмқҳ кіјкұ°л Ҙ, 비лӮҙмӢңкІҪ л°Ҹ мҳҒмғҒн•ҷм Ғ кІҖмӮ¬ мҶҢкІ¬мқ„ нҶ лҢҖлЎң м•…м„ұмў…м–‘, к·ё мӨ‘м—җм„ң лҰјн”„мў…мқҳ к°ҖлҠҘм„ұмқ„ м—јл‘җм—җ л‘җм—Ҳкі мҷёлһҳм—җм„ң лӮҙмӢңкІҪмқ„ мқҙмҡ©н•ң мЎ°м§Ғ кІҖмӮ¬лҘј мўҢмёЎ 비강мқҳ 비мӨ‘кІ©, 비강м Җл¶Җм—җм„ң мӢңн–үн•ҳмҳҖмңјл©° к°ҷмқҖ мӢңкё°м—җ н”јл¶Җкіјм—җм„ң лӘёнҶөмқҳ мһҗмғүмқҳ нҷҚл°ҳм„ұ кІ°м Ҳм—җ лҢҖн•ң мЎ°м§Ғ кІҖмӮ¬лҘј мӢңн–үн•ҳмҳҖлӢӨ.
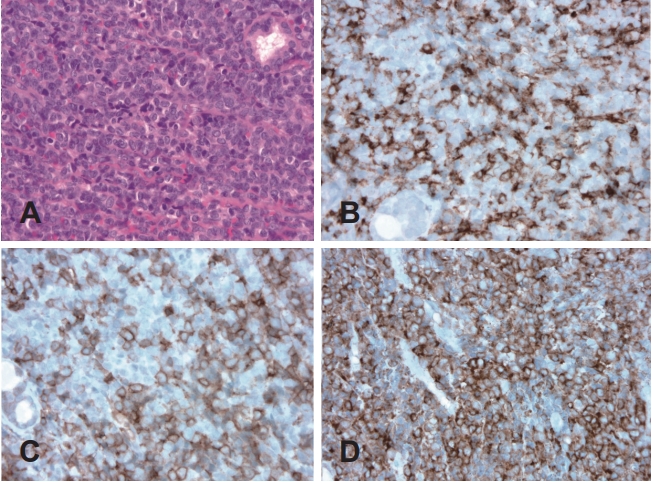
비강 мЎ°м§Ғ кІҖмӮ¬м—җм„ң м •мғҒ 비강 мЎ°м§Ғмқҳ нҢҢкҙҙлҘј лҸҷл°ҳн•ҳлҠ” мў…м–‘м„ёнҸ¬мқҳ м№ЁмңӨ, нҳёмӮ°м„ұмқҳ м„ёнҸ¬м§Ҳмқ„ к°Җм§Җл©°, м„ёнҸ¬мқҳ н•өмқҖ лӮҳм„ нҳ•мқҳ н•өл§үмқ„ к°Җм§Җл©° 분мӮ°лҗң м—јмғүм§Ҳкіј лҲҲм—җ лқ„м§Җ м•ҠлҠ” н•өмҶҢмІҙмқҳ мҶҢкІ¬мқ„ ліҙмҳҖмңјл©° л©ҙм—ӯмЎ°м§Ғнҷ”н•ҷ кІҖмӮ¬м—җм„ңлҠ” CD34, myeloperoxidase (MPO), c-kit, lysozyme м–‘м„ұ мҶҢкІ¬мқ„ ліҙмҳҖмңјл©° CD3, CD20, Epstein-Barr virus by in situ hybridization (EBV-ISH) мқҢм„ұ мҶҢкІ¬мқ„ ліҙмҳҖлӢӨ(Fig. 3). н”јл¶Җмқҳ нҷҚл°ҳм„ұ кІ°м Ҳм—җм„ңлҸ„ MPO, CD34, c-kit м–‘м„ұ мҶҢкІ¬, CD3, CD20, CD30, EBV-ISH мқҢм„ұ мҶҢкІ¬мқҙ лӮҳмҷҖ 비강 л°Ҹ н”јл¶Җмқҳ кіЁмҲҳм„ұ мңЎмў…мңјлЎң 진лӢЁлҗҳм—ҲлӢӨ.
мқҙм—җ л”°лқј кіЁмҲҳмқҙнҳ•м„ұмҰқмқҳ л°ұнҳҲлі‘м„ұ ліҖнҷ”лҘј ліҙмҳҖлҚҳ кіЁмҲҳ мғҒнғңмқҳ ліҖнҷ”лҘј нҢҢм•…н•ҳкё° мң„н•ҙ нҳҲм•ЎлҸ„л§җ кІҖмӮ¬ л°Ҹ кіЁмҲҳ кІҖмӮ¬лҘј мһ¬мӢңн–үн•ҳмҳҖмңјлӮҳ мқҙм „кіј к°ҷмқҙ кіЁмҲҳмқҙнҳ•м„ұмҰқмқҳ л°ұнҳҲлі‘м„ұ ліҖнҷ”лҘј ліҙмҳҖм§Җл§Ң кёүм„ұ кіЁмҲҳм„ұ л°ұнҳҲлі‘мқҳ 진лӢЁ кё°мӨҖм—җлҠ” лҜём№ҳм§Җ лӘ» н•ҳмҳҖлӢӨ.
мң„мқҳ кІ°кіјл“ӨлЎң, кіЁмҲҳмқҙнҳ•м„ұ мҰқнӣ„кө°мқҳ л°ұнҳҲлі‘м„ұ ліҖнҷ”мҷҖ лҸҷл°ҳлҗң 비강 л°Ҹ л¶Җ비лҸҷ, н”јл¶Җмқҳ кіЁмҲҳм„ұ мңЎмў…мңјлЎң мөңмў… 진лӢЁн•ҳмҳҖкі мқјм°Ём Ғ м№ҳлЈҢлҘј мң„н•ҙ idarubicine(12 mg/m2, 3мқј), cytarabine(200 mg/m2, 7мқј)мқҳ н•ӯм•”нҷ”н•ҷмҡ”лІ•мқ„ кі„нҡҚн•ҳмҳҖлӢӨ. н•ӯм•”м№ҳлЈҢ 6мқјм§ё нҳёмӨ‘кө¬ к°җмҶҢлҘј лҸҷл°ҳн•ң м„ӨмӮ¬ л°Ҹ кі м—ҙмқҙ л°ңмғқн•ҳмҳҖкі лӢӨмқҢлӮ нҳҲм••мқҙ м Җн•ҳлҗҳл©° нҳҲм•Ўл°°м–‘м—җм„ң extended-spectrum beta-lactamses м–‘м„ұ escherichia coliк°Җ кІҖм¶ңлҗҳм–ҙ нҢЁнҳҲм„ұ мҮјнҒ¬лЎң кҙ‘лІ”мң„ н•ӯмғқм ң, м§ҖмҶҚм ҒмӢ лҢҖмІҙмҡ”лІ• л“ұмңјлЎң м№ҳлЈҢн•ҳмҳҖмңјлӮҳ кІ°көӯ лӢӨл°ңм„ұ мһҘкё°л¶Җм „мңјлЎң мӮ¬л§қн•ҳмҳҖлӢӨ.
кі м°°
кіЁмҲҳм„ұ мңЎмў…мқҖ кіЁмҲҳлӘЁм„ёнҸ¬лЎң мқҙлЈЁм–ҙм ё кіЁмҲҳ мҷё л¶Җмң„м—җ л°ңмғқн•ң мў…м–‘мңјлЎң, лӢЁмҲңн•ң л°ұнҳҲлі‘м„ёнҸ¬мқҳ мЎ°м§Ғ м№ЁмңӨмқҙ м•„лӢҲлқј м •мғҒ мЎ°м§Ғ кө¬мЎ°мқҳ мҶҢмӢӨмқ„ лҸҷл°ҳн•ҳл©°[6], кіЁмҲҳ мҷё м№ЁлІ”м—җ лҢҖн•ң лі‘мқёмқҖ м •нҷ•нһҲ л°қнҳҖ진 кІғмқҖ м—ҶмңјлӮҳ л№„м •мғҒм Ғмқё л°ұнҳҲкө¬мқҳ нҡҢк·Җ мӢ нҳё(homing signal)мҷҖ м—°кҙҖлҗҳл©° кө¬мІҙм ҒмңјлЎң B2 integrinsмҷҖ matrix metalloproteinase 9лЎң мқҙлЈЁм–ҙ진 мҙҲ분мһҗ ліөн•©мІҙк°Җ л°ұнҳҲлі‘ м„ёнҸ¬мқҳ м„ёнҸ¬ мЈјмң„ лӢЁл°ұ분н•ҙ л°Ҹ м„ёнҸ¬ мқҙлҸҷм—җ кҙҖм—¬н•ңлӢӨкі н•ңлӢӨкі мғқк°ҒлҗңлӢӨ[7].
кіЁмҲҳм„ұ мңЎмў…мқҖ мқёмІҙ лӮҙ м–ҙл””м—җм„ңлҸ„ л°ңмғқн• мҲҳ мһҲмңјлӮҳ л‘җкІҪл¶Җм—җм„ңмқҳ л°ңмғқмқҖ л“ңл¬јл©° нҠ№нһҲ 비강 л°Ҹ л¶Җ비лҸҷм—җм„ңмқҳ л°ңмғқмқҖ л§Өмҡ° л“ңл¬јм–ҙ нҳ„мһ¬к№Ңм§Җ 10мҳҲмқҳ көӯмҷёмқҳ мҰқлЎҖ ліҙкі к°Җ мқҙлЈЁм–ҙмЎҢлӢӨ[1,2,8,9]. мҰқмғҒмқҖ мў…м–‘мқҳ л°ңмғқ л¶Җмң„ л°Ҹ нҒ¬кё°м—җ л”°лқј лӢӨм–‘н•ҳлӮҳ лҢҖл¶Җ분 비нҠ№мқҙм Ғмқё кІҪмҡ°к°Җ л§Һм•„ мҰқмғҒмңјлЎңлҠ” 진лӢЁмқҙ м–ҙл өлӢӨ[1]. 비강 л°Ҹ л¶Җ비лҸҷм—җм„ңлҠ” мҪ”л§үнһҳмқҙ к°ҖмһҘ нқ”н•ң мҰқмғҒмқҙл©°, мў…м–‘мқҳ нҒ¬кё°м—җ л”°лқј кёү, л§Ңм„ұ л¶Җ비лҸҷм—јмқҙ н•©лі‘лҗ мҲҳ мһҲмңјл©° нҷ”лҶҚм„ұ мҪ§л¬ј, нӣ„비루, л‘җнҶө л°Ҹ м•Ҳл©ҙ л¶Җмў… лҳҗлҠ” м••л°•к°җ, м•ҲмҷҖлҘј м№ЁлІ”н• кІҪмҡ° м•Ҳкө¬ лҸҢм¶ңмҰқ, мӢңк°Ғ мһҘм• к°Җ л°ңмғқн• мҲҳ мһҲлӢӨ[8,9]. ліё мҰқлЎҖмқҳ кІҪмҡ° м җ진м Ғмқё м–‘мёЎ мҪ”л§үнһҳ, м•Ҳл©ҙ м••л°•к°җмқ„ нҳёмҶҢн•ҳмҳҖмңјлӮҳ нҷ”лҶҚм„ұ мҪ§л¬ј, нӣ„비루лҠ” м—Ҷм—ҲлӢӨ.
л§ҺмқҖ кІҪмҡ°м—җм„ң кіЁмҲҳм„ұ мңЎмў…мқҖ лӢӨмқҢкіј к°ҷмқҖ 4к°Җм§Җ мғҒнҷ©м—җм„ң л°ңмғқн•ңлӢӨ. кёүм„ұ кіЁмҲҳм„ұ л°ұнҳҲлі‘мқ„ 진лӢЁл°ӣмқҖ нҷҳмһҗм—җкІҢм„ң л°ңмғқн•ҳлҠ” кІҪмҡ°, л§Ңм„ұ кіЁмҲҳм„ұ л°ұнҳҲлі‘мқҳ кёүм„ұкё° м „нҷҳ(blast crisis) нҷҳмһҗм—җкІҢ л°ңмғқн•ҳлҠ” кІҪмҡ°, кіЁмҲҳмқҙнҳ•м„ұ мҰқнӣ„кө°мқҳ л°ұнҳҲлі‘м„ұ ліҖнҷ” нҷҳмһҗм—җкІҢ л°ңмғқн•ҳлҠ” кІҪмҡ°, к·ёлҰ¬кі мқҙлҹ¬н•ң м§Ҳнҷҳл“Өмқҳ лӘ…л°ұн•ң мҰқкұ° м—Ҷмқҙ мӣҗл°ңм„ұмңјлЎң л°ңмғқн•ҳлҠ” кІҪмҡ°к°Җ мһҲлӢӨ[2].
мҳҒмғҒн•ҷм Ғ мҶҢкІ¬мқҖ 비нҠ№мқҙм ҒмңјлЎң лӢӨлҘё мў…м–‘м„ұ лі‘ліҖкіј к°җлі„мқҙ нһҳл“Өм§Җл§Ң, мқјл°ҳм ҒмңјлЎң м»ҙн“Ён„°м „мӮ°нҷ”лӢЁмёөмҙ¬мҳҒм—җм„ң мЈјліҖкіј мһҳ кІҪкі„м§Җм–ҙм§Җл©° л¶Җл“ңлҹҪкі к· м§Ҳн•ҳкІҢ мЎ°мҳҒмҰқк°•лҗҳл©° мЈјліҖмқҳ кіЁм№ЁлІ” мӢң мңөн•ҙм„ұмңјлЎң лӮҳнғҖлӮҳлҠ” нҠ№м§•мқ„ к°Җм§Җкі мһҲлӢӨ[10]. мЈјлҗң 진лӢЁлІ•мңјлЎңлҠ” мЎ°м§Ғ лі‘лҰ¬ кІҖмӮ¬, л©ҙм—ӯмЎ°м§Ғ нҷ”н•ҷ кІҖмӮ¬к°Җ мһҲмңјл©° мЎ°м§Ғ кІҖмӮ¬мғҒ кіЁмҲҳлӘЁм„ёнҸ¬, мӨ‘м„ұкө¬, мӨ‘м„ұкө¬кі„ м „кө¬м„ёнҸ¬л“Өмқҙ нҳјмһ¬лҗҳм–ҙ мһҲкі мқҙл“Ө м„ёнҸ¬л“ӨмқҖ нҠ№м§•мңјлЎң лҶ’мқҖ н•ө/м„ёнҸ¬м§Ҳ 비мңЁмқ„ ліҙмқҙлҠ” л‘Ҙк·ј м„ёнҸ¬, м ҒмқҖ м„ёнҸ¬м§Ҳ, м„ёнҸ¬м§Ҳм—җ нҳёмӮ°кө¬м„ұ кіјлҰҪмқ„ ліҙмқҙлҠ” м„ёнҸ¬л“Өмқҳ мһҰмқҖ мң мӮ¬л¶„м—ҙмқ„ ліҙмқёлӢӨ[1]. мқҙлҹ¬н•ң мЎ°м§Ғ кІҖмӮ¬ мҶҢкІ¬мқҖ лӢӨлҘё мӣҗнҳ•мҶҢм„ёнҸ¬мў…м–‘(small round cell tumor)л“Өмқ„ к°җлі„н•ҙм•ј н•ҳл©° мқҙлҘј мң„н•ҙм„ңлҠ” л©ҙм—ӯмЎ°м§Ғ нҷ”н•ҷ кІҖмӮ¬к°Җ н•„мҡ”н•ҳлӢӨ[1,8].
кө¬мІҙм Ғмқё л©ҙм—ӯмЎ°м§Ғ нҷ”н•ҷ кІҖмӮ¬ н•ӯлӘ©л“Өм—җлҠ” CD68/KP1, MPO, CD43, CD117 лҳҗлҠ” c-kit, CD99, CD68/PGM1, lysozyme, CD34, terminal deoxynucleotidyl transferase, CD56, CD30, glycophorin, CD4 л“ұмқҙ мһҲлӢӨ[2]. кіЁмҲҳм„ұ мңЎмў…м—җм„ң кіЁмҲҳм„ұ 분нҷ”мқҳ н‘ңм§ҖмһҗлЎңлҠ” CD13, CD33, CD117 лҳҗлҠ” c-kit, MPO л“ұмқҙ нқ”н•ҳкі , лӢЁн•өлӘЁм„ёнҸ¬м„ұ 분нҷ”мқҳ н‘ңм§ҖмһҗлЎңлҠ” CD14, CD163, CD11cк°Җ нқ”н•ҳм—¬ кіЁмҲҳм„ұ мңЎмў…мқҳ 진лӢЁмқ„ мң„н•ҙм„ңлҠ” мқҙл“Өмқҳ м–‘м„ұмқ„ нҷ•мқён•ҙм•ј н•ңлӢӨ[11]. ліё мҰқлЎҖмқҳ кІҪмҡ°м—җлҠ” CD34, c-kit м–‘м„ұ мҶҢкІ¬мңјлЎң л§ҢлҠҘ мЎ°нҳҲ мӨ„кё°м„ёнҸ¬(pluripotent hematopoietic stem cell) лҳҗлҠ” м „кө¬м„ёнҸ¬ кі„нҶөмқҳ лҜём„ұмҲҷм„ёнҸ¬лЎң нҠ№м •нҷ”н• мҲҳ мһҲм—Ҳкі , кіЁмҲҳм„ұ 분нҷ”мқҳ н‘ңм§ҖмһҗлЎң lysozyme, MPO м–‘м„ұмқ„ ліҙм—¬ кіЁмҲҳм„ұ мңЎмў…мңјлЎң 진лӢЁн•ҳмҳҖлӢӨ.
к°җлі„ м§ҲнҷҳмңјлЎңлҠ” 비нҳём§ҖнӮЁ лҰјн”„мў…, мң мһү мңЎмў… лҳҗлҠ” мӣҗмӢңмӢ кІҪмҷёл°°м—Ҫм„ұ мў…м–‘(primitive neuroectodermal tumor), нҡЎл¬ёк·ј мңЎмў…, мӢ кІҪм•„м„ёнҸ¬мў…, к°җк°ҒмӢ кІҪлӘЁм„ёнҸ¬мў…(esthesioneuroblastoma), мҶҢм„ёнҸ¬м•” л“ұмқҙ мһҲмңјл©° мқҙл“Ө мӨ‘ нқ”нһҲ мҳӨ진лҗҳкё° мү¬мҡ°л©° к°ҖмһҘ мӨ‘мҡ”н•ң к°җлі„ м§Ҳнҷҳмқё 비нҳём§ҖнӮЁ лҰјн”„мў…мқҖ Bм„ёнҸ¬ лҳҗлҠ” Tм„ёнҸ¬ кі„м—ҙмқҳ мў…м–‘м„ёнҸ¬кө°мқ„ лӮҳнғҖлӮҙл©° мқҙл“Өмқҳ н‘ңм§Җмһҗм—җлҠ” CD3, CD20, CD45RO, CD79aк°Җ мһҲлӢӨ. л”°лқјм„ң кіЁмҲҳм„ұ мңЎмў…мқҳ 진лӢЁм—җм„ң мқҙл“Өмқҳ мқҢм„ұмқ„ нҷ•мқён•ҙм•ј н•ңлӢӨ[8]. ліё мҰқлЎҖмқҳ кІҪмҡ°м—җлҠ” лҰјн”„кі„ 분нҷ”мқҳ н‘ңм§ҖмһҗлЎңм„ң CD3, CD20 мқҢм„ұ мҶҢкІ¬мқ„ нҶөн•ҙ лҰјн”„мў…мқ„ л°°м ңн•ҳмҳҖлӢӨ.
кіЁмҲҳм„ұ мңЎмў…мқҳ 54.3%м—җм„ң м—јмғүмІҙ мқҙмғҒ мҶҢкІ¬мқ„ ліҙм—¬ м„ёнҸ¬мң м „н•ҷ кІҖмӮ¬ к·ёлҰ¬кі нҳ•кҙ‘лҸҷмҶҢліҙн•©лІ•(fluorescence in situ hybridization) кІҖмӮ¬лҘј нҶөн•ң 진лӢЁмқҙ н•„мҡ”н•ҳлӢӨлҠ” ліҙкі к°Җ мһҲмңјл©°, мқҙлҹ¬н•ң м—јмғүмІҙ мқҙмғҒм—җлҠ” mixed-lineage leukemia(MLL) rearrangement, t(8;21), monosomy 7, trisomy 8, MLL splitting, inv(16), trisomy 4, monosomy 16, 16q-, 5q-, 20q-, trisomy 11 л“ұмқҙ мһҲлӢӨ[12]. н•ҳм§Җл§Ң мқҙлҹ¬н•ң мң м „м Ғ мқҙмғҒм—җ л”°лҘё мҳҲнӣ„лӮҳ м№ҳлЈҢ л°©лІ•кіјмқҳ м—°кҙҖм„ұмқҖ м•„м§Ғ л°қнҳҖм§Җм§Җ м•Ҡм•„ мһ„мғҒм Ғ нҷңмҡ©м—җ мһҲм–ҙм„ңлҠ” лҚ” м—°кө¬лҗҳм–ҙм•ј н•ңлӢӨ[8].
кіЁмҲҳм„ұ мңЎмў…мқҖ л№ҲлҸ„к°Җ лӮ®кі л°ңмғқ л¶Җмң„к°Җ лӢӨм–‘н•ҳл©°, м—°кҙҖлҗң нҳҲм•Ў м§ҲнҷҳмңјлЎң мқён•ҙ м№ҳлЈҢм Ғ м§Җм№ЁмқҖ мһҳ м •лҰҪлҗҳм–ҙ мһҲм§Җ м•ҠмңјлӮҳ cytarabineмқ„ нҸ¬н•Ён•ң м „мӢ м Ғмқё н•ӯм•” м№ҳлЈҢлҘј мқјм°Ё м№ҳлЈҢлЎң к¶Ңн•ҳкі мһҲлӢӨ[13]. мҲҳмҲ м Ғ м№ҳлЈҢлҠ” мЎ°м§Ғн•ҷм Ғ нҷ•м§„мқҙ н•„мҡ”н•ң кІҪмҡ° лҳҗлҠ” мў…м–‘мқҳ нҒ¬кё° мҰқк°ҖлЎң мқён•ң мӢ кІҪм••л°• л“ұмқҳ кёүм„ұ мҰқмғҒмқҙ мһҲмқ„ л•Ң мӢңн–үн• мҲҳ мһҲмңјл©° л°©мӮ¬м„ м№ҳлЈҢлҠ” лі‘ліҖмқҙ көӯмҶҢм Ғмқј кІҪмҡ° лҳҗлҠ” н•ӯм•” м№ҳлЈҢм—җ мӢӨнҢЁн–Ҳмқ„ кІҪмҡ°м—җ мӢңлҸ„н•ҙ ліј мҲҳ мһҲлӢӨ[14]. лҸҷмў… мЎ°нҳҲлӘЁм„ёнҸ¬ мқҙмӢқмқҖ м•„м§Ғ нӣ„н–Ҙм Ғ м—°кө¬к°Җ н•„мҡ”н•ҳлӮҳ[8] мөңк·ј м—°кө¬ мқҳн•ҳл©ҙ лҸҷмў… мЎ°нҳҲлӘЁм„ёнҸ¬ мқҙмӢқ нӣ„ 5л…„ мғқмЎҙмңЁмқҙ 47%мқҙл©° нҠ№нһҲ 비강мқҳ кіЁмҲҳм„ұ мңЎмў…м—җм„ңлҠ” лҸҷмў… мЎ°нҳҲлӘЁм„ёнҸ¬ мқҙмӢқмқ„ л°ӣм§Җ м•ҠмқҖ нҷҳмһҗлҠ” 2л…„ мқҙмғҒ мғқмЎҙн•ҳм§Җ лӘ»н•ҳм—¬ нҡЁкіјм Ғмқё н•ӯм•”м№ҳлЈҢ мқҙнӣ„ лҸҷмў… мЎ°нҳҲлӘЁм„ёнҸ¬ мқҙмӢқмқҳ н•„мҡ”м„ұмқ„ к°•мЎ°н•ҳмҳҖлӢӨ[9]. мөңк·јм—җлҠ” fms-like tyrosine 3 inhibitors, farnesyl-transferase inhibitors, histone deacetylase inhibitorsл“Өмқҙ мғҲлЎңмҡҙ м№ҳлЈҢм ңлЎң мҶҢк°ңлҗҳкі мһҲлӢӨ[11].
кіЁмҲҳм„ұ мңЎмў…мқҳ мқјл°ҳм Ғмқё мҳҲнӣ„лҠ” мһҳ л°қнҳҖм ё мһҲм§Җ м•ҠмңјлӮҳ м—°кҙҖлҗң нҳҲм•Ўн•ҷм Ғ м§Ҳнҷҳкіј лҸҷл°ҳлҗҳм–ҙ л°ңмғқн•ҳлҠ” мқҙм°Ём„ұ кіЁмҲҳм„ұ мңЎмў…мқҙ мӣҗл°ңм„ұ кіЁмҲҳм„ұ мңЎмў…ліҙлӢӨ мҳҲнӣ„к°Җ л¶Ҳлҹүн•ҳл©° мӣҗл°ңм„ұ кіЁмҲҳм„ұ мңЎмў… лҳҗн•ң лҢҖл¶Җ분 нҸүк· 1л…„ лӮҙм—җ кёүм„ұ кіЁмҲҳм„ұ л°ұнҳҲлі‘мңјлЎң 진н–үн•ҳл©° мқҙ кІҪмҡ° 1л…„ лҜёл§ҢмңјлЎң мғқмЎҙн•ҳмҳҖлӢӨ[15]. ліё мҰқлЎҖмқҳ кІҪмҡ°лҸ„ мқҙм°Ём„ұ кіЁмҲҳм„ұ мңЎмў…мңјлЎң 진лӢЁ нӣ„ 1к°ңмӣ” лӮҙ мӮ¬л§қн•ҳмҳҖлӢӨ.
ліё мҰқлЎҖлҠ” кіЁмҲҳмқҙнҳ•м„ұ мҰқнӣ„кө°кіј м—°кҙҖлҗҳм–ҙ л°ңмғқн•ң 비강мқҳ мқҙм°Ём„ұ кіЁмҲҳм„ұ мңЎмў…мқҳ л§Өмҡ° л“ңл¬ё мӮ¬лЎҖлЎң, м—°кҙҖлҗң нҳҲм•Ўн•ҷм Ғ м§Ҳнҷҳкіј н•Ёк»ҳ кёүкІ©нһҲ м•…нҷ”лҗҳлҠ” нҠ№м„ұ л°Ҹ нқ”нһҲ м•…м„ұ лҰјн”„мў…мңјлЎң мҳӨ진лҗҳм–ҙ м№ҳлЈҢк°Җ лҠҰм–ҙм§ҖлҠ” м җмқ„ кі л Өн•ҳмҳҖмқ„ л•Ң ліҙлӢӨ лӮҳмқҖ мҳҲнӣ„лҘј мң„н•ҙ л№ лҘё 진лӢЁ л°Ҹ м№ҳлЈҢк°Җ н•„мҡ”н•ҳлӢӨ. мқҙлҘј мң„н•ҙм„ңлҠ” мҡ°м„ к°җлі„ 진лӢЁмңјлЎң мқём§Җн•ҳлҠ” кІғмқҙ мӨ‘мҡ”н•ҳл©° м •нҷ•н•ң 진лӢЁмқ„ мң„н•ҙм„ң мЎ°м§Ғлі‘лҰ¬ кІҖмӮ¬, л©ҙм—ӯмЎ°м§Ғнҷ”н•ҷ кІҖмӮ¬, кіЁмҲҳ кІҖмӮ¬к°Җ н•„мҲҳм Ғмқҙл©° нҷ•м§„ нӣ„ мӢ мҶҚн•ң м „мӢ м Ғмқё н•ӯм•”нҷ”н•ҷмҡ”лІ•мқ„ мӢңмһ‘н•ҙм•ј н•ҳл©° 추к°Җм ҒмңјлЎң мҲҳмҲ м Ғ м№ҳлЈҢ, л°©мӮ¬м„ м№ҳлЈҢ, лҸҷмў… мЎ°нҳҲлӘЁм„ёнҸ¬ мқҙмӢқ л“ұмқ„ м„ нғқн• мҲҳ мһҲлӢӨ.