구인두암에서 초치료에 따른 생존 분석
Primary Treatment and Survival Outcomes in Oropharyngeal Cancer
Article information
Trans Abstract
Background and Objectives
Oropharyngeal cancer is one of those cancers with increasing incidence, and the therapeutic choices remain controversial. This study aims to evaluate the influence of changes in the primary treatment on the prognosis of oropharyngeal cancer patients.
Subjects and Method
A total of 135 patients treated for oropharyngeal cancer in a single institution from 2004 to 2017 were analyzed in this study. Disease-free survival rate and the 3-, 5-year survival rates were calculated according to various radical primary treatments, which included concurrent chemo-radiation or radiation therapy, and surgery. Other outcomes including functional outcomes and treatment duration were also reported.
Results
The proportion of patients who were no-evidence-of-disease state at the last follow up was 97.8% for the group who underwent surgery as radical primary treatment, followed by concurrent chemo-radiation or radiation therapy (84.1%). The five-year survival rate was 0.7963 [95% confidence interval (CI): 0.6746-0.8765] for the concurrent chemo-radiation or radiation therapy group and 0.9488 (95% CI: 0.8093-0.9870) for the surgery group. When surgery was chosen as radical primary treatment for appropriately selected patients, approximately 30% of the patients could avoid radiation therapy. Gastrostomy or admission for supportive care as functional outcome showed no significant difference between treatment groups.
Conclusion
Our results show various treatment outcomes depending on the radical primary treatment. These results can be used in clinical decisions and patient counselling.
서 론
구인두암은 전 세계적으로 흔한 암은 아니나, 다른 주요 암종의 발생이 감소하는 추세인 반면, 구인두암의 발생은 증가하는 추세를 보이고 있다[1]. 이러한 구인두암의 역학 변화는 human papilloma virus(HPV) 감염에 의한 구인두암의 증가에 기인한 것으로 보인다[2]. 그리고 HPV 양성 구인두암은 HPV 음성 구인두암보다 치료 반응이 좋아 더 나은 예후를 보이는 것으로 알려져 있다[3,4].
한편, 구인두암에서는 수술 및 비수술적 치료(방사선치료 또는 동시항암화학방사선요법(concurrent chemoradiation)이 주된 치료방법으로 이용되고 있다[5]. 수술과 비수술적 치료의 성적을 비교한 대규모의 무작위 연구 결과는 없는 실정이며, 현재까지의 관찰연구들에 의하면 두 방법의 차이가 없는 것으로 알려져 있어, 기능적 손실이나 삶의 질을 고려하여 치료방침을 결정하게 된다[6-9]. 비수술적 치료로는 방사선치료보다는 동시항암화학방사선요법이 우수하다는 결과들이 있어 최근에는 동시항암화학방사선요법이 주로 이용되고 있다[10].
본 연구에서는 단일 기관에서 14년간 수집된 구인두암 환자 자료를 이용하여 구인두암에서 초치료 선택에 따른 치료결과에 대해 분석하고자 한다.
대상 및 방법
대 상
본 기관에서 2004년부터 2017년까지 구인두암으로 진단 및 치료받은 환자들의 의무 기록을 후향적으로 조사하였으며, 제외 기준은 1) 편평세포암종이 아닌 다른 병리소견인 경우, 2) 고식적 치료만 받은 경우, 3) 치료 없이 경과 관찰만 한 경우, 4) 두경부 영역에서 이전에 악성 종양으로 치료를 받은 경험이 있는 경우, 5) 진단 시점에 구인두 외 다른 부위 악성종양이 동시에 존재할 경우, 6) 구인두암으로 의심되는 소견이 있었으나 원발부위가 확인되지 않은 경우, 7) 초치료를 타 기관에서 받은 경우이다.
해당되는 환자에 대하여 인구통계학적 정보, 병변 위치, 병기, 병리, HPV 감염 여부, 치료 방법, 재발 여부, 사망 여부 등에 대한 자료를 수집하였다. 본 연구는 분당서울대학교병원 생명윤리심의위원회의 검토와 승인을 받았다(승인번호: B-1812-511-101).
병기 및 치료
병기는 American Joint Committee on Cancer 7th edition의 분류를 기준으로 하였다[11]. 편도절제술 후 진단되어 원발부위 종양의 크기를 결정하기 힘든 경우에는 T1으로 분류하였다.
본 기관의 구인두암 치료방침은 다음과 같다. 우선 원발부위 및 전이부위 조직검사, 신체검사, 영상검사를 통해 병기설정을 하고 다학제 토의 및 환자의 선호도에 따라 초치료를 선택하였다. 필요에 따라 유도항암화학요법을 시행했고, 유도항암화학요법 이후 50% 이상의 종양이 줄어든 부분관해 이상의 경우는 동시항암화학방사선요법이나 방사선치료로 치료를 진행하였으며, 50% 미만의 관해를 보이는 경우는 수술을 권하였다. 환자 군은 근치적 초치료의 종류에 따라서[1] 비수술 군(유도항암화학요법 또는 방사선치료) [2], 수술 군으로 나누어 비교하였다.
분석 방법
연구 대상을 후향적으로 분석하여 치료 방법에 따른 무병생존율(disease-free survival rates)을 비교 분석하였다.
그룹 간의 비교를 위해서 카이 제곱 검정, t 검정 및 one way analysis of variance를 사용하였고, 생존 분석은 Kaplan-Meier 방법과 log-rank test를 이용하였다. 통계는 STATA version 14.0(Stata Corp., College Station, TX, USA)을 사용하였고, p<0.05를 유의한 것으로 판정하였다.
결 과
인구통계학적 특성 및 병기
총 174명의 구인두암 환자 중 제외 기준에 해당되는 39명을 제외한 135명을 연구 대상으로 하였다. 인구통계학적 특성 및 병기는 Table 1에 수술 군과 비수술 군으로 나누어 제시하였다. 연구 대상 135명 중 남자는 122명, 여자는 13명이었으며, 연령은 36~80세까지 분포되어 있었고 평균 60.0±9.01세였다. 평균 추적 관찰기간은 40.4±23.42개월이었다.
원발부위는 편도가 104예(77.0%)로 가장 많았으며 전체 병기의 분포는 stage I 6예(4.4%), stage II 14예(10.4%), stage III 25예(18.5%), stage IV 90예(66.7%)로 진행된 병기가 많았다.
흡연력이 없는 환자는 60예(44.4%), 현재 흡연 중인 환자는 35예(25.9%), 과거 흡연력이 있는 경우는 27예(20.0%), 흡연력을 알 수 없는 환자 13예(9.6%)였다.
초치료에 따른 분석
38예(28.1%)에서 유도항암화학요법 시행한 후 근치적 초치료로 동시항암화학요법 또는 방사선치료 또는 수술을 시행했다(Fig. 1). 유도항암화학요법을 시행한 환자들의 stage 분포는 stage III 2예(5.3%), stage IV A 31예(81.6%), stage IV B 5예(13.2%)로 stage IV 이상의 진행된 병기가 대부분이었다(Table 2). 유도항암화학요법 후 31예(81.6%)에서는 동시항암화학방사선요법, 그리고 1예(2.6%)에서는 방사선치료를 이어서 시행하였으며. 반응이 좋지 못하였던 6예(15.8%)에서는 수술을 시행하였다.
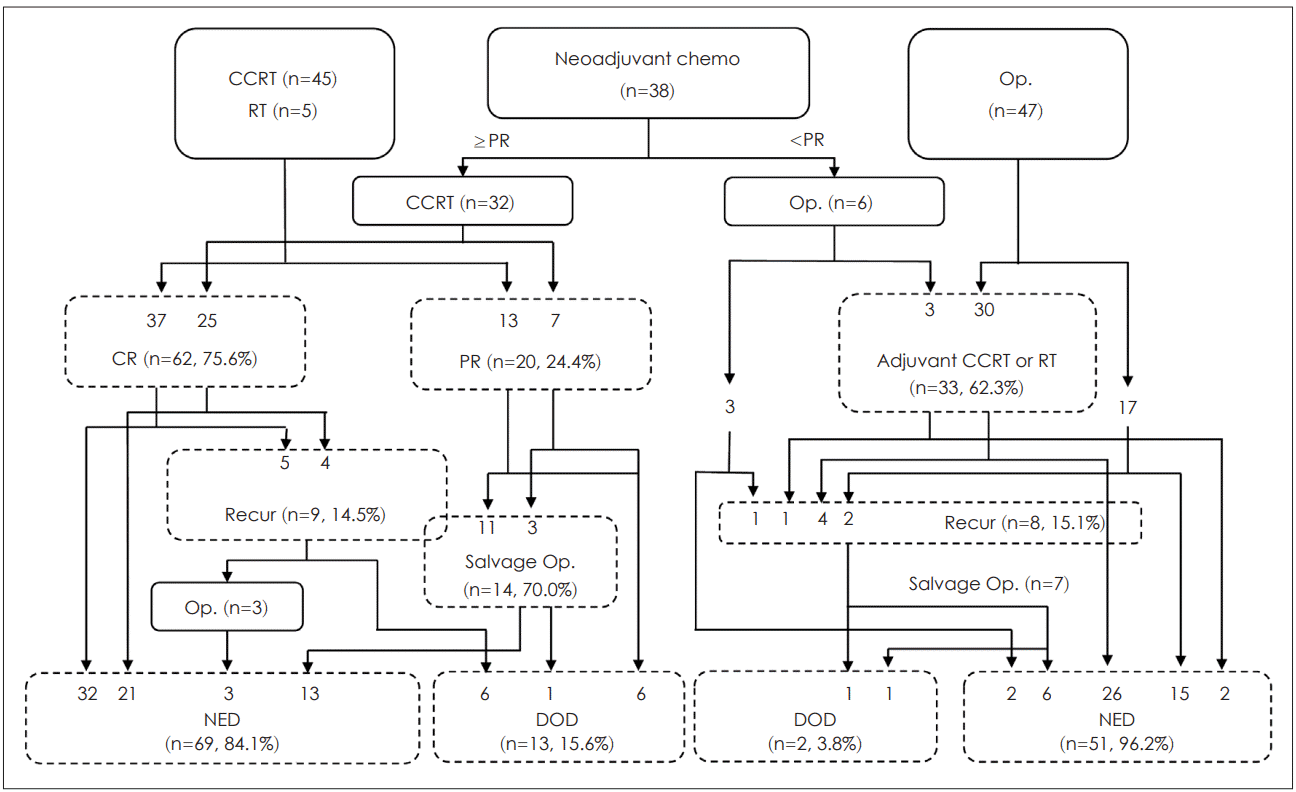
NED survival analysis according to primary treatment. Op.: surgery, NED: no evidence of disease, DOD: dead of disease, CCRT: concurrent chemoradiation therapy, RT: radiation therapy, PR: partial remission, CR: complete remission.
50예(37.0%)에서 유도항암화학요법 없이 동시항암화학방사선요법 또는 방사선치료를 시행했고, 45예에서 동시항암화학방사선요법, 5예에서 방사선치료를 시행했다.
결과적으로 유도항암화학요법 실시 여부에 무관하게 동시항암화학방사선요법 혹은 방사선치료를 근치적 초치료로 선택한 환자들에서 완전관해는 62예(62/82, 75.6%)에서 왔으며 완전관해가 아닌 20예 중에서 14예(70%)에서는 수술(salvage surgery)을 시행하였다(Fig. 1). 유도항암화학요법 후에 동시항암화학방사선요법을 시행한 군과 처음부터 동시항암화학방사선요법을 시행한 군에 완전관해율 차이는 없었다.
Table 3에 동시항암화학방사선요법 혹은 방사선치료를 근치적 초치료로 받은 환자에서 경부림프절과 무관한 원발부위의 완전관해 비율을 T stage에 따라 제시하였다. T stage 중 T2에서 원발부위의 완전관해 비율이 38/43(88.4%)로 가장 높았다. 원발부위에 완전관해가 오지 않은 환자 중 구제수술을 받은 비율은 T stage가 낮을수록 높은 경향을 보였다(Table 3).

Complete remission and salvage surgery of non-surgery (with/without induction neoadjuvant chemotherapy) group by T staging
Table 4에 동시항암화학방사선요법 혹은 방사선치료를 근치적 초치료로 받은 환자에서 원발부위와 무관한 경부림프절의 완전관해 비율을 N stage에 따라 제시하였다. N stage가 낮을수록 경부림프절에 완전관해 비율이 높았다. 경부림프절에 완전관해가 오지 않은 경우 구제수술을 받은 비율도 같은 경향을 보였다(Table 4).

Complete remission and salvage surgery of non-surgery (with/without induction neoadjuvant chemotherapy) group by N staging
유도항암화학요법 없이 근치적 초치료로 수술을 시행한 군은 47예(47/135, 34.8%)였다. Stage 분포는 stage I 5예(5/47, 10.6%), stage II 9예(9/47, 19.2%), stage III 13예(13/47, 27.7%), stage IV A 20예(20/47, 42.6%)로 stage III 이하의 낮은 병기가 대부분이었다(Table 2). 수술 후 보조요법은 30예(30/47, 63.8%)에서 시행되었고, 동시항암화학방사선요법 14예(14/47, 29.8%), 방사선치료 16예(16/47, 34.0%)였다. 앞서 이야기한 바와 같이 유도항암화학요법 후 반응이 좋지 못했던 6예에서는 근치적 초치료로 수술을 시행했다.
유도항암화학요법 실시 여부에 무관하게 수술을 근치적 초치료로 선택한 환자에서 수술 후 보조요법은 33예(33/53, 62.3%)에서 시행되었고, 동시항암화학방사선 요법 15예(15/53, 28.3%), 방사선치료 18예(18/53, 33.9%)였다.
생존 분석
마지막 경과 관찰 시 질병의 증거가 없는 상태(no evidence of disease)인 비율은 다음과 같다. 동시항암화학방사선요법 또는 방사선치료는 84.1%(69/82), 수술은 97.8%(51/53)에서 마지막 경과 관찰 시 무병 생존 상태였다(Fig. 1).
생존율을 근치적 초치료에 따라 동시항암화학방사선요법 또는 방사선치료 군, 수술 군으로 나누어 제시한 그래프를 Fig. 2에 제시하였다. 본 연구 경과 관찰기간의 중간값이 33.8개월로 3년 생존율을 산출하였다. 3년 생존율은 동시항암화학방사선요법 또는 방사선치료 군에서 0.7963[95% confidence interval(CI): 0.6746-0.8765], 수술 군에서 0.9488(95% CI: 0.8093-0.9870)였다(Fig. 2A). 5년 생존율은 3년 생존율과 같은 동일한 수치였다. 추가적으로 유도항암화학요법 후 동시항암방사선요법 또는 방사선치료 군, 유도항암화학요법 후 수술 군 2개 군의 생존율을 분석하였고, 유도항암화학요법 후 근치적 초치료에 따른 생존율 차이는 통계적으로 유의미하지 않았다(log rank p=0.9746)(Fig. 2B).
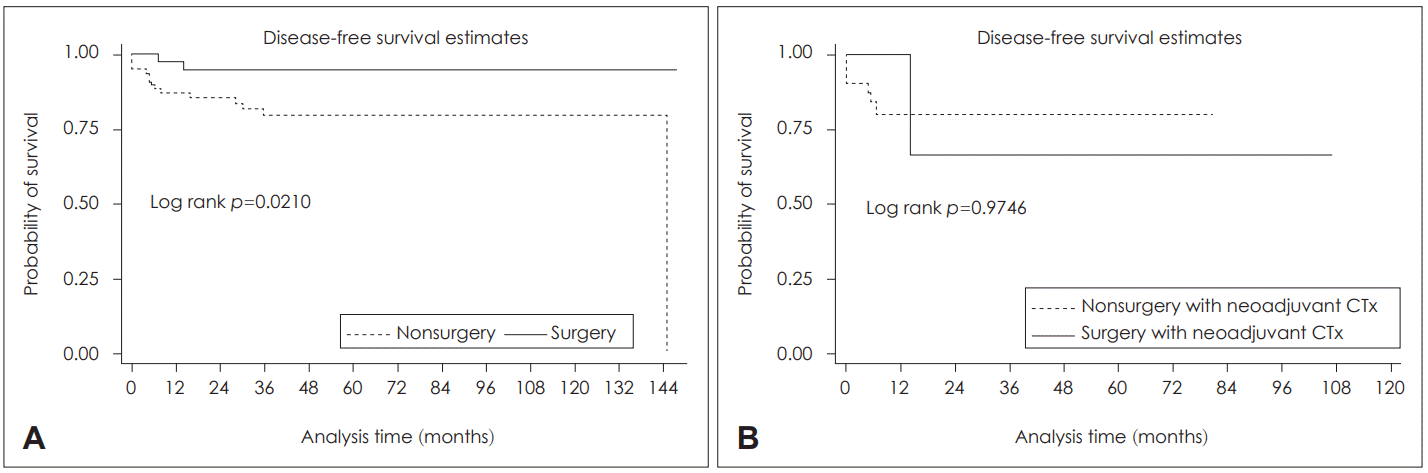
Kaplan-Meier survival analysis. Disease-free survival of nonsurgery group and surgery group (A). Disease-free survival of nonsurgery with neoadjuvant CTx group and surgery with neoadjuvant CTx group (B). CTx: chemotherapy.
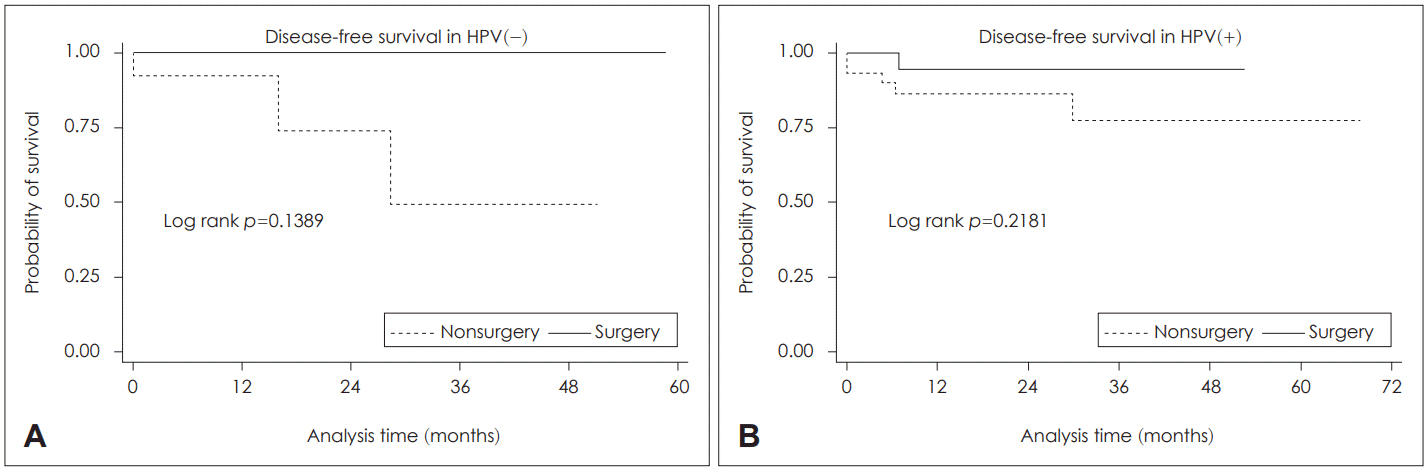
HPV에 따라 분석한 결과 군 간 유의한 차이는 없었다. 그러나 동시항암화학방사선요법 또는 방사선치료 군의 생존율은 HPV 음성인 군보다 HPV 양성인 군에서 비교적 좋은 경향을 보였다(Fig. 3).
기능적 결과
기능적 결과는 Table 5에 제시하였다. 기능적 결과를 보기 위해 영양 공급을 위한 입원 또는 위루관 삽입 여부를 조사하였다. 동시항암화학방사선요법 또는 방사선치료를 근치적 초치료로 선택한 군에서는 9.7%(8/82), 수술 군에서는 13.2%(7/53)가 근치적 초치료 이후 영양 공급을 위해 입원을 하거나 위루관 삽입을 하였다. 영구적인 위루관 삽입술을 시행한 비율은 동시항암화학방사선요법 또는 방사선치료 군에서 2.4%(2/82), 수술 군에서 3.7%(2/53)이었다. 하지만 각 군 간에 차이가 통계적으로 유의하지는 않았다(p=0.462).
치료기간
평균 치료기간은 동시항암화학방사선요법 또는 방사선치료 군이 92.6일[standard deviation(SD)=55.3], 수술 군이 79.6일(SD=107.9)로 동시항암화학방사선요법 또는 방사선치료 군의 평균 치료기간이 수술 군에 비해 길었으나 통계적 유의성은 없었다(p=0.3559).
유도항암화학요법을 시행한 경우 평균 치료기간은 117.2일(SD=34.0), 유도항암화학요법 없이 동시항암화학방사선요법 또는 방사선치료한 경우 75.7일(SD=59.9), 유도항암화학요법 없이 수술한 경우에는 76.1일(SD=113.6)로 유도항암화학요법을 시행한 경우에 평균 치료기간이 다른 두 경우에 비해 길었다(p=0.0253).
고 찰
본 연구에서는 단일 기관에서 14년간 치료한 구인두암 환자들의 초치료에 따른 치료 결과를 분석하였다. 마지막 경과 관찰 시 무병 생존인 상태인 환자는 유도항암화학요법 여부에 무관하게 근치적 초치료로 수술을 했을 경우가 97.8%로 가장 많았고, 동시항암화학방사선요법 또는 방사선치료를 받은 경우가 84.1%였다. 5년 생존율은 동시항암화학방사선 요법 또는 방사선치료 군에서 0.7963(95% CI: 0.6746-0.8765), 수술 군에서 0.9488(95% CI: 0.8093-0.9870)였다.
이전에는 구인두암에서 방사선치료 단독 또는 수술 후 방사선치료가 표준 치료였으나 수십 년 전부터 두경부암에서 비수술적 치료가 시작되었다. 1991년 발표된 후두암 환자에서의 무작위 대조시험(randomized controlled trial, RCT)에서는 항암화학요법 이후 방사선치료를 시행한 경우가 수술 후 방사선치료를 한 경우와 비교하여 생존율 차이 없이 후두를 보존하는 데 효과적이라는 결과를 보여주었다[12]. 이후 2003년 발표된 연구에서는 후두암에서 동시항암화학방사선요법이 수술 후 방사선치료보다 우수하다는 결과를 보여주었다[13]. 후두암에서의 결과에 이어 구인두암에서도 항암화학요법의 사용에 대한 연구가 진행되었다. 구인두암에서 방사선치료와 동시항암화학방사선요법을 비교한 RCT들에서는 방사선 단독 치료 군보다 동시항암화학방사선요법 군에서 생존율이 더 높은 결과를 보여주었다[14,15]. 그러나 수술과 동시항암화학방사선요법을 비교한 RCT는 거의 없었다. Boscolo-Rizzo 등[16]의 matched survival analysis에서는 진행된 구인두암 환자에서 유도항암화학요법/동시항암화학방사선요법 후 구제적 수술을 시행한 경우가 수술 후 방사선치료를 시행한 경우와 비교하여 생존율에 차이가 없다는 결과를 보여주었다. Kano 등[17]도 비슷한 디자인의 연구에서 역시 동시항암화학방사선요법이 수술과 비교하여 생존율 차이가 없고, 삼킴 기능의 경우 동시항암화학방사선요법 군에서 더 좋은 결과를 보여주었다.
그러나 최근 들어 경구강 수술 기술 및 재건의 발전으로 수술적 치료에서도 좋은 기능적 결과를 보여주고 있으며[18], 동시항암화학방사선요법의 장기적인 부작용에 대한 논란이 되면서 수술적 치료에 대한 선호도가 다시 증가하고 있다[19]. 또한 수술적 치료 후 기능적인 보존은 수술 후 방사선치료의 추가 여부에 따라서 유의한 차이를 보여준 바 있다[20,21]. 따라서 초기 암의 경우는 수술만으로 치료가 가능한 경우 좋은 기능적 결과와 짧은 치료기간을 기대할 수 있어서 본 기관에서는 T3N1(stage III) 이하인 경우에는 초치료로 수술적 치료를 추천하였다. 그 이유는 stage III까지는 가능한 수술 후 방사선치료를 하지 않으려고 하기 때문이었으나, 실제 수술 후 병리 결과에 따라 stage가 올라간 경우가 많아 stage IV A가 많은 비중을 차지하게 되었으며, 이에 따라서 술 후 방사선치료는 63.8%에서 시행하게 되었다. 유도항암화학요법은 진행된 병변에서 주로 시행되었으나, 본 연구에서는 생존에 유의한 이득은 보여주지 못하였다. 다만 유도항암화학요법을 시행할 경우 84.2%에서 부분관해 이상의 반응을 보여 항암치료에 대한 좋은 효과를 확인하였다. 유도항암화학요법 이후 동시항암화학방사선요법 혹은 방사선치료한 경우와 유도항암화학요법 없이 동시항암화학방사선요법 혹은 방사선치료를 시행한 경우 완전관해율에 차이는 없었다. 유도항암화학요법 시행 여부에 무관하게 동시항암화학방사선요법 혹은 방사선 치료에서 완전관해를 75.6%(62/82)에서 얻을 수 있었고, 완전 관해를 이루지 못한 20명 중에서 14명은 구제수술이 가능하였으며(70%) 구제수술률도 해외의 보고보다 높음을 확인할 수 있었다[22,23]. 이런 차이는 주기적인 검사로 재성장을 조기에 발견하는 것이 중요한 역할을 한 것으로 생각한다.
생존 분석으로는 동시항암화학방사선요법 또는 방사선치료 군, 수술 군의 두 개 군으로 나누어 생존율을 비교하였고, 수술 군이 동시항암화학방사선요법 또는 방사선치료 군에 비해서 생존율이 좋은 것으로 나타났다. 이는 군 간에 TNM 병기에 유의한 차이가 있는 것으로 분석되어 그 영향이 있을 것으로 생각된다. 이에 Cox hazard regression model을 사용하여 병기 등을 보정한 생존 분석을 시행하였으나 통계적으로 의미 있는 결과는 나오지 않아 본 논문에서는 제시되지 않았다. 추가적으로 유도항암화학치료 시행 후 동시항암화학방사선요법 또는 방사선치료 군과 유도항암화학 치료 시행 후 수술 군의 생존 분석도 시행하였고 통계적으로 유의미한 결과는 나오지 않았다.
환자 상담에 있어서 원발부위와 경부림프절 전이의 완전관해 비율을 예측하여 실제적인 기대치를 가지게 하는 것이 중요하다. 따라서 본 연구에서는 근치적 초치료로 동시항암화학방사선요법 혹은 방사선치료를 받은 환자에서 원발부위의 완전관해 비율과 경부림프절의 완전관해 비율을 각각 제시하였다. 분석 결과에 의하면 T4나 N3에서는 완전관해가 오지 않았을 때 구제수술을 시행한 비율이 50%밖에 되지 않았으므로 초치료 결정에 더욱 신중해야 한다.
최근 구인두암의 증가는 HPV 양성 구인두암의 증가와 관련되어 있으며, HPV 양성 구인두암 환자들은 더 나은 예후를 보인다[3]. 예후 인자로써 HPV의 역할은 비교적 최근 강조되었기 때문에 본 기관에서도 최근 치료받은 환자들의 경우만 HPV 여부를 알 수 있었기 때문에 연구 대상의 47.4%에서는 HPV 결과를 알 수 없었다. 따라서 HPV 여부를 알 수 있는 71명을 대상으로 분석한 결과 통계적으로 유의성은 없었으나 동시항암화학방사선요법 또는 방사선치료 군의 생존율이 HPV 음성인 군보다 HPV 양성인 군에서 비교적 좋은 경향을 보였다. 이는 HPV 양성 구인두암에서 동시항암화학방사선요법에 더 잘 반응한다는 기존 연구들의 결과와 일치한다[2,24,25].
구인두암에서는 치료적 결과가 동등한 근치적 초치료 방법들이 있기 때문에 치료법에 따른 기능적 결과 및 삶의 질이 선택의 중요한 기준 중 하나이고, 따라서 이에 대한 연구들이 진행되어 왔다. Allal 등[6]의 연구에서는 방사선치료 또는 동시항암화학방사선요법 군 대 수술 군의 삶의 질 지표를 비교하였고, 그 결과 조기 병기에서는 치료법에 따른 삶의 질 차이가 없었으나, 진행된 병기에서는 동시항암화학방사선요법 또는 방사선치료 군의 삶의 질이 수술 군에 비해 더 좋은 결과를 보였다. 구인두암 치료를 받은 환자에서 기능적 결과로는 삼킴 기능이 중요하다. Gillespie 등[26]의 단면 연구에 의하면 구인두암의 장기 생존자에서 동시항암화학방사선요법을 한 경우가 수술 후 방사선치료를 받은 경우 보다 삼킴 관련 삶의 질에서 더 좋은 결과를 보였다. 하지만 동시항암화학방사선요법 또는 방사선치료에 의한 급성 독성으로 인한 연하 곤란으로 위루관 영양을 필요로 하게 되는 경우도 많다[27]. 본 연구에서는 기능적 결과를 영양 공급을 위한 입원 또는 위루관 삽입 여부로 평가하였으나 근치적 초치료에 따른 기능적 결과가 통계적으로 유의하지 않았으며, 동시항암화학방사선요법 또는 방사선치료 군에서 9.7%, 수술 군에서 16.9%의 위루관 삽입비율을 보여, 앞의 논문과 비교 시 위루관 삽입비율은 낮았으며, 이들도 대개는 일시적인 위루관이고 영구 위루관 삽입비율은 동시항암화학방사선요법 또는 방사선 치료 군에서 2.4%, 수술 군에서 3.7%에서만 있었다.
암 치료에서 치료기간은 환자의 삶의 질과 예후에 영향을 미칠 수 있으므로, 본 연구에서는 근치적 초치료에 따른 치료기간을 비교하였다. 동시항암화학방사선요법 또는 방사선치료 군에서 92.6일, 수술 군에서 79.6일으로 수술 군에서 평균 치료기간이 짧았지만 통계적인 유의성은 없었다. 그러나 유도항암화학요법을 시행한 경우 117.2일로 그렇지 않은 경우에 비해서 평균 치료기간이 길었고 통계적으로 유의했다.
본 연구는 본 기관의 14년간의 구인두암 환자의 치료적 결과 및 기능적 결과를 분석했다는 데에 그 의의가 있으나 다음과 같은 한계점이 있다. 첫째, 연구 대상의 수가 작아 통계적으로 유의한 결과들을 얻어내기 어려웠다. 둘째, 생존 분석 시에 병기를 포함한 교란 변수를 보정하지 못해 결과 해석에 제한이 있었다. 셋째, 의무 기록을 이용한 후향적 연구이기 때문에 HPV 여부 등 분석에 필요한 모든 정보를 얻는데 제한이 있었다. 추후 더 많은 연구 대상을 이용하여 후속 연구가 필요할 것으로 생각한다.
본 연구를 통하여, 구인두암 환자에서 다학제 접근을 통하여 87.4%의 높은 치료율을 확인할 수 있었으며, 적절히 선택된 환자에서는 수술적 치료를 근치적 초치료로 선택함으로써 30% 정도의 경우 방사선치료를 피할 수 있었다. 동시항암화학요법 또는 방사선치료를 근치적 초치료로 선택한 경우 75.6%에서 완전관해를 얻을 수 있었고 완전관해를 얻지 못한 경우 70%에서 구제수술이 가능하였다. 이러한 내용들은 구인두암 환자의 치료계획 결정 및 환자 상담에 활용할 수 있을 것으로 기대한다.