마누카꿀이 TGF-β1에 의한 비용 섬유모세포의 세포외기질 생성에 미치는 영향
Effect of Manuka Honey on Transforming Growth Factor Beta-1-Induced Extracelluar Matrix Production in Nasal Polyp Derived Fibroblasts
Article information
Trans Abstract
Background and Objectives
Manuka honey has anti-microbial, anti-inflammatory, and anti-proliferative action with a high concentration of methylglyoxal compound. It is also effective in killing Staphylococcus aureus biofilm and effective for the acute exacerbation of chronic rhinosinusitis. The aim of this study was to determine the anti-fibrotic effect of manuka honey in nasal polyp fibroblasts.
Materials and Method
Primary nasal fibroblasts were isolated from nasal polyps and treated with transforming growth factor-beta 1 (TGF-β1). To determine the anti-fibrotic effect of manuka honey, fibroblasts were pre-treated with various concentration of the honey. Reverse transcription-polymerase chain reaction and western blot analysis were then performed to determine α-smooth muscle actin (α-SMA), collagen type I, and matrix metalloproteinase-9 (MMP-9) messenger ribonucleic acid (mRNA) expression and protein production in nasal polyp fibroblasts. Phosphorylated Smad (pSmad) 2/3 and phosphorylated adenosine monophosphate-activated protein kinase (pAMPK) were then determined by western blotting.
Results
TGF-β1 stimulation increased α-SMA, collagen type I, and MMP-9 mRNA expression and protein production in nasal polyp fibroblasts. Manuka honey effectively suppressed α-SMA, collagen type I, and MMP-9 mRNA expression and protein production. Its inhibitory role on TGF-β1 induced myofibroblast differentiation and its extracellular matrix production was associated with Smad2/3 and AMPK pathway.
Conclusion
Manuka honey can inhibit TGF-β1 induced myofibroblast differentiation, collagen type I, and MMP-9 production in nasal fibroblasts. These results suggest that manuka honey might be a useful candidate for the inhibition of nasal polyp formation if further studies in vivo were accompanied.
서론
만성 비부비동염은 비부비동 점막에 발생하는 염증성 질환으로 알레르기, 점액섬모수송 장애, 해부학적 혹은 면역학적 이상 등이 관여하는 다인성 질환으로 발병기전에 대한 논란이 지속되고 있다 [1]. 조직내 염증세포의 침윤, 기저막 비후와 세포외기질의 축척은 만성 비부비동염의 특징적 소견으로 비용을 동반하지 않은 경우 matrix metalloproteinase-9(MMP-9), tissue inhibitors of matrix metalloproteinase-1(TIMP-1), transforming growth factor-beta(TGF-β)가 증가되나 비용을 동반한 경우 MMP-9은 증가하지만 TIMP-1과 TGF-β는 상대적으로 낮게 발현된다 [2,3]. 하지만 비용조직에서 TGF-β의 발현이 증가되어 있다는 보고도 있는데 이는 비용조직 내 호산구, vascular endothelial growth factor 등이 관여하고 있다. 4,5) TGF-β는 조직내 섬유모세포의 분화와 세포외기질 단백의 합성을 유도하여 만성 비부비동염과 비용 형성에 관여한다.
벌꿀은 기원전부터 감염된 상처나 위장관 질환의 치유와 신경계 증상 개선 등을 위해 민간에서 사용되어 왔다. 20세기에 들어와 벌꿀의 상처 치유 과정에 과학적 근거가 보고 되면 서 다양한 항균, 항염증 효과에 대한 연구들이 진행되었다[6,7]. 특히 뉴질랜드 마누카꿀은 세균의 성장을 억제하거나 파괴하 고, 심한 화상이나 당뇨성 궤양 치료 효과를 가지는 등 임상적 활용 가능성에 대한 연구가 이루어져 왔다[8,9]. 마누카꿀에 포함되어 있는 메틸글리옥살(methylglyoxal) 화합물에 의해 항균, 항염증 효과를 가지며, Staphylococcus aureus에 의해 형성된 생물막(biofilm)에 대한 항균효과가 입증되어 만성 비 부비동염의 치료제로서의 활용 가능성이 보고되었다[10].
만성 비부비동염에서 collagen, MMP-9, TIMP-1 등은 조직 재형성에 중요한 역할을 담당하며 이들은 피부 조직의 재생에도 관여한다. 즉, 벌꿀이 피부 상처 치유 효과를 가지듯이 손상된 비부비동 점막의 재형성에도 관여할 것이라는 가정하에 본 연구를 진행하였다[11]. 항염증 효과를 가지는 마누카꿀이 비용-유래 섬유아세포의 분화와 세포외기질 생성에 미치는 영향을 알아보고자 하였다.
재료 및 방법
마누카꿀의 준비
벌꿀은 뉴질랜드 Honey NZ International Ltd(Hamilton, New Zealand)에서 제공한 마누카꿀을 사용하였다. 꿀은 25 kGy의 코발트-60 방사선 조사장치에서 발생하는 감마선을 이용하여 소독하였으며, 1.37 g의 꿀을 19 mL의 RPMI 1640 (GIBCO, Grand Island, NY, USA)에 섞어 최종 농도 5% v/v을 준비하였다. 꿀에 포함되어 있는 꽃가루, 벌 조직 등은 Minisart Sartorius filter(Millipore Corp., Seattle, WA, USA)를 사용하여 제거하였다. 꿀이 포함하고 있는 효소의 변성과 분해를 방지하기 위해 실험이 진행될 때까지 어두운 용기에 넣어 4℃에 보관하였다.
비용 섬유아세포의 분리배양
섬유아세포는 부비동 내시경수술을 시행한 비용을 동반한 만성 비부비동염 환자 10명(남성과 여성 각 5명, 평균 연령 38.9 ±9.7세)의 비호산구성 비용조직에서 분리하여 사용하였다. 비용 조직의 특성은 Tokunaga 등12)이 보고하였던 Japanese Epidemiological Survey of Refractory Eosinophilic Chronic rhinosinusitis score를 기준으로 결정하였다. 연구는 대구가톨릭대학교병원 임상시험윤리위원회의 승인을 얻어 진행되었다. 대상자에게는 연구의 목적과 방법 등에 대한 정보를 제공하고 서면 동의서를 받았다. 만성 비부비동염의 진단은 2012년도에 발표된 European Position Paper on Rhinosinusitis and Nasal Polyps에서 제시한 기준13)에 따랐으며, 수술 전 적어도 4주 이내에 상기도 감염이 있었거나, 항생제나 항히스타민제의 사용 혹은 경구나 비강 스테로이드제를 사용한 환자, 알레르기를 동반한 환자는 대상에서 제외하였다.
비용조직은 0.3~0.5 mm의 절편을 만들어 인산완충생리식염수(phosphate buffered saline, PBS)에 세척 후 10% 소태아 혈청, 100 U/mL의 penicillin, 100 ug/mL의 streptomycin, 1.5 ug/mL의 amphotericin B를 포함하고 있는 Dulbecco’s Modified Eagle’s Medium F-12(Gibco, Grand Island, NY, USA)에 넣고, 37℃, 5% CO2에서 배양하였다. 단층을 형성하면 PBS로 세척 후 0.05% trypsin-ethylene diamine tetraacetic acid (Sigma-Aldrich, St. Louis, MO, USA)로 5분간 처리하여 분리 배양하였다. 연구에는 3~4세대째 계대배양된 섬유아세포를 사용하였다.
마누카꿀이 비용 섬유아세포의 세포증식에 미치는 영향
마누카꿀의 세포독성은 CellTiter-96Ⓡ AQueous one solution cell proliferation assay kit(Promega Corp., Madison, WI, USA)를 이용하여 측정하였다. 배양된 섬유아세포에 대한 세포독성을 확인하기 위하여 0.5%, 2%, 5%의 꿀로 24시간 동안 37℃, 5% CO2에서 처리 후, 배양액을 PBS로 3회 세척하였다. 세포 증식의 확인을 위하여 tetrazolium 합성물 2 mL과 phenazine ethosulfate 100 uL를 섞은 후 well당 20 uL의 혼합용액을 투여하여 1시간동안 배양 후 490 nm의 ELISA reader(Modecular Devices, San Jose, CA, USA)를 사용하여 흡광도를 측정하였다.
마누카꿀이 비용 섬유아세포의 α-SMA, collagen type I, MMP-9 mRNA 발현에 미치는 영향
섬유아세포의 α-smooth muscle actin(α-SMA), collagen type I, MMP-9 messenger ribonucleic acid(mRNA) 발현을 확인하기 위하여 섬유아세포를 0.5%, 1%, 2%의 마누카꿀로 1시간 처리하거나 전처리 없이 TGF-β1로 24시간 배양 후 세포를 분리하였다. 세포가 녹아있는 TrizolⓇ(GIBCO) 용액을 가압 멸균된 RNA 미세원심 분리시험관에 넣고 200 μL의 클로로포름을 첨가 후 흔들어 잘 섞이게 하고 13000 rpm으로 15분간 원심 분리하여 상층액에서 500 μL를 취하였다. 상층액과 동량의 isopropanol을 넣고 잘 섞어 10분간 방치 후 13000 rpm으로 10분간 원심 분리하였다. 얻어진 RNA 침사를 70% 에틸알코올로 세척한 후 diethyl pyrocarbonate를 처리한 증류수 10 μL로 RNA 침사를 녹여서 RNA를 추출하였다.
추출한 RNA를 대상으로 reverse transcription system (Promega Corp.)을 이용하여 cDNA를 합성하였다. 역전사 중합효소연쇄반응(reverse transcription-polymerase chain reaction, RT-PCR)의 조건은 다음과 같다. 5 mM MgCl2, 10 mM Tris-HCl(pH 9.0, 25℃), 50 mM KCl, 0.1% triton X-100, 각각의 dNTP 1 mM, 1 U/μL Ribonuclease inhibitor, 20 U AMV reverse transcriptase, 0.5 μg oligo(dT)15 primer로 구성된 중합효소연쇄반응 시약에 RNA 9.5 μL를 주입하여 총 20 μL를 DNA thermal cycler 480(PE Applied Biosystems, Foster City, CA, USA)으로 증폭하였다. 25℃에서 10분간 반응시킨뒤 42℃에서 60분간 방치하고 72℃에서 5분간 방치하여 역전사효소를 무력화시킨 뒤 4℃로 냉장시켰다.
합성된 cDNA를 대상으로 α-SMA, collagen type I, MMP-9과 β-actin의 정량적 중합효소연쇄반응을 MJ Mini personal Thermal cycler(Bio-Rad, Hercules, CA, USA)로 실시하였다. 중합효소연쇄반응에 사용되는 시약은 TB GreenTM Premix Ex TaqTM(Takara Bio Inc., Otsu, Japan)을 사용하였다. DNA가 증폭되면 SYBRⓇ green(Applied Biosystems, Waltham, MA, USA)과 결합하여 형광을 발생, 중합효소연쇄반응의 각 주기마다 닫혀져 있는 시험관의 마개를 통하여 형광의 세기를 측정함으로써 중합효소연쇄반응 산물을 정량적으로 나타낼 수 있다. 즉, 주입한 DNA 양이 많을수록 형광이 처음으로 검출되는 연쇄반응 주기의 시점이 빨라지고 이를 threshold cycle 수로 나타낸다. α-SMA, collagen type I, MMP-9과 βactin의 발현을 위해 95℃에서 1분간 반응시킨 다음, 변성 95℃ 15초, 결합 54~60℃ 15초, 72℃ 45초로 40회 동안 증폭하였다. 사용한 primer의 유전자 위치, 염기서열, 증폭 산물의 크기는 Table 1과 같다
마누카꿀의 비용 섬유아세포 α-SMA, collagen type I, MMP-9 단백 발현에 미치는 영향
섬유아세포의 단백발현은 각각의 조건으로 배양된 세포에서 western blot을 이용하여 측정하였다. 세포는 100 uL의 RIPA 완충액(150 mM NaCl, 1% NP40, 0.5% deoxycholate, 0.1% sodium dodecyl sulfate, and 50 mM Tris-Cl)을 이용하여 단백질을 분리하였다. 분리된 단백질은 BCA protein assay reagent kit(Pierce Biotechnology, Rockford, IL, USA)를 이용하여 측정하였다. 정량한 sample을 같은 양으로 NuPAGE 4~12% Bis-Tris gel(Invitrogen)에 전기영동한 후 Xcell Surelock(Invitrogen)을 이용하여 nitrocellulose membrane에 1시간 transfer하였다. Transfer가 끝난 membrane을 세척한 후, membrane blocking solution(Invitrogen)에서 1시간 동안 처리하였다. 준비된 membrane에 α-SMA, collagen type I, MMP-9과 GAPDH 항체(Santa Cruz Biotechnology, Santa Cruz, CA, USA)를 1:1000으로 희석하여 처리하고 4℃에서 밤새 반응시켰다. 다음날 goat anti-rabbit HRP-conjugated된 이차 항체(Santa Cruz Biotechnology)를 1:3000으로 희석하여 상온에서 1시간 반응시켰다. 이 후 SuperSignal West Pico Chemiluminescent Substrate(Pierce Biotechnology) 이용하여 발색시켜 Gel Doc XR+(Bio-Rad)로 단백 발현량을 확인하였다.
마누카꿀이 비용 섬유아세포 Smad 2/3와 adenosine monophosphate-activated protein kinase(AMPK) 발현에 미치는 영향
비용 섬유아세포에서 발현하는 phosphorylated Smad (pSmad) 2/3과 AMPK는 western blot을 이용하여 측정하였다. 섬유아세포를 마누카꿀로 1시간 전처리하거나 전처리 없이 TGF-β1로 6시간 배양 후 세포를 획득하였다. 이들 전사인자의 발현은 위와 동일한 방법으로 western blot을 이용하여 측정하였다.
통계 분석
각각의 실험은 5회 이상 반복하여 그 결과를 얻고자 하였으며 마누카꿀의 세포독성은 1개 요소 분산값(one factor repeated measure analysis)을 이용하였으며, 비강 섬유아세포의 세포외기질과 전사인자 발현은 Kruskal-Willis test를 사용하여 분석하였다(SPSS ver. 21.0, IBM Corp., Armonk, NY, USA). 통계학적 유의수준은 0.05로 하였다.
결 과
마누카꿀의 섬유아세포에 대한 세포독성
0.5%, 2%, 5%의 마누카꿀과 섬유아세포를 1시간, 6시간, 24시간 배양하였으며, 5%의 농도에서 배양 6시간(27%)과 24시간(38%)에서 세포분화가 감소하는 독성을 보여 이후 진행되는 실험은 2% 이하의 농도에서 시행되었다(Fig. 1).

Effect of manuka honey on proliferation of nasal polyp fibroblasts. Fibroblasts were treated with various concentrations of manuka honey for 24 hours. 5% of acacia honey inhibited the proliferation of nasal fibroblasts. *p<0.05. NT: non-treated control.
마누카꿀이 비용 섬유아세포 α-SMA, collagen type I, MMP-9 mRNA와 단백 발현에 미치는 영향
섬유아세포를 0.5%, 1%, 2%의 마누카꿀로 전처리 하거나, 꿀로 처리하지 않은 상태에서 5 ug/mL의 TGF-β1와 배양 후 mRNA는 RT-PCR을 이용하여, 단백 생성은 western blot 분석을 이용하여 확인하였다. TGF-β1은 섬유아세포의 α-SMA, collagen type I, MMP-9 mRNA와 단백 발현을 증가시켰고, TGF-β1에 의한 α-SMA mRNA 발현은 마누카꿀 2%에서 40.5%, collagen type I과 MMP-9 mRNA는 마누카꿀 0.5%에서 각각 51.4%와 51.6%로 강하게 발현이 억제되었다. 섬유아세포의 단백 생성은 α-SMA와 collagen type I의 경우 마누카꿀 1%에서 각각 42.6%와 40.5%, MMP-9은 2%에서 42.1%로 가장 많이 억제되었다. 섬유아세포를 전처리한 마누카꿀의 농도가 mRNA와 단백 생성 억제 효과에 유의한 영향을 미치지는 않았다(Fig. 2).
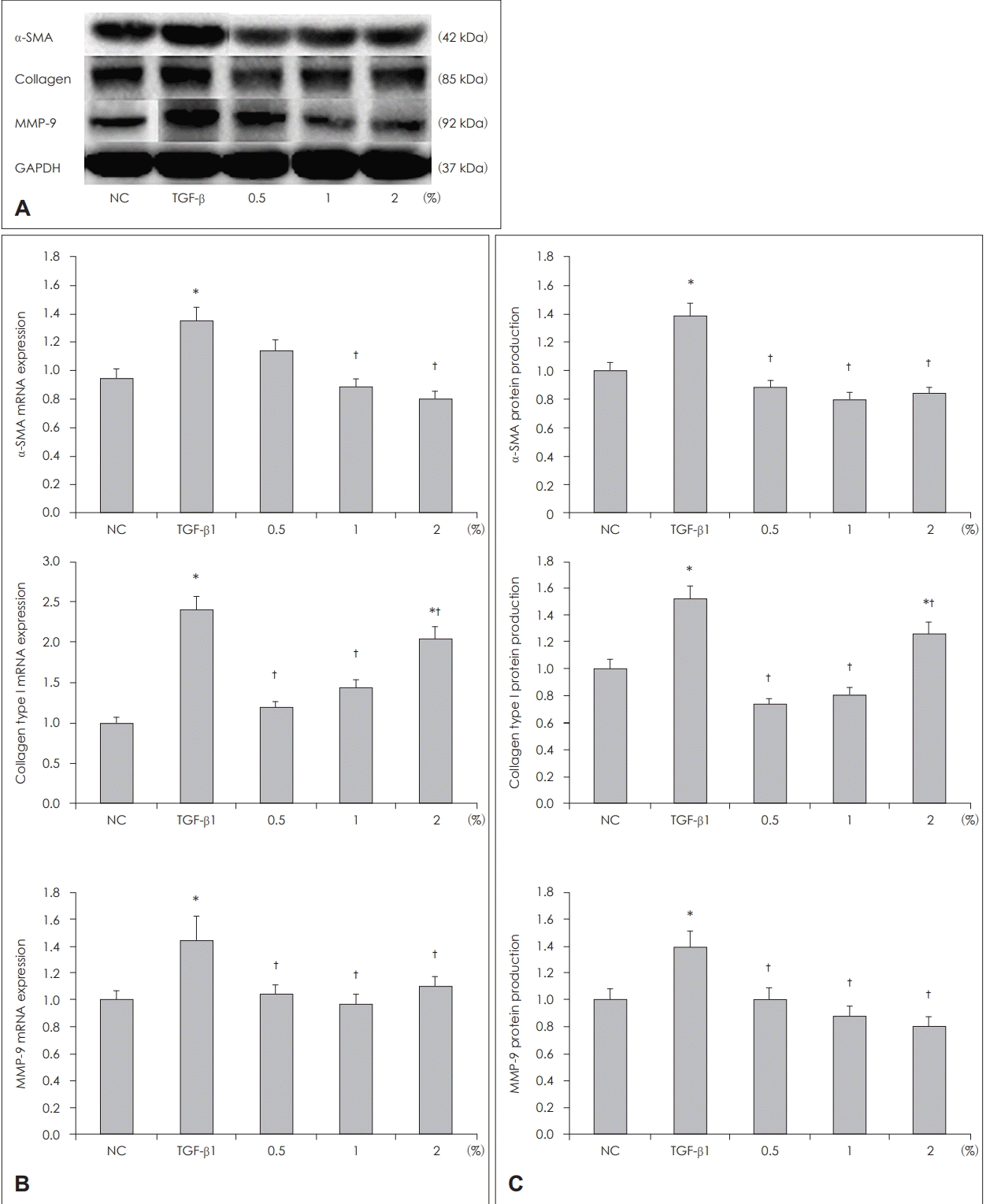
Effect of acacia honey on expression of TGF-β1 induced α-SMA, collagen type I, and MMP-9 mRNA (B) and protein (C) in nasal polyp fibroblasts. TGF-β1 induced α-SMA, collagen type I, and MMP-9 mRNA and protein expressions were significantly suppressed by manuka honey. A shows representative results of western blot analysis. *p<0.05 compared with the negative control, †p<0.05 compared with TGF-β1 treated group. α-SMA: α-smooth muscle actin, GAPDH: TGF-β1: transforming growth factor-beta1, MMP-9: matrix metalloproteinase-9, mRNA: messenger ribonucleic acid, NC: negative control.
마누카꿀이 비용 섬유아세포 pSmad 2/3와 pAMPK 발현에 미치는 영향
섬유아세포를 0.5, 1, 2%의 마누카꿀로 전처리 하거나, 꿀로 처리하지 않은 상태에서 TGF-β1와 배양 후 pSmad 2/3와 pAMPK를 western blot 분석을 이용하여 확인하였다. TGFβ1은 섬유아세포의 pSmad 2/3의 발현을 유의하게 증가시켰으며, 마누카꿀로 전처리하는 경우 각각의 농도에서 pSmad 2/3 발현이 유의하게 감소하였다. pAMPK의 경우 TGF-β1에 의해 유의한 발현 증가는 없었으나 마누카꿀 0.5%와 1%로 처리한 경우 음성대조군에 비해 약 2.4배 이상 발현이 증가하였으며, TGF-β1으로 처리한 경우 보다 1.67배 이상 증가하였다(Fig. 3).

Effect of manuka honey on pSmad 2/3 and pAMPK expression in nasal polyp fibroblasts. pSmad 2/3 and pAMPK were measured using western blotting and density analysis. A shows representative results of western blot analysis. TGF-β1 induced Smad 2/3 phosphorylation was significantly inhibited by manuka honey (B) and AMPK expression was significantly increased (C) by manuka honey. *p<0.05 compared with the negative control, †p<0.05 compared with TGF-β1 treated group. pSmad 2/3: phosphorylation of Smad 2/3, pAMPK: phosphorylated adenosine monophosphate-activated protein kinase, TGF-β1: transforming growth factor-beta1, NC: negative control.
고 찰
만성 비부비동염은 국소 염증반응에 의한 조직내 염증세포의 침윤과 세포외기질의 축적에 의한 조직재형성을 특징으로 한다. TGF-β는 면역조절 기능을 가지고 있으며 근섬유모세포의 분화와 세포외기질 생성에 중요한 역할을 담당한다. 본 연구에서도 TGF-β1과 함께 배양한 비용 섬유아세포에서 α-SMA, collagen type I, MMP-9의 mRNA와 단백 발현이 증가하였으며, 마누카꿀로 전처리 한 경우 이들 mRNA와 단백 발현이 유의하게 감소함을 확인할 수 있었다. 이는 마누카 꿀이 비용 조직의 근섬유모세포(myofibroblast) 분화와 세포외기질 생성을 억제할 수 있음을 의미하는 것이다. 본 연구에서는 섬유아세포를 비용 조직에서 분리 배양하여 사용하였는데, 이는 정상인과 비용 환자의 비강 섬유아세포의 세포외기질 생성과 그 발현 기전에 차이가 없다는 기존의 연구 결과를 근거로 하였다[14].
벌꿀의 삼투압, 수소이온 농도, 과산화효소(peroxidase) 활성도, 메틸글리옥살 함량 등에 의해 면역학적 특성이 결정되는데, 인체내에서 면역 억제 뿐만 아니라 면역 활성화를 유도 할 수 있다[9,14]. 대부분의 벌꿀은 지질다당류를 포함하고 있으나 면역학적 영향을 미칠 정도의 양은 아니며, 벌꿀에 포함되어 있는 꽃가루와 꿀 처리과정의 오염 문제를 해결하기 위해 감마선 조사와 필터 처리 후 사용하였다. 벌꿀의 항균, 항염증 효과는 조직 재생을 촉진하고, 상피세포를 형성시키며, 반흔 형성을 최소화 시켜주는 특성을 이용하여 창상치유에 사용되어 왔으며, 항산화, 항균 등의 특성을 가지고 있다[7-9]. 특 히 뉴질랜드에서 생산되는 마누카꿀은 다량의 메틸글리옥살을 함유하고 있어 강력한 항균, 항염증 효과를 가지고 있어 많은 연구가 이루어져 왔다[10,15]. 마누카꿀의 Staphylococcus aureus와 Pseudomonas aeruginosa에 의해 만들어지는 생물막에 대한 효과를 보고하면서 만성 비부비동염의 치료제로서의 활용 가능성이 제시 되기도 하였다[16]. 이처럼 마누카꿀의 항염증, 항균 효과에 대한 다양한 보고는 있었으나 조직재형성에 대한 연구는 부족하여 마누카꿀의 만성 비부비동염 조직 재형성에 미치는 영향을 확인하기 위하여 본 연구를 진행하였다.
TGF-β1은 만성 비부비동염 조직에서 증가되어 있으며, 섬유아세포의 분화를 유도하고 α-SMA과 collagen의 생성을 유도하는 것으로 알려져 있다[17]. 이처럼 TGF-β1은 근섬유모세포의 마커인 α-SMA의 발현을 증가시키고, 세포외기질 단백의 합성을 통한 조직 재형성을 유도하여 만성 비부비동염, 비용, 기관지 천식과 같은 호흡기 질환의 병태생리에 관여하게 된다[2,3,18]. 만성 비부비동염의 경우 세포외기질에 두꺼운 콜라겐 섬유를 형성하고 있는 특징을 가지고 있으며, MMP-9과 TGF-β1이 조직내에서 증가하는 것이 관찰된다[2,3,17]. Smad2/3의 인산화는 TGF-β1에 의한 섬유아세포의 근섬유모세포로의 분화와 세포외기질 단백 합성에 중요하게 관여하는 전사인자이다[14]. Smad2/3은 α-SMA의 발현을 증가시키고, 각종 세포외기질의 생성을 유도하게 된다. AMPK는 에너지대사, 세포 분화와 화학 매개 물질의 생성, 세포자연사와 염증반응에 관여한다[19]. 비용 섬유아세포에서 AMPK가 TGFβ1에 의한 근섬유모세포의 분화를 억제하고 세포외기질 생성을 억제하는 것으로 보고 되었다[20]. 마누카꿀은 0.5% 이상의 농도에서 pSmad 2/3의 발현을 억제하였을 뿐 아니라 pAMPK의 발현을 증가시켰다. 이는 마누카꿀이 섬유아세포의 세포외기질 생성에 관여하는 두 전사인자에 동시에 작용하는 이중작용(dual action) 효과를 나타내는 것으로 마누카꿀이 강력한 항섬유화 효과를 가지고 있음을 알 수 있었다. 하지만 TGF-β1에 의한 collagen type I이나 MMP-9의 생성 억제 효과와 전사인자 발현 억제가 마누카꿀의 농도와는 연관성을 보이지 않았다. 향후 마누카꿀의 항섬유화 효과를 얻을 수 있는 최적의 농도 결정과 마누카꿀에 의한 Smad2/3과 AMPK의 작용 기전에 대한 추가적인 연구가 필요할 것이다.
마누카꿀은 만성 비부비동염의 발병과 관련이 있는 Staphylococcus aureus에 대한 항균효과 뿐 아니라 비강 세척을 통해 만성 비부비동염의 급성 악화가 있는 환자에 대한 치료 효과가 입증되어 임상적 활용 가능성이 제시되고 있다[16,21]. 본 연구를 통해 마누카꿀이 비용 섬유아세포의 근섬유모세포 분화와 세포외기질 생성을 억제할 수 있음이 확인되었다. 향후 마누카꿀의 임상적 활용을 위해서는 생체 내 실험을 통한 섬유화 억제 효과의 입증이 필요하며, 만성 비부비동염 발병 억제 효과와 마누카꿀의 국소 비강 치료제로의 활용 가능성을 확인하기 위한 추가적인 연구가 필요할 것이다.

