N1 활동성으로 나타난 성인 인공와우 사용자의 청각정보 처리 능력과 반구상 비대칭
Auditory Cortical Temporal Processing and Hemispheric Asymmetry Revealed by N1 Dipole Source Activity in Adult Cochlear Implant Users
Article information
Trans Abstract
Background and Objectives
Cochlear implant (CI) changes the way that sound inputs are processed in the brain, possibly causing brain reorganization. Given that the pattern and degree of reorganization are known to be related to speech perception skill, information regarding hemispheric asymmetry can be used to predict behavioral performances in CI users. The current study investigated the hemispheric asymmetry of N1 dipole cortical activity in response to the temporally varied speech sounds and its relationship to speech perception abilities in adult CI users.
Subjects and Method
The cortical activity was recorded from 64 scalp electrodes in 10 CI users and 11 normal-hearing controls. Speech stimuli were synthesized consonant-vowels, the /ba/-/pa/ continuum that ranged from 0 to 50 ms with a 6-step voice onset time (VOT). N1 dipole amplitudes, latencies, and locations were analyzed as a function of VOT and the direction of implantation. Also investigated was the relationship between N1 dipole lateralization and speech perception.
Results
For the N1 dipole location, significant location differences between CI and normal hearing groups were seen at 40 ms VOT in the anterior-posterior direction. For hemispheric asymmetry, the N1 dipole activity in good CI performers was higher in the auditory cortex contralateral to the stimulated ear, while poor CI performers showed greater ipsilateral activity. In addition, a lateralization index at 20 ms VOT showed significant correlation with the /ba/-/pa/ consonant perception scores in noise.
Conclusion
The results suggest that the hemispheric asymmetry of N1 dipole activity in response to stimuli of temporally varied speech has a substantial clinical value, and that this can be used to estimate CI speech perception.
서 론
인공와우(cochlear implant)는 고심도 감각신경성 난청자를 대상으로 청각(hearing sensation)을 되살릴 수 있는 유일한 방법으로 현재까지 전 세계적으로 많은 청각장애인들에게 적용되어 왔다. 인공와우의 사용은 단순히 말초적인 청감각을 되살릴 뿐만 아니라, 새로운 청각 신호의 유입을 통한 대뇌피질 가소성(cortical plasticity)을 유도하여 대뇌피질 재조직화를 유발하는 것으로 알려져 있다[1]. 특히, 인공와우 사용으로 유발된 대뇌피질 재조직화에 의해 뇌 활동성이 왼쪽 혹은 오른쪽으로 치우치는 현상을 의미하는 반구상 비대칭(hemispheric asymmetry) 또한 바뀐다는 연구 결과가 발표된바 있다[2]. 정상 청력인의 경우 소리 자극을 한쪽 귀에 제시하였을 경우 자극음을 제시한 방향과 동일한 반구, 즉 동측(ipsilateral) 보다 대측(contralateral) 반구의 청각 피질에서 더 큰 반응성을 보이는 것으로 보고되어 왔다[3]. 반면 인공와우 사용자는 인공와우 착용 방향, 인공와우 이식 시기, 인공와우 이식 순서, 그리고 청각 손실의 기간과 같은 요인에 따라 반구상 비대칭의 패턴이 달라지는 것으로 나타났다[4].
인공와우 사용자의 대뇌피질 재조직화를 살펴본 선행연구들에 의하면 인공와우 이식 시기와 양측 인공와우 사용 여부가 반구상 비대칭의 변화에 영향을 미친다고 보고하였다[4]. 이러한 반구상 비대칭의 변화는 특히 인공와우를 이식한 아동 혹은 청소년에게 두드러지게 나타났다. P1 쌍극자 신호원을 이용하여 대뇌피질 재조직화를 측정한 한 연구에 따르면, 한쪽 인공와우를 이식한 후 단기간 내에 다른 쪽에도 인공와우를 이식하거나, 양측 인공와우를 동시에 이식한 아동들은 정상적인 수준의 대측 활동성을 보인 반면, 오랜 기간 동안 편측 인공와우를 착용한 아동에서는 대측 대뇌피질 활동성이 비정상적으로 높게 나타났고, 이러한 패턴이 강하게 나타날수록 말지각력 점수는 낮게 나타났다[4]. 최근 연구에서는 오랜 기간 편측 인공와우를 착용한 청소년에게 다른 한쪽 귀에도 인공와우를 이식한 후 대뇌 활동성을 측정하였다. 연구 결과, 인공와우를 착용해왔던 귀에 청각적 자극을 제시하였을 때 정상인에 비해 훨씬 큰 대측 활동성이 나타났으나, 새로 인공와우를 이식한 귀에 청각 자극을 제시하였을 때에는 대뇌피질 활동성이 비정상적으로 크고 뇌 전체에 퍼진 양상으로 나타났다. 또한 이러한 뇌 활동성은 단어 지각력과 유의미한 상관관계를 나타내었다[5]. 따라서 인공와우 사용자의 반구성 비대칭 패턴의 변화는 인공와우 사용으로 인한 대뇌피질의 재조직화를 반영한다고 볼 수 있다.
기능적 자기공명영상(functional magnetic resonance image)을 이용하여 인공와우를 이식한 성인의 대뇌피질 재조직화를 관찰한 선행연구에 따르면, 말소리 인지와 연관된 음운 축약(phonological process)을 처리할 때 상후장골극측두 이랑(posterior superior temporal gyrus)과 연상회(supramarginal gyrus)를 포함한 오른쪽 측두엽 부위가 왼쪽 반구의 측두엽에 비해 더욱 활성화된 것으로 나타났다[6]. 18F-fluorodeoxyglucose positron emission tomography(18FFDG PET)을 이용한 대뇌 연결성 연구에서도 일차 청각 피질(primary auditory cortex)의 대사율이 인공와우 착용 귀의 동측 반구에서 기능적 연결성이 더 높게 나타났으며, 이러한 반구성 비대칭 현상은 인공와우를 착용한 성인에 비해 아동에서 더 두드러지게 관찰되었다[7]. 하지만 인공와우를 착용한 성인을 대상으로 반구상 비대칭을 관찰한 선행연구들은 비대칭 패턴에 대해 상이한 결과들을 보고하였는데, 그 원인 중 하나는 여러 연구에서 tone burst 혹은 클릭음 같은 단순음을 사용하여 대뇌 활동성을 측정하였기 때문으로 보인다. 실제로 클릭 같은, 자연음과는 동떨어진 소리들을 이용하여 대뇌피질 활동을 측정하는 경우 결과의 일관성이 떨어지는 것으로 보고되고 있다[6]. 따라서 실제 말소리와 유사한 자연스러운 소리를 이용하여 인공와우 사용자를 대상으로 한 대뇌피질의 재조직화에 대한 연구가 더욱 필요한 실정이다. 일부 연구는 인공와우 사용자 사이에 보이는 말지각 능력의 차이가 그들의 신경 가소성 속도와 정도 차이에 기인한다고 주장하였다[8]. 예를 들어, 인공와우 사용자에게 시각 자극을 제시하였을 때 청각 중추가 시각 자극을 처리하는 데 관여하는 교차 감각 재조직화(cross-modal reorganization)가 일어나는 현상이 확인되었으며, 이러한 재조직화의 정도는 인공와우 사용자의 말지각력과 상관관계가 있다고 보고하였다[9,10]. 따라서 청각 손실과 인공와우 사용에 따른 대뇌 재조직화의 변화를 측정하고, 객관적으로 측정한 대뇌 활동성과 주관적인 행동적 수행력과의 상관관계를 밝히는 것은 과학적, 그리고 임상적으로 중요하다고 볼 수 있다.
본 연구에서는 뇌전도(electroencephalography) 기술을 이용하여 N1 쌍극자 신호원을 측정하여 시간적 변화를 포함한 말소리에 따른 대뇌 활동성의 변화와 반구상 비대칭을 알아보고자 한다. N1을 선택한 이유는 청각 사건 관련 전위(auditory event-related potential, AEP)를 구성하는 여러 하위 성분 중 N1이 청각 관련 정보에 가장 민감하게 반응하는 성분으로 알려져 있기 때문이다[11,12]. 또한, 본 연구에서는 6가지 단계의 음성개시시간(voice onset time, VOT)이 포함된 말소리를 소리 자극으로 사용하였다. 정상 청력인을 대상으로 VOT의 길이 변화에 따른 N1의 변화를 관찰하였을 때, VOT가 증가할수록 N1의 진폭이 작아졌으며[13], 긴 VOT를 가진 청각 자극을 사용한 경우 두 개의 N1 정점(double peak)이 나타났다[14]. 인공와우 사용자의 N1과 말지각력을 조사한 연구에서는 VOT의 길이에 따른 N1의 변화와 말지각 능력 간의 유의미한 상관관계를 확인하였다[15]. 또한 인공와우 사용자를 대상으로 VOT에 따른 범주 지각과 N1의 상관관계를 알아본 최근 선행연구에서는 말지각력이 낮을수록 범주 지각(categorical perception)이 나타나는 VOT가 늦어지며, 이는 N1 진폭과 관련이 있다고 밝힌바 있다[16].
따라서, 본 연구에서는 VOT 변화에 따른 N1 쌍극자 진폭 및 잠재기의 변화를 알아보고, 반구상 비대칭을 수치적으로 나타낼 수 있는 N1 쌍극자의 편재화 지수(lateralization index)를 계산하여 대뇌 편측화를 측정하였다. 특히, 범주 지각과 N1 진폭의 변화를 측정한 선행연구에서 /바/와 /파/를 구분하는 범주 지각의 경계가 약 20 ms VOT에서 나타난다고 밝힌바 있으므로[16], 본 연구에서는 20 ms의 편재화 지수를 이용하여 인공와우 사용자들의 말지각력과 반구상 비대칭의 상관관계를 조사하였다.
대상 및 방법
연구 대상
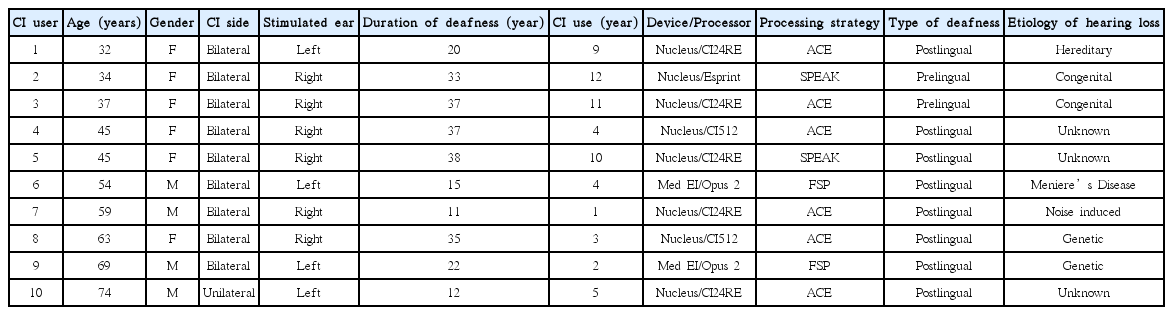
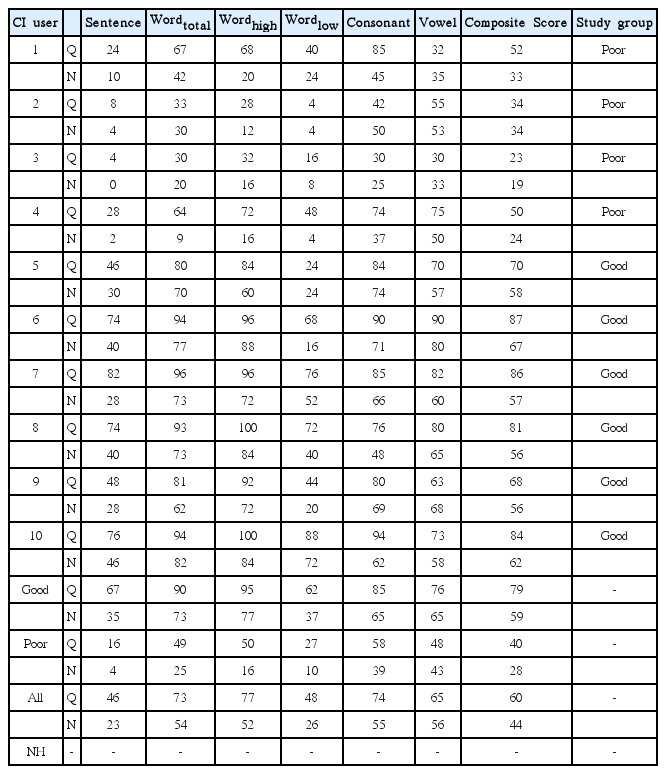
본 연구를 위해 영어를 모국어로 하는 인공와우 사용자 10명(남 4명, 연령 범위: 32~74세, 평균: 49.6세)과 정상 청력을 가진 성인 11명(남 4명, 연령 범위: 20~42세, 평균: 31세)이 참여하였으며, 모든 피험자는 오른손잡이였다. 인공와우 사용자들은 신시내티 아동 병원의 임상시험윤리위원회 프로토콜(IRB No. 2013-0105)에 따라 모집되었으며, 인공와우 이식 후 1년 이 지났으며, 하루에 적어도 8시간 인공와우를 꾸준히 착용하였다고 보고한 성인을 대상으로 하였다. 10명의 인공와우 사용자 중 2명의 난청 발생시기는 언어 습득 이전, 8명은 언어 습득 이후인 성인으로, 수술 전 청력은 대상자 모두 고도 이상이었다. 인공와우를 착용한 피험자 모두 양쪽 귀의 말지각력을 실시하여 수행력이 더 좋은 한쪽 귀에만 인공와우를 착용한 상태로 본 실험에 참가하였다. 인공와우 대상자의 연령, 성별, 인공와우 착용 귀, 착용 기간, 인공와우 세부정보는 Table 1에, 그리고 말지각력 검사 결과에 대한 정보는 Table 2에 제시하였다. 또한, 인공와우 사용자군은 모음과 자음 인지 검사(Vowel and Consonant Recognition Test)와 소음 하 말지각(Speech Perception In Noise, SPIN) 검사를 수행하여 우수(good)군과 저조(poor)군의 두 그룹으로 구별하였다. SPIN 검사는 http://www.tigerspeech.com에 무료 배포된 검사 도구를 이용하였으며, 총 50개의 문항을 듣고 따라 말하는 검사로서, 단어와 문장 수준의 지각력을 측정할 수 있다. 자음 검사는 총 16개의 “a/C/a” 구조로 총 400회 제시되었으며, 모음은 “h/V/d”의 구조로 10개의 단모음 및 2개의 이중 모음 비율로 총 300개의 모음을 제시하였다. 총 10명의 인공와우 피험자 중 40점 이하의 총점(composite score)을 보인 4명의 사용자들은 저조 사용자군으로, 50점 이상의 총점을 가진 6명의 사용자들은 우수 사용자군으로 분류되었다.
건청인 11명은 모두 양이 순음청력검사 결과 250 Hz부터 8000 Hz까지 옥타브 단위 주파수에서 15 dB HL 이하의 정상 청력을 보였다. 모든 참여자는 동의서 서명 후 실험에 참여하였다.
자극음
자극음은 하스킨스 연구소(Haskins laboratories)가 개발한 Abramson/Lisker VOT 자극음에서 수정된 6단계의 /바/ - /파/ VOT 연결체로, 이 6개의 음절은 각각 0 ms에서부터 50 ms까지 10 ms의 간격으로 넓어지는 6개의 VOT를 포함한다(http://www.haskins.yale.edu/featured/demo-lisk-abram/index.html). Fig. 1은 본 연구에서 사용된 0 ms VOT의 파형과 자극음에 따른 인공와우 잡음(artifact)과 토포그래피(topography)를 보여준다. 모든 자극음은 VOT 구간을 포함하고, 입술에 의한 파열 구간을 지나 모음 /ㅏ/로 끝나는 형식으로 구성되었으며, 자극음의 총 지속시간은 180 m s으로 모두 동일하게 유지하였다. 자극음은 직접 제작한 Matlab(MathWorks, Natick, MA, USA)를 이용하여 Tucker-Davis Technologies(TDT, Alachua, FL, USA) 사의 RZ5를 통해 호환 가능한 디지털 사운드 파일로 변환하여 전달되었고, 동시에 TDT를 통해 신호가 전달되는 시간을 실시간으로 컴퓨터에 저장하였다. Bruel and Kjær 2260 사운드 레벨미터(Bruel and Kjær, Nærum, Denmark)를 사용하여 소리의 강도를 보정하였다.

The example of CI artifact in respond to /ba/ stimulus. The features of CI artifact are instantaneous waves with the onset of sound increased energy near CI peak topography. The VOT of sound waveform in this figure is 0 ms. Note that the CI is located at a left ear. CI: cochlear implant, VOT: voice onset time.
연구 절차
뇌파 측정
뇌파는 64채널 뇌파측정기(actiChamp; Brain Products GmbH, Munich, Germany)를 이용하여, 전극이 부착된 캡을 두피에 씌워 측정하였다. 접지 전극은 비근점(미간; nasion)과 Cz 위치의 중간 지점에 위치하도록 조절하였으며 총 64개 중 한 개는 기준 전극으로 Cz에 위치하였고, 나머지 63개의 전극에서 뇌파를 측정하였다. 본 연구에서는 등거리 레이아웃이 적용된 전극 캡을 사용하였는데, 이 캡은 international 10-20 시스템을 따르지 않기 때문에 Cz의 위치에 가장 가까운 3개의 전극에서 얻어진 뇌파의 값을 평균하여 N1을 측정하였다. 자극음은 피험자로부터 1.5 m 앞 정면에 위치한 스피커를 통해 쾌적강도레벨(most comfortable level, MCL) 수준의 크기로 차폐 방음실 안에서 제시되었다. 자극음 사이 구간(inter-stimulus interval, ISI)은 1.5초로서 자극음이 끝난 후 1.5초의 휴지 구간을 지나 그다음 자극음이 제시되었다. 모든 인공와우 사용자는 왼쪽 혹은 오른쪽 귀 중 청력 역치가 더 낮은 한쪽 귀에만 인공와우를 착용한 상태로 청각 유발 전위 측정을 실시하였다. 정상 청력 대조군은 스피커를 통해 양쪽 귀로 소리를 전달받았으며, 70 dB의 강도로 자극음을 제시하였다. 실험 시 피험자는 자신이 선택한 음소거 된 영화를 시청하였으며, 이해를 위해 자막을 제시하였다. 집중에 의한 하향식 처리(top-down processing)의 영향을 최소화할 수 있도록 실험을 시작하기에 앞서 피험자에게 영화에 최대한 집중하고, 자극음은 무시하도록 지시하였다. 각 VOT 자극음 당 200회씩 총 1200회(6 VOTs×200회)의 자극음이 정상 청력군에게 제시되었고, 인공와우 사용자군의 경우 인공와우에 의한 잡음(noise)이 많이 발생하므로, 자극음 당 최소 400회씩 총 2400회(6 VOTs×400회)의 자극음이 4개의 블록에 걸쳐 제시되었다. 뇌파 측정 후 Polhemus Patriot 3D 디지타이저(Polhemus, Colchester, VT, USA)를 이용하여 각 피험자의 정확한 전극 위치를 기록하였으며, 이는 쌍극자 분석에 사용되었다. 데이터 저장 시 표본율(sampling rate)은 1000 Hz였고 모든 데이터는 오프라인 분석을 위해 저장되었다. 모든 자극음은 예측 효과를 방지하기 위해 무작위 순서로 제시되었으며, 총 뇌파 측정 시간은 정상 청력인의 경우 평균 1.5 시간, 인공와우 사용자는 평균 2.5 시간이 소요되었고, 각 세션 사이와 피험자가 원하는 때에 휴식 시간이 주어졌다.
뇌파의 전처리 및 기록
뇌파의 전처리(preprocessing) 및 분석은 B rain V ision Analyzer 2.0(Brain Products GmbH)을 사용하여 실시되었다. 측정된 뇌파는 먼저 고대역 통과 필터(high-pass filter)를 사용하여 저주파에서 발생하는 잡음 신호를 제거하기 위해 0.01 Hz 이하 주파수를 차단하였고, 표본율을 512 Hz로 낮추었다. 또한, 통과 주파수 대역 필터링(band-pass filter)을 이용하여 전원에 의해 발생하는 잡음(60 Hz)을 차단하였다. 이후 육안검사(visual inspection)로 신체 움직임과 관련된 잡음을 제거하였고, 독립성분분석(independent component analysis, ICA)을 통해 눈 깜빡임/좌우 움직임, 심전도(electrocardiography), 인공와우 잡음(CI artifact)을 제거하였다. Fig. 1에 자극음의 제시에 따른 인공와우 잡음이 나타난 파형과 토포그래피에 나타나는 인공와우 관련 대뇌 활동성에 대한 대표적인 예시를 제시하였다.
잡음 제거(artifact rejection)가 완료된 데이터는 저대역 통과 필터(low-pass filter)로 20 Hz 이상의 주파수를 필터링하였고, 자극 시작점인 0 ms를 기준으로 자극 전 200 ms에서부터 자극 후 1000 ms까지 총 1200 ms으로 분할(segmentation)하여 분석에 활용하였다. 6가지의 VOTs 조건에 따라 나누어진 데이터는 조건당 실시된 시행 수를 63개의 전극 별로 평균화하여 기준 전극의 평균값으로 빼주었다.
뇌파 신호원 분석(EEG source analysis)
쌍극자 신호원 분석(dipole source analysis)은 BESA Research 6.0(Brain Electric Source Analysis, GmbH)을 사용했으며, Hine과 Debener [17]의 논문에서 설명한 것과 유사한 방법으로 분석을 실시하였다. 이 논문에서는 등가 쌍극자 모델(equivalent dipole model)을 적용하여 왼쪽과 오른쪽 반구에 각각 한 개의 대칭적인 위치에 쌍극자를 심어 쌍극자의 위치와 방향을 계산하는 방식을 이용하였다. 양쪽 반구의 쌍극자들은 청각 자극에 가장 민감하게 반응하는 것으로 알려진 횡회(Heschl’s gyrus, centroid, in Talairch 좌표: ±49.5, -17, 9) 근방에 배치하였다. 위치 설정을 위한 Talairch 좌표는 Hine과 Debener [17]의 연구에서 적용한 좌표를 이용하였다. N1의 전부위장력(global field power; GFP)을 측정하여 최대 진폭을 포함한 20 ms 구간의 데이터를 쌍극자 분석에 사용하였으며, 쌍극자 중에서도 접선(tangential) 신호원을 N1 쌍극자 분석에 활용하였다. 쌍극자들에 의해 발생하는 각 전극 채널의 전위 측정치의 오차를 최소화하기 위해 모든 피험자에서 20 ms 구간을 기준으로 측정한 적합도(goodness of fit, GOF)가 80% 이상이 되는 데이터만 최종 분석에 사용되었다. 마지막으로 모든 피험자에서 평균 쌍극자 파형(grand mean source waveform)을 계산하였으며, 조건 간의 통계적 차이를 평가하기 위해, 접선 쌍극자의 피크를 중심으로 한 20 ms 구간에서의 평균값이 통계 분석에 사용되었다.
인공와우 사용자군(poor vs. good CI performers)의 반구상 비대칭을 비교하기 위해 편재화 지수(lateralization index)를 다음의 식을 이용하여 계산하였다.
편재화 지수(lateralization index) = (contralateral-ipsilateral)/(contralateral+ipsilateral)
편재화 지수는 -1부터 +1까지 분포하며, +는 대측 반구로의 편측성을 의미하고, -는 동측으로의 편측성을 의미한다.
통계 방법
통계 분석은 Statistica SPSS version 12(SPSS Inc., Chicago, IL, USA) 프로그램을 이용하여 실시되었다. 독립변수는 6개의 VOT 값과 피험자 그룹이었으며, 종속변수로는 x, y, z 쌍극자 위치와, 쌍극자 신호원 활동성이 설정되었는데, 쌍극자 활동성의 경우 인공와우 사용자는 동측과 반대측의 대뇌 활동성이, 정상 청력군은 오른쪽과 왼쪽 대뇌 활동성이 사용되었다. 반복측정 분산분석(repeated measures analysis of variance)이 그룹 내 변수(6개의 VOT)와 그룹 간 변수(우수 CI군, 저조 CI군, 정상청력군)에 따른 N1 쌍극자 활동성에서의 유의미한 차이가 있는지, 또한 변수 간 상호작용(interaction)이 있는지 조사하였으며, 유의미한 차이가 있는 경우 Fisher’s Least Significant Difference(LSD)를 통해 사후검증을 실시하였다. N1 쌍극자 위치는 x, y, z 각각의 위치에서의 인공와우 사용자군과 정상 청력군과의 차이를 독립표본 t 검정을 통해 검증하였다. 인공와우 사용자군에서의 편측 지수와 말지각력과의 상관관계는 스피어만 상관계수(Spearman’s rank correlation coefficient)를 이용하여 검증하였다.
결 과
N1 쌍극자 위치
쌍극자 분석 결과 정상 청력 대조군과 인공와우 사용자군 모두에서 80% 이상의 적합도를 나타내었다. Fig. 2는 VOT에 따른 정방향과 역방향의 평균 쌍극자 신호원 파형을 보여주고 있다. 전체적으로 VOT가 증가할수록 N1 쌍극자 반응이 작아지는 현상이 관찰되었으며, 정상 대조군과 우수 인공와우 사용자군에 비해 저조 인공와우 사용자군에서 N1 신호원 활동성이 감소된 것으로 나타났다.
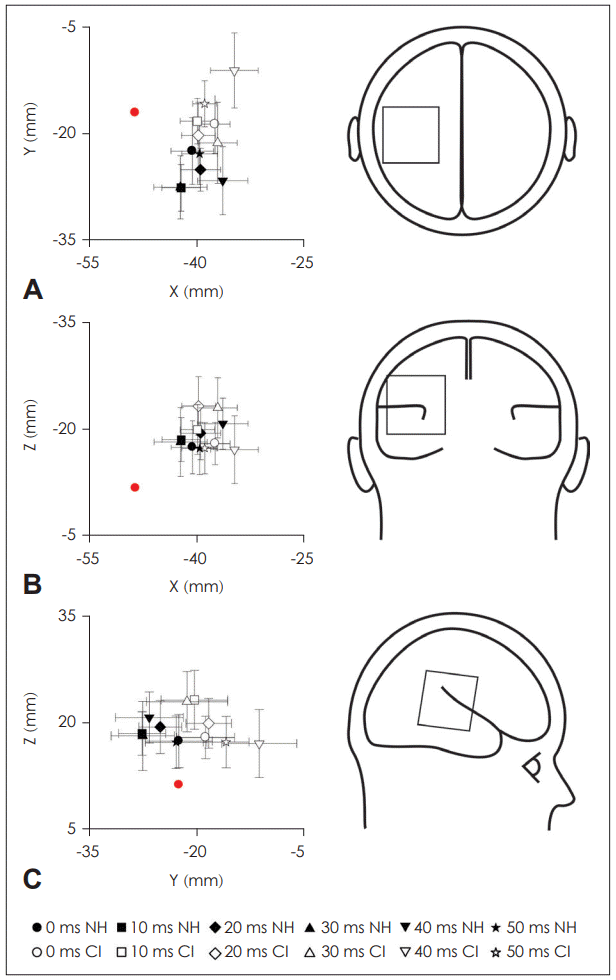
N1 dipole locations for each of six VOTs in CI and NH groups. The dipoles are shown at the location of best fit in each of three views; transverse (A), coronal (B), and sagittal (C). For the CI group, individual dipoles are shown for contralateral and ipsilateral activity. Dipole fits for the NH group represent the left and the right auditory cortex. Red dots indicate Heschl’s gyrus (Talairch coordinates: ±49.5, -17, 9). CI: cochlear implant, NH: normal hearing, VOT: voice onset time.
쌍극자 위치 분석 결과, 쌍극자 핏(dipole fit)이 일차 청각 영역(primary auditory cortex)과 그 주변에 위치한 것을 확인할 수 있었다. VOT의 변화에 따른 쌍극자 위치 변화를 통계적으로 분석한 결과 유의미한 VOT 효과는 관찰되지 않았다(p>0.05). 그룹 간 비교를 위해 우수 인공와우 사용자 군과 저조 인공와우 사용자 군의 쌍극자 위치를 비교한 결과 전후 방향(anterior-posterior direction; y)에서 40 ms의 VOT가 자극음으로 주어졌을 때 두 인공와우 그룹 간의 유의미한 차이가 관찰되었다(t=-2.62, df=18, p<0.05).
N1 쌍극자 파형 패턴과 반구상 비대칭성
Fig. 3은 우수 인공와우 사용자군과 저조 사용자군에서의 VOT의 변화에 따른 동측과 반대측의 쌍극자 신호원 파형의 평균(grand mean average)과, 정상 청력군의 왼쪽과 오른쪽 반구 그랜드 평균 신호원 파형을 보여주고 있다.

Dipole source waveforms as a function of VOT. Individual waveforms represent contralateral and ipsilateral activity for Good CI performers (A), Poor CI performers (B) and NH (C) right and left auditory activity are shown. N1 source amplitude as a function of VOT (D). Black circles, blue squares, and red triangles represent NH, good CI, and poor CI groups, respectively. CI: cochlear implant, NH: normal hearing, VOT: voice onset time.
Fig. 3에서 보이는 바와 같이, 전체적인 N1 쌍극자 파형의 패턴은 모든 VOTs 조건에서 우수 인공와우 사용자군의 동측과 대측 N1 활동성 모두 저조 사용자 군에 비해 높고, 정상군보다는 낮은 것으로 나타났다. 또한 VOT 길이에 따른 N1 쌍극자 활동성의 편재화 지수의 변화를 Fig. 4에 제시하였다. 전체적인 패턴을 살펴보았을 때, 우수 인공와우 사용자군에서는 모든 VOT 조건에서 대측의 활동성이 큰 것으로 나타났으나, 저조 군에서는 20~30 ms VOT를 제외하고 나머지 VOT에서는 동측 방향으로 활동성이 증가한 것으로 나타났다.

Lateralization index as a function of VOT in good and poor CI groups. Note that a plus (+) in lateralization index means the contralateral dominance while a minus (-) indicates the ipsilateral dominance. CI: cochlear implant, VOT: voice onset time.
VOT 길이에 따른 N1 쌍극자 진폭과 잠재기의 변화를 알아보기 위해 반복 측정 분산분석을 이용하여 그룹 간(우수 인공와우/저조 인공와우/정상대조군) 비교와 그룹 내(VOT의 길이: 0~50 ms) 비교를 실시하였다. N1 쌍극자 진폭과 잠재기는 피험자가 착용한 인공와우 기준으로 동측과 대측의 진폭과 잠재기를 각각 측정하였으며, 정상 청력군의 경우 왼쪽과 오른쪽 반구의 N1 쌍극자 진폭과 잠재기를 측정하여 반구상 비대칭을 분석하였다. 통계 분석 결과 그룹 간 차이는 통계적 유의성에 근접하나 유의미하게 나타나지는 않았다[F(2,17)=3.01, p=0.07]. 하지만 사후 검증 분석 결과 우수 인공와우군과 저조 인공와우군을 비교했을 때, 대측에서의 N1 쌍극자 진폭이 유의미하게 증가한 것으로 나타났다(p<0.05). 또한 VOT 효과[F(5,40)=4.05, p<0.05]와 VOT와 그룹간 상호작용[F(5,40)=2.59, p<0.05] 효과 모두 통계적으로 유의미하게 나타났다. 사후 검증 분석 결과, 우수 인공와우군의 N1 쌍극자 진폭이 0 ms과 10 m s VOT보다 20, 30, 40, 50 ms VOT에서 유의미하게 감소한 것으로 나타났다(all p<0.05). N1 잠재기에서도 유의미한 VOT 효과가 관찰되었으며[F(5,40)=3.5, p<0.05], 50 ms VOT에서의 동측 쌍극자의 잠재기가 10 ms VOT 보다 유의미하게 증가된 것으로 나타났다(p<0.05).
N1 쌍극자 활동성과 말지각력 간의 상관관계
인공와우 사용자의 N1 쌍극자 활동성의 반구상 비대칭성이 그들의 말지각 능력과 상관관계가 있는지 알아보기 위하여 20 ms VOT에서의 N1 쌍극자 편재화 지수와 소음 하 자음 지각 검사에서의 수행력과의 상관관계를 분석하였다. Fig. 5는 인공와우 사용자들의 소음 하 자음 지각 점수에 따른 편재화 지수를 나타내고 있다. 스피어만 상관계수 분석 결과 인공와우 사용자군의 편재화 지수가 소음 하 자음 지각력과 통계적으로 유의미한 상관관계를 보이는 것으로 나타났으며(spearman’s rho=0.71, p<0.05), 이는 소음 하 자음지각력이 좋을수록 대측 반구에서의 N1 쌍극자 활동성이 증가하는 것을 의미하며, 이와 반대로 지각력이 낮을수록 동측인 반구에서의 N1 활동성이 커지는 것을 의미한다.
고 찰
본 연구는 인공와우 사용으로 인한 대뇌 가소성을 쌍극자 신호원 분석을 통해 알아보고, 측정된 대뇌 활동성의 특성과 인공와우 이식 후 말지각력과의 상관관계를 밝히고자 하였다. 연구 결과, 말지각력이 우수한 인공와우 사용자군은 대측 반구에서 N1 쌍극자 활동성이 증가한 것으로 나타났으나, 말지각력이 저조한 인공와우 사용자군은 이와 반대로 동측 반구에서 활동성이 높게 나타났다. 또한 인공와우 사용자의 N1 쌍극자 활동성에 대한 편재화 지수가 소음 하 자음 지각력과 관련성이 깊은 것으로 나타났다.
N1 쌍극자 신호원의 위치
그룹 간 N1 쌍극자의 위치를 비교하였을 때 우수 인공와우 사용자군의 N1 쌍극자의 위치는 저조 인공와우 사용자군의 쌍극자의 위치와 전후 방향에서(Fig. 2) 유의미한 차이를 보인 반면, 정상 청력군과의 차이는 나타나지 않았다. 이는 우수군과 저조군의 인공와우 이식 후 대뇌 재조직화 패턴이 상이한 것을 의미한다. 인공와우 사용자를 대상으로 뇌자도를 이용하여 N1 쌍극자 위치를 비교한 선행연구에 따르면, 인공와우 이식 후 2년이 지난 피험자의 N1m 신호원 위치와 정상 대조군에서 측정한 N1m 신호원의 위치가 차이가 없었다고 보고하였다[18]. 한편, 인공와우 환자의 대뇌 재조직화 연구에서는 N1 쌍극자가 대뇌 피질의 어느 부위에 위치하는지가 중요하다고 주장하였다. 정상 청력인에서 측정된 N1 쌍극자의 위치는 일차 청각 피질뿐만 아니라 연합 청각 피질과 같은 비일차 청각 대뇌피질 부위(non-primary auditory cortex)를 포함하는 것으로 알려져 있는데[19], 인공와우 사용자를 대상으로 한 연구에서도 N1 쌍극자 신호원이 비일차 청각 피질 부위에 위치하는 것을 확인하였다[20]. 따라서 인공와우를 통한 청각 자극의 재유입은 정상적인 패턴으로의 대뇌 대조직화를 야기한다고 볼 수 있으며, 이러한 재조직화는 말지각력이 좋은 인공와우 사용자에게 더욱 현저히 나타나는 것으로 생각된다.
N1 쌍극자 신호원 활동성과 반구성 비대칭
본 연구에서는 인공와우 사용자의 반구성 비대칭의 패턴이 말지각 수준에 따라 상이하다는 것을 확인하였다. 우수 인공와우 사용자의 경우 인공와우의 이식 방향을 기준으로 대측에서 N1 활동성이 더 증가한 것으로 나타났으나, 저조 인공와우 사용자군에서의 N1 활동성은 동측에서 더 큰 것으로 관찰되었다. 인공와우 사용자의 반구상 비대칭에 대한 선행연구를 살펴보면 상반되는 결과를 제시하고 있다. 18FFDG-PET을 이용하여 반구상 비대칭을 살펴 본 연구에서는 자극 제시 방향과 상관없이 오른쪽 반구에서 대뇌 활동성이 더 크게 나타났다고 보고하였으나[7], 성인[17]과 아동[21] 인공와우 사용자의 경우 왼쪽 귀로 자극음을 제시하였을 경우에만 반대쪽 반구의 우세가 더 두드러진다고 보고하였다. 이러한 상이한 결과를 야기한 이유 중 하나는 여러 연구에서 서로 다른 자극 제시 방향과 분석 방법을 사용했기 때문으로 생각된다. 하지만 최근 들어 인공와우를 착용한 귀를 기준으로 대측과 동측의 대뇌 활동성을 분석하는 방법을 많이 사용하고 있고, 이러한 방법을 적용한 연구들은 비교적 일관적인 연구 결과를 보고하고 있다. 그중에서도 인공와우를 착용한 아동을 대상으로 한 연구에서 흥미로운 연구 결과들이 발표되었다. Gilley 등[8]은 단음절 말소리를 이용하여 P1 쌍극자 연구를 시행하였는데, 인공와우 이식 시기와 관계없이 모든 아동에서 동측과 비교하여 더 큰 대측 P1 활동성이 확인되었다. 편측성 인공와우 아동을 대상으로 한 연구에서도 대측 쌍극자 활동성이 증가한 것으로 나타났다. 하지만 남은 한쪽 귀에 인공와우를 이식한 후에는 이전에 보였던 대측의 활동성이 우세했던 현상이 현저히 줄어들거나, 비대칭성이 사라져 대뇌 전반에 걸친 쌍극자 활동성이 관찰되었다[4,5,21]. 또 다른 연구에서는 양측 인공와우 이식 아동을 대상으로 P1 활동성을 측정하였는데, 양측 인공와우 이식 아동에게 정상 청력 아동에서 나타나는 대측 반구 우세가 나타내었으며, 대측 반구의 활동성이 클수록 높은 말지각력을 나타내었다[4]. 이러한 선행연구의 결과와 유사하게, 본 연구에서도 말지각력이 우수한 인공와우 사용자에서 대측 활동성이 높게 나타났는데, 이와 같은 현상은 유입된 자극음을 효율적으로 처리하기 위해 대측 청각 피질로 정보를 보내기 위한 대뇌의 책략이며[22], 이러한 대뇌 처리 경로로 정보전달이 가능한 인공와우 사용자들의 말지각력이 더 우수한 것으로 유추된다. 반면에 말지각력이 저조한 사용자의 경우는 청각 피질을 포함한 청각 중추에서는 정보의 정확한 처리가 어렵기 때문에, 양쪽 반구를 동시에 사용하거나 대뇌 전반에 걸친 신경 활동을 유도하는 것으로 추측된다. 혹은 인공와우의 부적응(maladaptation)으로 인한 비정상적인 대뇌 재조직화의 결과로, 정상적인 청각 처리 경로를 벗어나서 다른 경로를 이용하는 것으로도 추측할 수 있다[5].
뇌 활동성과 말지각력의 상관관계
본 연구에서는 인공와우 사용자에서 나타난 반구상 비대칭이 행동적으로 측정한 말지각 능력과 연관이 있는지 살펴보기 위하여 편재화 지수와 소음 하 자음 지각 점수와의 상관관계를 살펴보았다. 여러 말지각 검사 중 소음 하 자음을 선택한 이유는 선행연구에서 다른 종류(모음, 단어, 문장 등)의 말지각 검사보다 자음, 특히 소음 하에서의 말지각 능력이 대뇌 활동성과 연관이 깊은 것으로 나타났기 때문이다[23,24]. 본 연구에서는 심리음향학적으로 가장 변별이 어려운 20 ms VOT에서의 N1 쌍극자 편재화 지수가 소음 하 자음 지각력과 유의미한 상관관계를 보였는데, 이는 성인 인공와우 사용자의 반구상 비대칭과 말지각력 간의 유의미한 상관관계를 보고한 이전 연구의 결과와 유사하다[25]. 인공와우 사용자는 클릭 같은 단순 자극음보다 말소리와 같은 복합음의 처리가 어려우며, 복합음의 효과적인 처리를 위해 가장 효율적인 대뇌 처리 경로를 개발하는 방향으로 대뇌 재조직화가 실행되는 것으로 알려져 있다[26]. 이러한 하향 조절(top-down modulation) 능력이 더 좋은 사용자일수록 시간적 정보를 처리하는 청각 경로가 특화되어 더 우수한 말지각력으로 나타나는 것으로 유추된다.
이전의 많은 선행연구에서 청성 뇌간 반응, 복합신경 활동전위 등의 다양한 객관적 측정 도구와 행동적으로 측정한 인공와우 사용자의 말지각력 간의 상관관계를 조사하였으나, 두 측정치 간의 유의미한 상관관계를 발견하지 못하였다[27-29]. 인공와우 이식 후 이식자의 말지각 능력은 매우 다양하게 나타나지만 아직도 그 원인은 밝혀지지 않은 상태이다. 또한 주관적 검사가 어려운 피검자나 영유아의 경우 행동적으로 측정하는 방식의 적용은 임상적으로 어렵기 때문에 대뇌 피질 유발 전위와 같은 객관적 측정도구의 개발이 시급한 실정이다. 따라서 N1 대뇌 유발 전위를 이용하여 이식 후의 인공와우의 이득에 대한 평가가 가능하다면 임상적으로 큰 도움이 될 수 있을 것이다. 하지만 임상적 적용을 위해서는 다양한 연령의 인공와우 사용자를 대상으로 한 연구가 진행되어야 할 것이며, 영유아를 위해 실험 시간을 단축하여 측정할 수 있는 연구 방법이 개발되어야 할 것이다.
결론적으로, 본 연구는 성인 인공와우 사용자에서 시간 정보를 포함한 말소리 자극에 따른 대뇌 활동성의 변화를 쌍극자 신호원 분석을 통해 알아보았다. 연구 결과 인공와우 사용자의 N1 쌍극자의 반구상 비대칭이 언어적 수행력과 연관성이 있는 것으로 나타났다. 연구 결과의 확장과 임상적 적용을 위하여 후속 연구에서는 더 많은 표본수의 인공와우 사용자를 대상으로 연구가 실시되어야 할 것이다. 또한 인공와우 적응 기간에 따른 대뇌 활동성의 변화를 종단 연구를 통해 알아본다면 인공와우 사용자의 대뇌 재조직화에 대한 이해를 높이고, 최적화된 청각 재활 모델을 개발하는 데 이론적인 도움이 될 것으로 사료된다.
Acknowledgements
This project was supported in part by Basic Science Research Program through the National Research Foundation of Korea (NRF) funded by the Ministry of Education (2019R1A2B5B01070129 and 2017R1D1A1B03030613) and by the Center for Women in Science, Engineering and Technology (WISET) Grant funded by the Ministry of Science, ICT & Future Planning of Korea (MSIP) under the Program for Returners into R&D (WISET-2019-252).