두경부암 수술 후 메트로니다졸 예방적 사용의 임상적 유용성
Clinical Usefulness of Prophylactic Metronidazole after Head and Neck Cancer Surgery
Article information
Trans Abstract
Background and Objectives
Head and neck cancer surgery has a high risk of infection, because surgical fields are exposed to the oral cavity and the pharynx during surgery. The purpose of this study is to evaluate the usefulness of prophylactic metronidazole by identifying factors contributing to postoperative fistulas in clean-contaminated head and neck cancer surgery.
Subjects and Method
A total of 234 patients underwent mucosa-opening surgery between January 2002 and October 2015. Of those, 167 patients received conventional prophylactic antibiotics and 67 patients received metronidazole in addition to the conventional prophylactic antibiotics. Various clinical factors were evaluated to find association with postoperative fistula.
Results
The multivariate analysis showed that the tumor site, advanced T stage, and the preoperative treatment were significantly associated with fistula formation, and the prophylactic use of metronidazole significantly reduced the number of postoperative fistulas.
Conclusion
In cases where the incidence of postoperative fistulas are more likely to increase, such as in the advanced T stage, in oral/pharyngeal cancer, and preoperative non-surgical treatment, prophylactic metronidazole may be useful for preventing postoperative fistulas.
서 론
두경부암 수술은 수술 중 타액이 수술 부위에 노출되어 수술 후 감염을 일으킬 위험이 매우 높은 수술로서, 감염 시 불량한 예후, 입원 기간 연장, 의료비 상승, 추가 수술 등을 유발할 수 있다[1,2].
예방적 항생제를 사용하면 수술 후 감염률이 감소한다고 보고한 이전 연구에서처럼[2-4] 두경부암 수술에서도 예방적 항생제를 사용하는 것이 수술 후 감염을 줄이는 데 중요하다. 혐기균이 정상 구인두 점막의 정상 균총인 반면, 타액은 대부분 그람 양성 구균과 혐기균으로 구성되어 있다[1,3]. 이전 연구에서 두경부암 수술 후 창상 감염 부위에서 그람 음성균을 포함한 다양한 균이 배양된다는 것이 확인되었다[5]. 따라서 그람 양성균, 그람 음성균 및 혐기성 박테리아를 포함하는 광범위한 항생제의 예방적 사용이 두경부암 수술에서 매우 중요하다.
예방적 항생제 외에도 수술 후 감염과 관련된 요인을 확인하기 위한 여러 연구가 수행되었고 이에 여러 가지 요인들이 제시되었음에도 불구하고, 대부분의 연구가 후두암 수술에 국한되어 있고 어떤 특정 요인이 수술 후 누공을 유발하는지에 대한 합의가 이루어지지 않고 있다[1,6-12].
본 연구는 수술 후 누공과 관련된 여러 가지 임상적 요인을 조사하여, 점막 개방 수술에서 예방적 항생제로서 메트로니다졸의 효과를 평가하고자 하였다.
대상 및 방법
본 연구는 후향적으로 2002년 1월~2015년 10월까지 두경부암 수술을 받은 428명의 환자를 대상으로 하였다. 이 중 125명이 구강암, 구인두암으로 진단이 되었고, 특히 62명의 환자는 종양의 제거를 위해 경하악골 접근법, 하악설유리 접근법, pull through 접근법 등을 통한 점막 개방 수술을 받았다. 전체 그룹 중 303명의 환자가 후두암 또는 하인두암으로 진단받았다. 이 중 172명이 인두 절개술 및 후두 절제술과 같은 개방적 접근법을 사용하여 수술을 받았다. 따라서, 점막 개방수술을 받은 234명의 환자를 대상으로 연구를 진행하였고 술 후 누공의 유무를 나이, 성별, 질환, 술 및 흡연의 병력, 방사선 치료 또는 항암방사선 치료와 같은 수술 전 치료 유무, 종양 원발 부위, 종양 병기 등에 따라 평가하였다. 이 연구는 한국고려대학교 안암병원 기관 심사위원회(IRB 2018AN0344)의 승인을 받았다.
2002년 1월~2015년 10월까지 2명의 두경부 전문 외과의에 의해 수술이 진행되었고, 두 전문가의 수술 기법 및 절차는 동일하였으며, 모든 수술은 무균적으로 수행되었다.
총 234명의 환자 중 2002년 1월~2010년 9월까지 수술을 받은 167명의 환자가 수술 후 기존의 예방적 항생제 치료를 받았고, 2010년 10월~2015년 10월까지 수술을 받은 67명의 환자가 기존의 예방적 항생제와 함께 메트로니다졸 투여를 받았으며 누공의 발생 여부는 식도조영술로 진단하였다.
기존의 항생제군(1군)에서는 정맥 내 1일 3회 aminoglycoside(300 mg)와 2세대 cephalosporin(1000 mg) 치료를 받았다. 메트로니다졸군(2군)에서는 메트로니다졸 5 00 m g을 통상적인 항생제 외에도 1일 3회 정맥 투여하였다. 항생제는 두 군에서 모두 7일 동안 예방적으로 사용되었다.
데이터의 통계 분석은 SPSS 버전 22(IBM Corp., Armonk, NY, USA)를 이용하였으며 chi-square 테스트와 Mann-Whitney U 테스트를 사용하여 그룹 간의 차이점을 비교 분석하고 로지스틱 회귀 분석은 다변량 분석에 사용되었다. Kaplan-Meier 방법과 log-rank test를 이용하여 암 재발 및 환자 생존 데이터를 추정하였다. 유의 수준은 p-value<0.05에서 확립되었다.
결 과
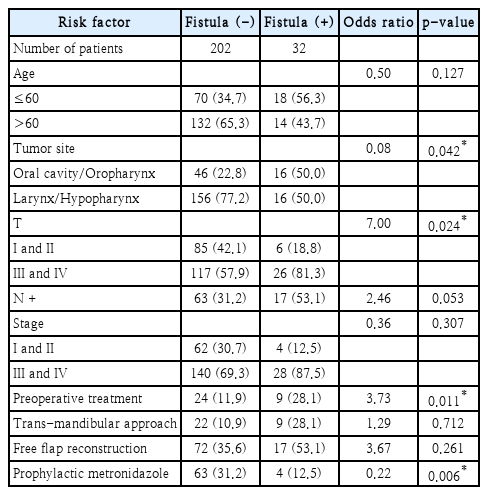
환자의 평균 연령은 62세(61.77±12.17)였다. 환자의 50% 이상이 술과 흡연의 병력이 있었다. 전체 등록된 환자 중 62명(26.5%)은 구강/구인두암 환자였고, 172명(73.5%)은 후두/하인두암 환자였다. 전체 환자 중 III, IV기의 진행된 환자가 많았다(Table 1).
수술 후 누공 발생률은 13.7%(32/234명)였으며 대부분 수술 후 2주 이내에 발생하였다(평균 9일). 누공 환자 중 8명은 보존적 치료를 받았고, 20명은 일차 봉합, 4명은 자유 피판 재건술을 받았다. 치료 기간은 보존적 치료, 일차 봉합, 자유 피판 재건술(20, 22, 72일)의 순서로 더 길었고 누공이 있는 환자의 입원 기간이 의미 있게 더 길었다(60.06±38.49일 vs. 27.54±21.43일, p<0.05).
단변량 분석에서 연령, 수술 전 치료 유/무, 종양 원발 부위, 종양 병기, 경하악골 접근법, 메트로니다졸의 예방적 사용이 누공의 발생과 유의한 관련이 있었다(Table 2).
다변량 분석에서 종양 원발 부위, 수술 전 치료 유/무, T 병기, 메트로니다졸의 예방적 사용은 누공의 발생과 유의한 상관 관계가 있었다(Table 3). 누공 발생의 위험은 수술 전 비수술 치료를 받은 환자의 경우 3.73배 더 높았고, 구강/구인두암에서 후두/하인두암에서 보다 12.5배 높았다. 누공의 위험은 진행된 T 병기를 가진 종양이 7배 더 높았다. 반면 누공의 빈도는 2군(메트로니다졸 첨가군, 6.0%)보다 1군(기존군, 16.8%)에서 유의하게 높았으며(p<0.05) 예방적 메트로니다졸의 사용은 누공의 위험을 0.22배로 감소시켰다.
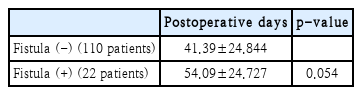
방사선 치료 또는 동시 항암화학방사선 치료를 포함하는 수술 후 보조 치료를 받은 132명의 환자에서 수술 후 보조치료의 시작이 누공 발생 환자에서 늦게 시작하는 경향을 보였으나 유의한 차이는 없었다(Table 4). 또한 수술 후 누공의 발생 여부와 무병 생존율과 전체 생존율은 p-value가 각각 0.997, 0.250으로 유의한 차이가 없었다(Fig. 1). 누공이 발생한 환자에서 메트로니다졸의 사용에 따른 누공 폐쇄 기간의 유의한 차이는 없었지만, 1군의 한 환자에서 수술 후 162일에서야 누공이 폐쇄될 수 있었다(Table 5).
Comparison of treatment onset according to fistula in the patients with postoperative adjuvant therapy

Comparison of disease free survival rate (A) and overall survival rate (B) according to the presence of postoperative fistula. Fistula (-): group without fistula, Fistula (+): group with fistula.
고 찰
이전 다양한 기존 연구들은 수술 후 누공 발생 위험과 관련된 위험 인자들로 나이, 기저 질환, 환자의 영양 상태, 종양 원발 부위, 종양의 크기, 자유 피판 재건 여부, 경부 림프절 절제 여부, 수술 이전의 방사선 요법 또는 항암화학 요법 시행 여부, 수술 전 기관 절제술 여부 등을 제시하였다. 그러나 어떤 위험 인자가 누공과 관련이 있는지에 대해서는 논란이 있다[1,6-12]. 본 연구에서는 이전 연구와 유사하게 수술 전 비수술 치료, 종양 원발 부위, T 병기가 수술 후 누공 형성과 의미있는 연관이 있다는 결과와 함께 메트로니다졸의 예방적 사용이 누공의 발생을 유의하게 줄일 수 있음을 제시하고 있다.
진행된 T3-T4 병기와 수술 전 방사선 치료 또는 동시 항암화학방사선 치료는 본 연구에서뿐만 아니라 이전 연구에서 위험 인자였는데[11,13] 이는 진행된 종양의 광범위한 절제 및 재건이 누공의 발생을 증가시키는 원인으로 생각되며, 방사선 치료를 받은 조직은 혈액 공급이 감소하기 때문에 염증에 취약하여 수술 후 누공을 유발할 수 있다.
구강/구인두암 수술은 후두암 수술보다 상처 감염이 더 흔한 것으로 보고된 바 있는데[14] 일반적으로 구강/구인두는 다른 부위에 비해 병원성 박테리아가 많으며, 두경부암 수술 후 좋은 구강 위생을 유지하지 못하여 감염이 증가한다. 또한, 구강 내 종양을 제거할 때, 구강 내 나머지 구조와 하악 사이에는 잠재 공간이 존재할 수 있으며, 이 공간 내에 박테리아에 의해 오염된 혈종이 발생하여 농양과 누공이 생길 수 있다. 따라서 특히 구강/구인두 수술에서 누공의 위험을 미리 인식할 필요가 있다.
두경부암 수술에는 다양한 항생제가 사용되어 왔다. 2013년 American Journal of Health-System Pharmacy(AJHP) 임상 지침에서는 두경부암 수술에서 예방적 항생제로 cefazolin+metronidazole, cefuroxime+metronidazole 및 ampicillinsulbactam을 권장하였고 beta-lactam 알레르기 환자에게는 clindamycin이 권장되었다[15]. 본원에서는 2010년까지는 3세대 cephalosporin과 이에 더해 시너지 효과가 있는 것으로 알려진 aminoglycoside가 예방적 항생제로 사용되었다.
본원에서는 메트로니다졸이 혈관 신생 및 콜라겐 생성을 자극하고 상처 감염을 감소시킴으로써 상처 치유에 기여한다는 이전의 연구에 기초하여 2010년부터 예방적 항생제로 사용되었으며[16-18] 이전 연구와 마찬가지로 이 연구에서도 메트로니다졸을 사용한 환자에서 누공의 발생이 감소하며, 입원 기간이 짧아진다는 것을 확인할 수 있었다[1,6,17,18].
이 연구에서 예방 항생제는 평균 7일 동안 사용되었다. 그러나 2013 AJHP 가이드 라인에 따르면 점막 개방 수술에서 예방적 항생제를 하루 이상 사용하는 것을 권하지 않는다[15,19]. 재상피화가 24시간 이내에 진행이 되기 때문에 구강 점막에서 예방적 항생제를 단 하루만 사용하는 것이 합리적인 것으로 보고하고 있다[20]. 그러나 수술 전 화학 요법이나 방사선 치료를 받은 위험군의 환자는 점막 회복이 늦고 이로 인해 장기간 타액에 노출될 수 있다. 이와 같은 경우 수술 후 감염으로 인한 문제를 예방하기 위해 예방적 항생제를 하루 이상 사용하는 것이 좋다[21].
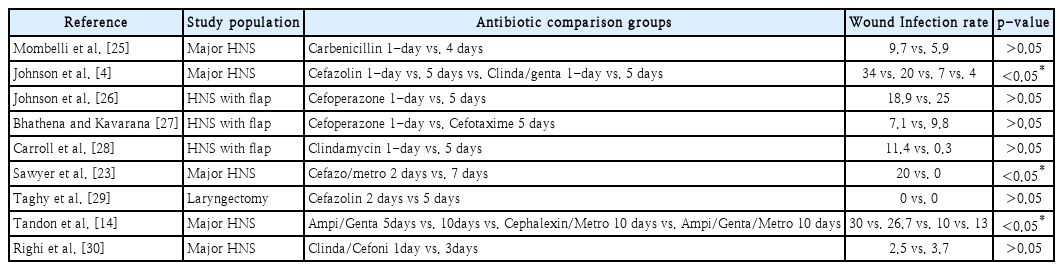
많은 최근의 연구에 따르면 항생제의 장기간 사용으로 인한 이익이 없다고 보고 되었지만, 일부 연구에서는 감염 위험을 줄이기 위해 하루 이상 항생제 사용을 권장한다(Table 6) [14,22,23]. 이는 방사선 또는 항암 치료 등의 수술 전 치료 여부 또는 구강/구인두암 등 누공 발생의 위험 인자가 동반된 환자와 위험 인자가 동반되지 않은 환자를 구분하지 않았기 때문에 다양한 결과가 나왔을 것으로 생각되며 따라서 수술 이전의 화학 요법이나 방사선 요법을 받은 환자나 구강/구인두암 또는 진행된 종양 단계와 같이 누공 발생의 위험 인자가 동반된 환자의 경우 1일 이상 예방적 항생제가 필요할 수 있으며 메트로니다졸의 추가 투여가 수술 후 누공 발생을 줄일 수 있다. 특히, 메트로니다졸이 누공 환자에서 누공이 닫히는 데에까지 기간을 유의하게 단축시키지 못할 지라도, 메트로니다졸을 투여한 환자에서 메트로니다졸을 투여하지 않은 환자에 비해 일찍 폐쇄되는 경향이 있었던 결과를 봐서는 메트로니다졸의 유용성이 의미 있다고 보여진다. 이는 예방적 메트로니다졸의 사용이 누공의 발생을 완전히 막지는 못하더라도, 잠재적인 균의 수를 감소시킴으로써 그리고 혈관 신생 및 콜라겐 생성을 자극함으로써 육아 조직의 생성을 자극하여 상처 치유에 도움이 되기 때문으로 생각된다[17,18].
이전 다른 연구에서 누공 발생 시 수술 후 추가적 치료 지연으로 인해 예후가 좋지 않다고 보고되었지만[13,24], 본 연구에서는 누공이 발생한 환자의 수가 적어서인지, 누공의 발생과 환자의 예후는 연관성이 없으며, 누공 발생 시에도 치료 지연으로 이어지지 않았다.
본 연구의 한계점은 후향적 연구라는 것과, 누공이 발생한 환자의 수가 적다는 것이다. 또한 모든 환자에서 예방적 항생제를 7일 동안 균일하게 사용하였기 때문에 항생제의 유지 기간에 따른 누공 발생률의 차이는 평가되지 않았다. 따라서 적절한 항생제의 선택과 그 지속 기간을 확립하기 위해서는 추가 연구가 필요하다. 누공의 발생은 수술하는 전문의의 경험이 영향을 미치는 바가 매우 큼에도 불구하고, 같은 기간 내에 메트로니다졸의 사용 여부에 따른 차이를 보지 않아, 메트로니다졸 예방적 사용의 결과를 해석함에 있어 편향이 있을 수 있다.
구강/구인두암, 진행된 T 병기, 수술 전 방사선 치료/동시 항암화학방사선 치료는 수술 후 누공의 위험 인자이므로 따라서 이러한 위험 인자를 가진 환자의 경우 누공의 발생을 예방하기 위해 메트로니다졸의 사용을 고려해야 하며 두경부암 수술에서 예방 항생제의 사용은 누공의 발생과 같은 수술 후 합병증을 예방하고 입원 기간 단축하는 데 매우 중요하다.
Acknowledgements
None.