생체 의료 적용을 위한 3D 프린팅 지지체 제작 및 표면 최적화 기술
Surface Functionalization of Three-Dimensional Printed Scaffold for Biomedical Application
Article information
Trans Abstract
Three-dimensional (3D) printing is one of the most effective scaffold manufacturing techniques which might revolutionize the realm of tissue engineering and regenerative medicine. The scaffolds, one of the major elements of tissue engineering, along with growth factors and cells, are still one of the most promising approaches for developing organ regeneration. However, the applications of 3D-printed hard scaffolds might have limitations due to their poor surface properties, which play a crucial role in cell recruitment and infiltration, tissue-scaffold integration, and anti-inflammatory properties. Various prerequisites have been suggested for clinical applications of 3D-printed substitute for human body. Consequently, continuous amendment has been made to modify the surface properties, porosities and mechanical properties of these scaffolds. The techniques that modify the surfaces through chemical and material modifications can also be applied to facilitate the efficacy of these scaffolds. In this review, we summarized the characteristics of 3D printing technology and discuss the development direction of the latest 3D printing technology toward meeting the unmet needs in the clinic.
서 론
Three-dimensional (3D) 프린팅 기술은 구조체를 기존의 방법처럼 재료를 깎거나 혼합 주조하여 제작하는 것이 아니라 적층하여 만드는 공정이다[1]. 1986년 광경화 플라스틱을 이용한 stereolithography (SLA) 기술이 처음으로 개발된 이후, 열가소성 플라스틱을 이용한 용융 용착 조형법(fused deposition modeling, FDM), selective laser sintering (SLS) 등 다양한 기술들이 순차적으로 상용화되기 시작하였다. 2014년에 이르러 초기 3D 프린팅 기술들의 주요 특허가 만료되어 3D 프린팅 기술이 대중화되었고, 항공, 자동차, 선박, 건설 등 제조업 분야뿐만 아니라 의료에 이르기까지 다양한 분야에서 사용되면서 산업 전반에 큰 파급력을 보이고 있다[2]. 생체 조직공학 분야에서는 특히 생체적합 고분자 고체 필라멘트를 녹여서 한층, 한층 쌓아가며 적층하는 3D 프린팅 방식인 FDM 기술을 이용하여, 재생의학-조직공학용 인공지지체(scaffold)를 제작하고자 하는 3D 프린팅 기술이 2000년대 들어서 다양한 질환에 빠르게 적용되기 시작하였다. 뿐만 아니라 3D 프린팅 기술의 활용이 인체 삽입/세포부착용 조직공학 지지체 이외에도 수술 시뮬레이션, 가이드 및 수술 임플란트 제작, 환자맞춤형 보형물(patient-customized implants) 제작 등 다양한 임상의학 현장에서 활발하게 시도되고 있다[3]. 3D 프린팅 기술은 다양한 생체적합 소재를 이용하여 복잡한 3차원 생체 모사 구조를 아주 쉽고, 빠르게 제조할 수 있다는 장점에 기반하여 다양한 의료분야에 활용되고 있는 것이다.
실제 임상의학에서 환자에게 3D 프린팅 기술을 활용하는 분야는 크게 4가지로 분류해 볼 수 있다: 1) 수술 및 시술의 시뮬레이션 또는 실습 교육을 돕기 위한 정밀 인체 모사 대체 모형, 2) 수술적 절제의 정밀도 및 안전성을 개선하기 위한 수술용 가이드 및 수술기구(ex. 하악골 절제 가이드 및 비골 피판 절제 가이드 등), 3) 체외 접촉 의료기기(ex. 의족, 의수, 인공 귀, 방사선치료 고정 마스크 등), 4) 인체 내에 삽입하여 결손된 조직 및 장기 형태, 더 나아가 기능을 보조, 대체하는 이식용 의료기기로 구별할 수 있겠다[4]. 인체와 직접적으로 접촉하지 않거나 삽입되지 않는 1), 2), 3) 즉 1-3 등급 의료기기의 경우 생체재료를 필요로 하지 않으며 제작에도 난이도가 높지 않다. 하지만 인체에 삽입되는, 고도의 위해성을 가진 4등급 의료기기, 4)의 경우, 매우 정밀하고 안전한 생체재료를 통해 제작되어야 하겠다. 당연히 Food and Drug Administration (FDA) 승인된 고분자, 금속 생체재료들을 이용하여야 하며, 의료기기 제조 및 품질관리기준(Good Manufacturing Practice)에 맞춰, 면역반응을 일으키지 않도록 조절, 개선한 이후에 3D 프린팅에 활용하여야 한다[5]. 더 나아가 3D 프린팅 기술을 재생의학용 지지체 제작에 활용할 때, 생체적합성, 천연유래(naturally derived) 재료를 사용하여 살아있는 세포를 포함하여 필요한 기관(organ) 형태로 제작을 한다면 다른 인공재료(synthetic) 지지체보다 기존 조직 및 세포들과의 생착률을 높이고 거부/면역 반응을 줄일 수 있어, 다양한 생체재료를 이용한 3D 프린팅 기술이 적극적으로 연구 및 개발되고 있다. 본 종설에서는 다양한 생체재료 및 합성재료의 생체적합성을 높이기 위한 3D 프린팅 기술의 개요 및 특징, 구조체의 표면처리, 기능성 인자(성장인자, 항체, 펩타이드 등) 부착기술 등 최신 3D 프린팅 기술의 발전방향에 대해 살펴보고자 한다.
본 론
3D 프린팅 기술의 개요 및 특징
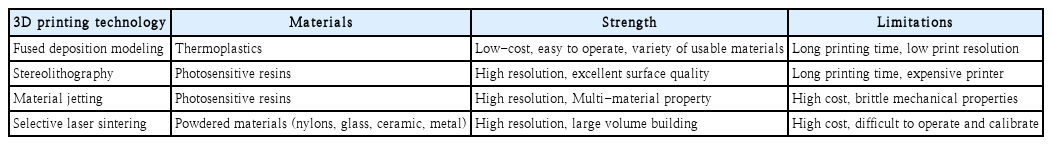
3D 프린팅 제조 기술은 기본적으로 재료를 적층하여 3차원 구조를 제작하는 것을 기본원리로 한다. 3차원 구조 재현 해상도 및 정확도 구현 방법, 사용하는 원료 물질 등에 따라 기술을 구분할 수 있으며 각각 기술은 그에 따른 장단점을 갖는다(Table 1). SLA 기법 이후 FDM, SLS, digital light processing, color jetting printing, multijet printing 등 다양한 3D 프린팅 제조 기술이 개발되어 상용화되었다[6-8]. 현재 의학분야에서 가장 널리 사용되고 있는 FDM 기술은 생체적합 고분자 재료를 녹이거나 분출할 수 있는 방식으로 제작, 압출하여 경화시킴으로써 3차원 구조체를 제작하는 방식으로, 다른 기술들과 비교하면 가장 단순하고, 경제적이며 인체에 적용할 수 있는 재료의 선택 폭이 가장 넓지만, 해상도 및 정확도가 떨어지고, 표면의 질이 높지 못하다는 단점이 있다. 또한, 출력된 구조체의 3차원 형상을 온전하게 보존하기 위해 서포터를 필요로 하는 경우가 많아 세밀한 구조를 제작하는 데 한계가 있을 수 있다. 한 걸음 나아가, 요즘 각광받는 바이오프린팅은 세포 자체를 포함한 생체 적합성 물질을 직접 3D 프린팅하여 구조체를 제작하는 기술이다[9,10]. 이를 통해 생체 적합성이 높으며, 인체 내로 세포 및 약물을 전달할 수 있고, 각 기관의 기능 대체하는 인체내 삽입형 의료기기를 제작하는 것을 목표로 한다[11]. 또한, 생체적합성 재료 및 인체 유래 세포를 이용하여 제작한 바이오 잉크는 실제 기관(organ)과 유사한 조직학적 구조 및 기능을 가진 기능성 조직을 구현할 수 있기 때문에, 간단하게는 lab-on-a-chip처럼 기존의 실험 방법보다 간단하고 저렴하게 효능평가가 가능하게 되었으며, 나아가 동물실험을 많은 부분 대체할 수도 있을 것으로 생각하고 있다[12,13].
생체적합성 분해성 고분자를 이용한 3D 프린팅 지지체 제작
의료용으로 사용되는 생체적합 분해성 고분자는 체내에서 가수분해 또는 효소분해 과정을 통해 인체에 무해한 H2O, CO2, N2, 무기염류 등 천연 부산물로 분해되는 특수한 범주의 고분자들을 일컫는다. FDA 승인된 소재로서 polyglycolic acid, poly(lactic acid), poly(lactic-co-glycolic acid), polycaprolactone (PCL) 등이 다양한 생분해성 봉합사, 스크류, 인공혈관, 인공피부, 스텐트, 인체 내 고정장치 등의 제작에 사용되고 있다. 이 중 PCL은 매우 낮은 유리전이온도(-60°C)를 가지며 상온 또는 체온에서 고무상(rubbery state)의 유연한 성질을 지니고 용융온도(60°C) 또한 매우 낮다. 이러한 성질에 기반하여 2000년대 초반부터 PCL 소재를 필라멘트로 전처리 압출성형한 후 이를 3D 프린터를 통하여 출력함으로써 최초의 3D 프린팅 조직공학 지지체로 연구 및 임상적용이 시도되었다[14]. 다양한 의료 현장에서 3D 프린팅 된 맞춤형 생분해성 제품들이 임상허가를 받아 안와골절, 두개골, 악안면 재건, 치조골 재생, 성형용 등으로 다양하게 사용되고 있다[15]. 또한 생체적합 고분자 단일 소재뿐만 아니라 tricalcium phosphate, hydroxyapatitie 등을 포함한 복합소재에 대한 많은 연구가 이루어지고 있다[16]. 생체에서 유래한 세포 외 기질(extracellular matrix)을 이용하여 바이오잉크를 제작, 이를 3D 프린팅하는 생체적합성 지지체 제작기술 또한 활발히 연구되고 있다[17]. 이런 다양한 생체 소재의 복합화와 저가의 프린팅 장비의 이점으로 인해 재료압출(material extrusion) 방식이 가장 활발하게 개발, 적용 중에 있다[18].
생체적합성 지지체의 표면처리 기술
표면 활성화(surface functionalization)는 다양한 기능성 재료를 이용하여 3D 프린팅 지지체를 코팅하거나, 지지체의 표면을 화학적 혹은 물리적 처리방법을 표면을 변화시켜 생체적합성을 높이고자 하는 기술을 말한다. 기능성 재료에는 성장인자(growth factor), 항체(antibody), 펩타이드(peptide), 핵산(nucleic acid) 또는 그 유도체(derivative)와 같은 생물학적 활성 분자가 포함되며, 3D 프린팅 구성 요소와 생물학적 개체 간의 상호 작용을 촉진하는 생체 적합성 또는 화학적 활성 코팅일 수도 있다[19].
알칼리 가수분해를 통한 표면활성화
알칼리 가수분해에서 알칼리 용액은 3D 프린팅 지지체 재료 표면과 반응하여 에스테르 결합을 분해하고 표면에 카르복실(carboxyl group, -COOH) 및 수산기(hydroxyl group, -OH)가 만들어 낸다[20]. 표면 침식 메커니즘은 3D 프린팅 지지체 표면의 상부층가 제거되어 카르복실산이 노출되며, 카르복실산 그룹은 알칼리성 용액에 존재하는 작용기와 반응하여 지지체 표면과 알칼리성 용액 사이에 공유 결합을 형성한다. 지지체의 알칼리성 가수분해는 표면 습윤성, 접착성, 인쇄성 및 염색성을 향상시킨다[21]. 이 방법은 주로 수산화나트륨(NaOH)과 같은 강염기를 사용하여 지지체의 표면 특성을 개선한다. 지지체를 NaOH 수용액에 담그면 지지체의 에스테르 및 니트릴 그룹이 가수분해되고 그 결과, 원래의 표면보다 극성과 친수성이 더 높은 카르복실산과 아미드 그룹이 형성되어 지지체의 표면 특성이 향상된다. NaOH 용액의 농도와 처리 시간이 증가하면 친수성과 표면 거칠기가 크게 증가한다. NaOH 용액 처리 시간과 농도를 조정하면 가수분해 정도를 제어할 수 있어 지지체의 표면 특성을 특정 용도에 맞게 조정할 수 있다. 이 기술은 접착력, 습윤성, 생체 적합성과 같은 특정 목적을 위해 지지체의 표면 특성을 수정하는 데 사용될 수 있으며, 매우 쉽고 저렴한 표면처리 기술 중 하나이다. 하지만 가수분해된 생성물에는 3D 프린팅 가능한 재료의 정확한 구성과 반응 조건에 따라 다양한 화학 물질이 포함될 수 있으므로 주의가 필요하다.
폴리도파민 코팅
홍합(mussel)에서 유래한 접착성 단백질인 폴리도파민(polydopamine, PDA)은 독특한 표면 코팅 능력과 풍부한 활성 부위로 인해 화학, 생물학, 의학 및 재료 과학에 널리 적용되고 있다[22]. 불과 10년 만에 PDA의 생체적합성 및 생분해 개선, 전기 전도도, 금속 이온 킬레이트화 및 산화환원 활동, 기타 잠재적 특성을 포괄하는 물리화학적 특성이 광범위하게 연구되었고, 이러한 모든 매력적인 특징 중에서 접착 특성과 화학 반응성은 3D 프린팅 지지체의 표면활성화에 적극적으로 이용된다. 도파민은 특히 알칼리성 용질 안에서, oxidative polymerization을 통해 다양한 재료 표면에 접착성 PDA 박막(thin film)을 형성할 수 있다. 이를 통해 PDA 필름은 표면에 카테콜(catechol), 아민(amine), 이민(imine)과 같은 많은 반응성 그룹을 결합시키는 2차 반응을 위한 중요한 플랫폼을 제공할 수 있어, 우리가 원하는 다양한 분자와의 공유 결합을 위한 출발점 역할을 할 수 있다. 또한, PDA nanomembrane의 거칠기(roughness) 또한 접착력을 결정하는 요인으로, 위에서 언급한 여러 가지 기전을 통해 PDA 코팅은 3D 프린팅 지지체의 표면 기능화에 매우 중요하게 사용되고 있다[23]. 도파민의 self-polymerization과 PDA의 증착은 매우 간편하지만, 일반적으로 시간이 많이 걸리는 과정이다. 알칼리성 수성 용액(일반적으로 pH 8.5의 Tris-HCl 완충액)에서 도파민 단량체(dopamine hydrochloride)의 용해 및 중합을 포함하여 12시간 이상이 소요되며, 색상은 무색에서 진한 갈색으로 변하게 된다[24].
UV 광결합반응
UV photografting (광결합반응)은 UV 광선을 사용하여 재료에 작용기를 접목시키는 표면 변형 기술이다. UV 광은 광범위한 중합 반응(polymerization)을 일으켜서 기능성 인자를 재료 표면에 연결하는 공유 결합을 생성시킬 수 있다. 지지체에서의 광결합반응은 표면에 친수성 작용기를 접목하여 친수성과 생체 적합성을 향상시킨다[25]. UV 방사선에 노출되면 결합 배열의 광개시제(photo-initiator: UV 또는 가시광선하에 라디칼[radical]을 형성해 광가교 물질인 고분자 또는 리간드[ligand]의 가교 반응이 효율적으로 일어날 수 있도록 도와주는 물질)가 자유 라디칼(free radical)을 생성하여 결합 단량체(monomer)와 지지체 표면 사이의 공유결합의 생성을 촉발한다. 공유결합을 일으키는 단량체의 종류와 농도, 조사 시간, UV 광의 강도 등이 표면 개질에 영향을 미치는 여러 가지 요소이다. 또한 광결합반응을 통해 표면 거칠기(surface roughness)가 증가하여 기능성인자의 기계적 결합 또한 향상될 수 있다. 지지체에 다양한 재료에 결합시킴으로써 증가된 친수성 및 생체 적합성이 지지체의 세포침투력을 증가시키고, 면역원성을 감소시킬 수 있다[26].
플라즈마를 이용한 표면활성화
플라즈마 처리 방법은 상온 상압 플라즈마(non-thermal atmospheric plasma)를 이용하여 재료의 표면을 개질하는 방법이다. 지지체가 산소, 질소, 아르곤 플라즈마를 포함한 다양한 유형의 플라즈마에 노출되면 변형이 일어나 표면 친수성, 세포 접착성 및 생분해성을 향상시킬 수 있다. 지지체 표면은 플라즈마 처리 공정 전반에 걸쳐 화학적, 물리적으로 변화하게 된다[27]. 이온, 라디칼 및 전자를 포함하는 플라즈마와 지지체의 표면 작용기 간의 상호 작용으로 인해 새로운 화학 결합 및 작용기가 생성될 수 있다. 지지체 표면의 플라즈마 유도 식각은 표면의 물리적 변경을 초래하며, 지지체 표면의 최상층은 플라즈마 처리에 의해 제거될 수 있어 그 아래의 표면이 드러나고 표면 특성이 향상될 수 있다. 상온 상압 플라즈마가 지지체의 세포 접착력, 친수성, 내구성, 면역원성 등의 특성을 향상시키는 것으로 알려져 있다. 플라즈마 처리를 통해 카르복실산, 수산기 및 아미노기를 포함한 여러 기능 그룹을 지지체 표면 기능 그룹에 추가할 수도 있다. 이러한 작용기는 표면 에너지와 표면 친수성을 높여 다른 재료와의 접착력을 향상시킬 수 있다.
고찰 및 결론
3D 프린팅을 이용한 지지체 제작, 의료기기 제작 기술은 각각의 환자 맞춤형 인체 삽입 보형물 또는 의료기기 등을 제작하여, 복잡하고 3차원 구조를 갖는 환자별 결손 조직을 재건하는 적절한 수술 계획 수립 및 난치성 질환의 해결에 희망을 보여주고 있다. 이렇게 축적되는 임상 경험 및 기록들은 디지털화되어 관리할 수 있기 때문에 대면 진료가 아니더라도 환자의 의료영상과 3D 프린터만으로 조직재생 의료기기의 제조가 가능해지며, 이는 전국적인, 더 나아가 전세계적인 의료의 질을 상향 평준화할 수 있는 비젼을 제시하고 있다. 물론 3D 프린팅이 실제 임상의학 현장에서 적극적으로 보편화되기에는 극복해야만 하는 현실적인 문제들이 많이 존재한다. 임상적으로 의료영상을 기반으로 한 영상 프로세싱 및 모델링을 위해 획득하는 의료영상의 표준화 및 질향상이 필요하며, 다양한 임상경험을 통해 영상만으로 확인하기 어려운 임상인자들을 반영하기 위한 3D 프린팅 의료기기 표준화 치료 가이드라인이 만들어져야 할 것이다. 그리고 임상적 수요에 상응하는 영상분할 및 모델링, 적절한 3D 프린팅 기술 및 재료를 선정하는 과정이 필요할 것이며, 이러한 프린팅 기술 개발, 재료 개선 연구는 중개의학의 영역으로 임상의사들과 연구자들이 적극적으로 협력하여 질환 특이, 환자 특이 지지체 제작을 위한 적극적인 연구개발 투자가 이루어져야 할 것이다. 따라서 앞서 언급된 일련의 사항들이 의료분야에서 합리적이고 효율적으로 수행될 수 있도록 프로토콜을 확립하고, 신기술을 도입할 필요가 있다. 이를 통해 향후 3D 프린팅 기술의 장점을 이용한 조직재생 지지체 및 인체삽입 의료기기가 많이 개발되어 임상의학에 적용될 것으로 생각된다.
Acknowledgements
This work was supported by the Basic Science Research Program through the National Research Foundation of Korea (NRF) funded by the Ministry of Education, Science, and Technology (NRF-2018R1D1A1A02043691), a grant of the Korea Health Technology R&D Project through the Korea Health Industry Development Institute (KHIDI), funded by the Ministry of Health & Welfare, Republic of Korea (HR21C1003).