ņä£ ļĪĀ
Ēö╝Ēåżņ╣śļō£ļĪ£ ņĢīļĀżņ¦ä ļéśļ¼┤ņĀĢņ£ĀļŖö ņłśļ¬®ļōżņØ┤ ņŻ╝ņ£äņØś ĒĢ┤ņČ®ņØ┤ļéś ļ»ĖņāØļ¼╝ļĪ£ļČĆĒä░ ņ×ÉņŗĀņØä ļ░®ņ¢┤ĒĢśĻĖ░ ņ£äĒĢ┤ Ļ│ĄĻĖ░ ņżæ ļśÉļŖö ļĢģ ņåŹņŚÉ ļ░£ņé░ĒĢśļŖö ļ¼┤ļÅģņä▒ņØś Ē£śļ░£ņä▒ ļ░®Ē¢ź ļ¼╝ņ¦łņØä ņ┤Øņ╣ŁĒĢ£ļŗż. Phenolics, terpenoid, alkaloid, phenylpropane, acetogenin ļō▒ņØś ĒÖöĒĢ®ļ¼╝ļĪ£ ĻĄ¼ņä▒ļÉśņ¢┤ ņ׳ņ£╝ļ®░ ĒĢŁņäĖĻĘĀ, ĒĢŁņ¦äĻĘĀ ļō▒ņØś ĒĢŁĻĘĀļĀźņØä Ļ░Ćņ¦ĆĻ│Ā ņ׳ļŗż[1-5]. ņĄ£ĻĘ╝ ņéČņØś ņ¦łņŚÉ ļīĆĒĢ£ Ļ┤Ćņŗ¼ņØ┤ ļåÆņĢäņ¦Ćļ®┤ņä£ ņ▓£ņŚ░ļ¼╝ņ¦łņØś Ļ░Ćņ╣śņÖĆ ĒÖ£ņÜ®ļÅäņŚÉ ļīĆĒĢ£ Ļ┤Ćņŗ¼ņØ┤ ņ”ØĻ░ĆļÉśņŚłĻ│Ā Ļ▒┤Ļ░Ģ ļ│┤ņĪ░ņĀ£, ĒÖöņןĒÆł, ļ░®Ē¢źņĀ£, Ē¢źĻĖ░ņ╣śļŻī ļō▒ ļŗżņ¢æĒĢ£ ļČäņĢ╝ņŚÉņä£ ļéśļ¼┤ņĀĢņ£ĀĻ░Ć ņé¼ņÜ®ļÉśĻ│Ā ņ׳ļŗż[6,7]. ĒÄĖļ░▒ļéśļ¼┤, ĻĄ¼ņāüļéśļ¼┤, ĒÖöļ░▒ļéśļ¼┤, ņé╝ļéśļ¼┤ ļō▒ņØ┤ Ļ│äņĀłņŚÉ ņāüĻ┤ĆņŚåņØ┤ ļ¦ÄņØĆ ņ¢æņØś ļéśļ¼┤ņĀĢņ£Āļź╝ ļČäļ╣äĒĢśļ®░ ĒŖ╣Ē׳ ĒÄĖļ░▒ņĀĢņ£ĀļŖö ņØ┤ļōż ņżæ Ļ░Ćņן ļ¦ÄņØĆ ļéśļ¼┤ņĀĢņ£Āļź╝ ĒĢ©ņ£ĀĒĢśĻ│Ā ņ׳ļŗż. ĒÄĖļ░▒ļéśļ¼┤ļŖö ņĢäņŚ┤ļīĆņä▒ ņŗØļ¼╝ļĪ£ ĻĄŁļé┤ņŚÉņä£ļŖö ļé©ĒĢ┤ņĢł ņ¦ĆņŚŁņŚÉ ĻĄ░ļØĮņ¦ĆĻ░Ć ļČäĒżĒĢśĻ│Ā ņ׳ņ£╝ļ®░ ĻĄŁļé┤ņŚÉņä£ļÅä ĒĢŁĻĘĀ, ĒĢŁņ¦äĻĘĀ ĒÜ©Ļ│╝ ļō▒ņŚÉ ļīĆĒĢ£ ļŗżņ¢æĒĢ£ ņŚ░ĻĄ¼Ļ░Ć ņØ┤ļŻ©ņ¢┤ņĀĖ ņÖöļŗż[8-10]. ĒÄĖļ░▒ņĀĢņ£ĀņØś Ļ▓ĮņÜ░ ņØ╝ļ│ĖĻ│╝ ļīĆļ¦ī ņ¦ĆņŚŁņŚÉņä£ ļ¦ÄņØĆ ņŚ░ĻĄ¼Ļ░Ć ņØ┤ļŻ©ņ¢┤ņĀĖ ņÖöņ£╝ļ®░ ņ¦ĆņŚŁņŚÉ ļö░ļØ╝ ņĀĢņ£ĀņØś ĻĄ¼ņä▒ ņä▒ļČäņŚÉ ņ░©ņØ┤Ļ░Ć ņ׳ņ¢┤ ņĄ£ĻĘ╝ņŚÉ ĻĄŁļé┤ ņŚ░ĻĄ¼Ļ░Ć ņ¦äĒ¢ēļÉśĻĖ░ ņŗ£ņ×æĒĢśļ®┤ņä£ ļŗżņ¢æĒĢ£ ņśüņŚŁņŚÉņä£ņØś ĒÜ©Ļ│╝Ļ░Ć ņ×ģņ”Ø, ĒÖ£ņÜ®ļÉśĻ│Ā ņ׳ļŗż[9,11].
ļ”╝ĒöäĻĄ¼ļŖö ņĢīļĀłļź┤ĻĖ░ ļ░Å Ļ░ÉņŚ╝ņä▒ ņŚ╝ņ”Øļ░śņØæņŚÉ Ļ┤ĆņŚ¼ĒĢśļŖö ļ®┤ņŚŁņĪ░ņĀł ņäĖĒżļĪ£ ļŗżņ¢æĒĢ£ ĒÖöĒĢÖļ¦żĻ░£ļ¼╝ņ¦łņØä ļ¦īļōżņ¢┤ ļŗżļźĖ ņŚ╝ņ”ØņäĖĒżņÖĆ ņŚ╝ņ”ØņĪ░ņ¦üņØś ļ®┤ņŚŁļ░śņØæņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣£ļŗż[12]. ņ”ē ļ”╝ĒöäĻĄ¼ņŚÉņä£ ļ¦īļōżņ¢┤ņ¦ĆļŖö ĒÖöĒĢÖļ¦żĻ░£ļ¼╝ņ¦łņŚÉ ņØśĒĢ┤ ļ®┤ņŚŁĻĖ░ļŖźņØ┤ ņŗ£ņ×æ, ņ£Āņ¦Ć, ņĪ░ņĀłļÉśļ®░ ņØ┤ļōż ĒÖöĒĢÖļ¦żĻ░£ļ¼╝ņ¦ł ņāØņä▒ņØś Ļ┤Ćļ”¼ļŖö ņŚ╝ņ”Øļ░śņØæņØä ņ¢ĄņĀ£ĒĢĀ ņłś ņ׳ļŖö ņżæņÜöĒĢ£ ņ╣śļŻī ņłśļŗ©ņØ┤ ļÉĀ ņłś ņ׳ļŗż. ļ¦Éņ┤łĒśłņĢĪ ļŗ©ĒĢĄĻĄ¼ļŖö ļ”╝ĒöäĻĄ¼, ļŗ©ĒĢĄĻĄ¼, ņłśņāüņäĖĒż ļō▒ņ£╝ļĪ£ ĻĄ¼ņä▒ļÉśņ¢┤ ņ׳ņ£╝ļ®░, ņØ┤ļōż ņŚ╝ņ”ØņäĖĒżņŚÉņä£ ļ¦īļōżņ¢┤ņ¦ĆļŖö ĒÖöĒĢÖļ¦żĻ░£ļ¼╝ņ¦łņŚÉ ņØśĒĢ┤ ņŚ╝ņ”Øņä▒ ļ®┤ņŚŁļ░śņØæņØ┤ ņĪ░ņĀłļÉśĻ│Ā ņ׳ņ¢┤ ņØ┤ļōż ĒÖöĒĢÖļ¦żĻ░£ļ¼╝ņ¦łņØś ņĪ░ņĀłņØ┤ ņŚ╝ņ”Øņä▒ ņ¦łĒÖśņØś ņ╣śļŻīņŚÉ ņżæņÜöĒĢ£ ņŚŁĒĢĀņØä ļŗ┤ļŗ╣ĒĢĀ Ļ▓āņØ┤ļŗż. ĒÖöĒĢÖļ¦żĻ░£ļ¼╝ņ¦łņØś ņāØņä▒ņØä ņ¢ĄņĀ£ĒĢśļŖö ļŗżņ¢æĒĢ£ ļ¼╝ņ¦łņØ┤ ņé¼ņÜ®ļÉśĻ│Ā ņ׳ņ£╝ļ®░ ļéśļ¼┤ņĀĢņ£Ā ļśÉĒĢ£ ņŚ╝ņ”ØņäĖĒżņØś ĒÖöĒĢÖļ¦żĻ░£ļ¼╝ņ¦łņØä ņ¢ĄņĀ£ĒĢśņŚ¼ ĒĢŁņŚ╝ņ”Ø ĒÜ©Ļ│╝ļź╝ Ļ░Ćņ¦ĆļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż[13,14].
ļ│Ė ņŚ░ĻĄ¼ļŖö ĻĄŁļé┤ņŚÉņä£ ņāØņé░ļÉ£ ĒÄĖļ░▒ņĀĢņ£Āļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ļ¦Éņ┤łĒśłņĢĪ ļŗ©ĒĢĄĻĄ¼ņØś ĒÖ£ņä▒ĒÖö Ļ│╝ņĀĢņŚÉņä£ ļ¦īļōżņ¢┤ņ¦ĆļŖö ĒÖöĒĢÖļ¦żĻ░£ļ¼╝ņ¦łņØś ņāØņä▒ņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņØä ĒÖĢņØĖĒĢ©ņ£╝ļĪ£ņŹ© ĒÄĖļ░▒ņĀĢņ£ĀņØś ĒĢŁņŚ╝ņ”Ø ņ╣śļŻīņĀ£ļĪ£ņä£ņØś ĒÖ£ņÜ® Ļ░ĆļŖźņä▒ņØä ĒÖĢņØĖĒĢśĻ│Āņ×É ĒĢśņśĆļŗż.
ļīĆņāü ļ░Å ļ░®ļ▓Ģ
ļ¦Éņ┤łĒśłņĢĪ ļŗ©ĒĢĄĻĄ¼ņØś ļČäļ”¼ ļ░Å ĒÖ£ņä▒ĒÖö
ļ¦Éņ┤łĒśłņĢĪ ļŗ©ĒĢĄĻĄ¼ļŖö Ļ░ÉņŚ╝ņä▒ Ēś╣ņØĆ ņĢīļĀłļź┤ĻĖ░ņä▒ ņ¦łĒÖśņØ┤ ņŚåņ£╝ļ®┤ņä£, ņĄ£ĻĘ╝ 4ņŻ╝ ņØ┤ļé┤ ĒĢŁņāØņĀ£, ĒĢŁĒ׳ņŖżĒāĆļ»╝ņĀ£ ļō▒ņØś ņĢĮļ¼╝ Ēł¼ņŚ¼ļź╝ ļ░øņ¦Ć ņĢŖņØĆ 25~45ņäĖņØś Ļ▒┤Ļ░ĢĒĢ£ ņä▒ņØĖ ļé©ņ×É 7ļ¬ģ, ņŚ¼ņ×É 3ļ¬ģņØś ļ¦Éņ┤łĒśłņĢĪņŚÉņä£ ļČäļ”¼ĒĢśņśĆņ£╝ļ®░, ņ░ĖņŚ¼ĒĢ£ ļ¬©ļōĀ ļīĆņāüņ×ÉņØś ļÅÖņØśļź╝ ļ░øņĢśļŗż. ņŚ░ĻĄ¼ļŖö ļīĆĻĄ¼Ļ░ĆĒå©ļ”ŁļīĆĒĢÖĻĄÉļ│æņøÉ ņ×äņāüņŗ£ĒŚś ņ£żļ”¼ ņ£äņøÉĒÜīņØś Ļ▓ĆĒåĀņÖĆ ņŖ╣ņØĖņØä ņ¢╗ņØĆ Ēøä ņ¦äĒ¢ēĒĢśņśĆļŗż(CR-14-070).
ļ¦Éņ┤łĒśłņĢĪ ļŗ©ĒĢĄĻĄ¼ļŖö ĒŚżĒīīļ”░ ņ▓śļ”¼ļÉ£ ĒśłņĢĪņØä density gradient centrifugation ļ▓ĢņØä ņØ┤ņÜ®ĒĢśņŚ¼ ļČäļ”¼ĒĢśņśĆļŗż. ļ¦Éņ┤łĒśłņĢĪ ļŗ©ĒĢĄĻĄ¼ 2├Ś106/mLļź╝ 10% calf serum, 2 umol/L glutamine, 50 umol/L 2-mercaptoethanolņØ┤ ņä×ņØĖ RPMI-1640ņØä ņØ┤ņÜ®ĒĢśņŚ¼ 37Ōäā, 5% CO2ņŚÉņä£ ļ░░ņ¢æĒĢśņśĆļŗż. ņØ┤ļĢī ļ¦Éņ┤łĒśłņĢĪ ļŗ©ĒĢĄĻĄ¼ņÖĆ ĒĢ©Ļ╗ś 5 ug/mLņØś phytohaemagglutinin(PHA: Life Technologies, Grand Island, NY, USA)Ļ│╝ 10 ug/mLņØś lipopolysaccharide(LPS: Sigma, St. Louis, MO, USA)ļź╝ ļäŻĻ│Ā 8, 24, 48, 72ņŗ£Ļ░ä ļ░░ņ¢æ Ēøä ņāüņĖĄņĢĪņØä ņ¢╗ņ¢┤ tumor necrosis factor-╬▒(TNF-╬▒), Interleukin-5(IL-5), interferon-╬│(INF-╬│)ļź╝ ĒÜ©ņåīļ®┤ņŚŁņĖĪņĀĢļ▓ĢņØä ņØ┤ņÜ®ĒĢśņŚ¼ ņĖĪņĀĢĒĢśņśĆļŗż(Endogen, Wobrun, MA, USA). TNF-╬▒, IL-5, INF-╬│ ļ¬©ļæÉ 2 pg/mL ņØ┤ņāüņØś ļ»╝Ļ░ÉļÅäļź╝ Ļ░Ćņ¦ĆĻ│Ā ņ׳ņŚłļŗż.
ĒÄĖļ░▒ņĀĢņ£ĀļŖö ĒÄĖļ░▒ļéśļ¼┤ņØś ņ×öĻ░Ćņ¦ĆņÖĆ ņ×ÄņØä Ļ│Āņś© ņŖżĒīĆ ņ▓śļ”¼ Ēøä ņØæņČĢņŗ£Ēé© ņĀĢņ£Āļź╝ ĒüÉņø░ņé¼(Seoul, Korea)ņŚÉņä£ ņĀ£Ļ│Ąļ░øņĢä ņé¼ņÜ®ĒĢśņśĆļŗż. ĒÄĖļ░▒ņĀĢņ£ĀņØś ņäĖĒżļÅģņä▒ņØä ĒÖĢņØĖĒĢśĻĖ░ ņ£äĒĢśņŚ¼ ĒÄĖļ░▒ņĀĢņ£Ā 0.05, 0.1, 0.2, 1%ļź╝ ļ¦Éņ┤łĒśłņĢĪ ļŗ©ĒĢĄĻĄ¼ņÖĆ ĒĢ©Ļ╗ś 8, 24, 48, 72ņŗ£Ļ░ä ļÅÖņĢł ļ░░ņ¢æ Ēøä Promegaņé¼(Madison, WI, USA)ņØś CellTiter-96Ōōć aqueous cell proliferation assay ĒéżĒŖĖļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņäĖĒżņ”ØņŗØņØä ņĖĪņĀĢĒĢśņśĆļŗż. Ļ▓Ćņé¼ ļ░®ļ▓ĢņØä Ļ░äļŗ©Ē׳ ņé┤ĒÄ┤ļ│┤ļ®┤, ļ░░ņ¢æļÉ£ ļ¦Éņ┤łĒśłņĢĪ ļŗ©ĒĢĄĻĄ¼ņŚÉ tetrazolium ĒĢ®ņä▒ļ¼╝ 2 mLņÖĆ phenazine ethosulfate 100 uLļź╝ ņä×ņØĆ Ēøä wellļŗ╣ 20 uLņØś Ēś╝ĒĢ®ņÜ®ņĢĪņØä ņ▓©Ļ░ĆĒĢśņŚ¼ 1ņŗ£Ļ░ä ļÅÖņĢł ļ░░ņ¢æ Ēøä 490 nmņØś ELISA reader(Modecular Devices, Sunnyvale, CA, USA)ļź╝ ņé¼ņÜ®ĒĢśņŚ¼ ĒØĪĻ┤æļÅäļź╝ ņĖĪņĀĢĒĢśņśĆļŗż.
ĒÄĖļ░▒ņĀĢņ£ĀņØś ĒĢŁņŚ╝ņ”Ø ĒÜ©Ļ│╝ļŖö ļ¦Éņ┤łĒśłņĢĪ ļŗ©ĒĢĄĻĄ¼ņŚÉ 5 ug/mLņØś PHA Ēś╣ņØĆ 10 ug/mLņØś LPSņÖĆ ĒĢ©Ļ╗ś ĒÄĖļ░▒ņĀĢņ£Ā 0.05, 0.1, 0.2%ļź╝ ļäŻĻ│Ā 8, 24, 48, 72ņŗ£Ļ░ä ļ░░ņ¢æ Ēøä ņāüņĖĄņĢĪņØä ņ¢╗ņ¢┤ TNF-╬▒, IL-5, INF-╬│ļź╝ ņĖĪņĀĢĒĢśņŚ¼ ļ╣äĻĄÉĒĢśņśĆļŗż.
ĒåĄĻ│äļČäņäØ
ņŗżĒŚśņØĆ ņĄ£ņåī 5ĒÜī ņØ┤ņāü ļ░śļ│ĄĒĢśņŚ¼ ņŗ£Ē¢ēĒĢśņśĆņ£╝ļ®░ ņ¢╗ņ¢┤ņ¦ä Ļ▓░Ļ│╝ļŖö ĒÅēĻĘĀ┬▒Ēæ£ņżĆĒÄĖņ░©ļĪ£ Ēæ£ĻĖ░ĒĢśņśĆļŗż. ļ¦Éņ┤łĒśłņĢĪ ļŗ©ĒĢĄĻĄ¼ņØś ņäĖĒżļÅģņä▒ņØĆ Mann-Whitney U testļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ļ╣äĻĄÉĒĢśņśĆĻ│Ā, ĒÄĖļ░▒ņĀĢņ£ĀņØś ĒĢŁņŚ╝ņ”Ø ĒÜ©Ļ│╝ļŖö Wilcoxon matched paired testļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ļ╣äĻĄÉĒĢśņśĆļŗż(SPSS ver. 21.0, IBM Corp., Armonk, NY, USA).
Ļ▓░ Ļ│╝
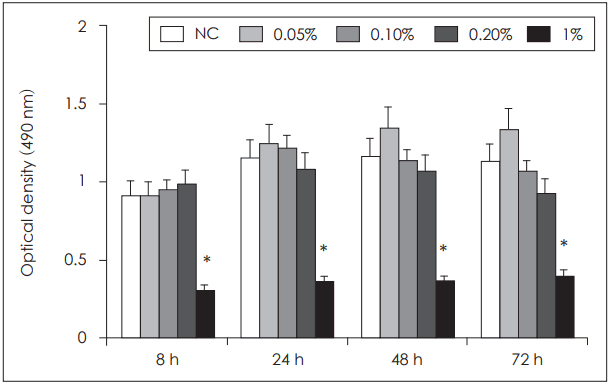
ļŗżņ¢æĒĢ£ ļåŹļÅäņØś ĒÄĖļ░▒ņĀĢņ£ĀņÖĆ ĒĢ©Ļ╗ś ļ¦Éņ┤łĒśłņĢĪ ļŗ©ĒĢĄĻĄ¼ļź╝ 8, 24, 48, 72ņŗ£Ļ░ä ļ░░ņ¢æĒĢśņśĆņØä ļĢī 1% ĒÄĖļ░▒ņĀĢņ£ĀļĪ£ ļ¦Éņ┤łĒśłņĢĪ ļŗ©ĒĢĄĻĄ¼ļź╝ ņ▓śļ”¼ĒĢ£ Ļ▓ĮņÜ░ ļ░░ņ¢æ ņŗ£Ļ░äņŚÉ Ļ┤ĆĻ│äņŚåņØ┤ ņäĖĒżņØś ņāØņĪ┤ņØ┤ 50% ņØ┤ņāü Ļ░ÉņåīĒĢ©ņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłņ£╝ļéś ĻĘĖ ņØ┤ĒĢśņØś ļåŹļÅäņŚÉņä£ļŖö ņäĖĒżļÅģņä▒ņØä ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśņ£╝ļ®░ 0.05%ņØś ļé«ņØĆ ļåŹļÅäņŚÉņä£ļŖö ņäĖĒż ņ”ØņŗØņØ┤ ņ”ØĻ░ĆĒĢśļŖö ņ¢æņāüņØä ļ│┤ņŚ¼ ņØ┤Ēøä ņŚ░ĻĄ¼ļŖö 0.2% ņØ┤ĒĢśņØś ļåŹļÅäņŚÉņä£ ņŗżĒŚśņØä ņ¦äĒ¢ēĒĢśņśĆļŗż(Fig. 1).
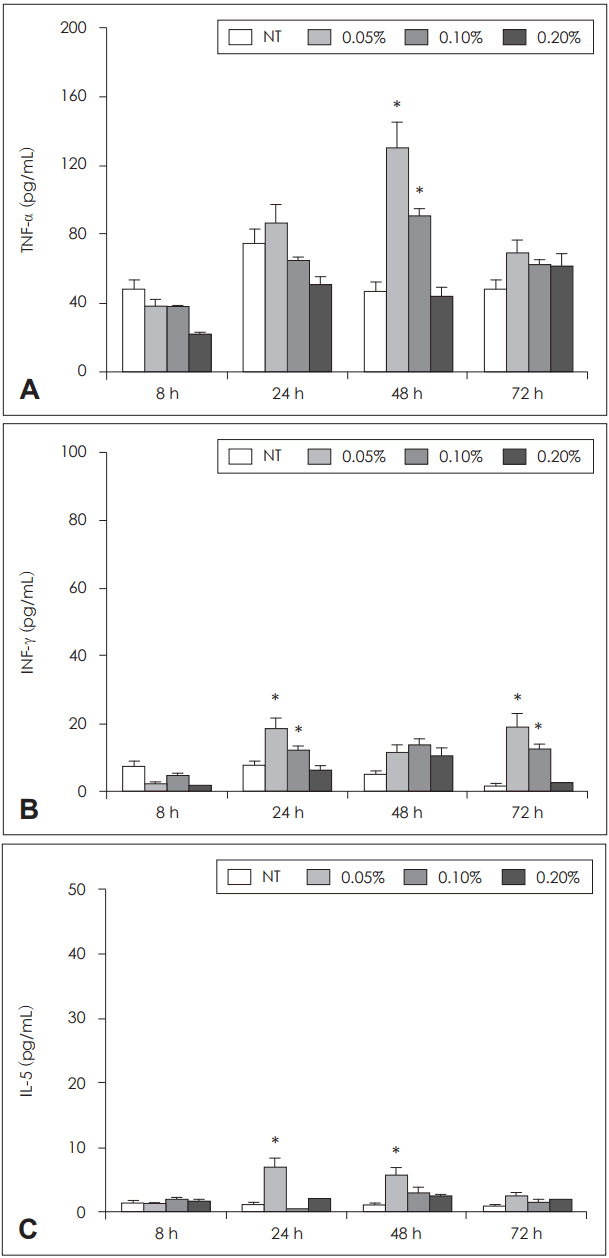
ĒÄĖļ░▒ņĀĢņ£ĀĻ░Ć ļ¦Éņ┤łĒśłņĢĪ ļŗ©ĒĢĄĻĄ¼ņØś ĒÖ£ņä▒ĒÖöņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņØä ĒÖĢņØĖĒĢśĻĖ░ ņ£äĒĢśņŚ¼ ļ¦Éņ┤łĒśłņĢĪ ļŗ©ĒĢĄĻĄ¼ņÖĆ ļŗżņ¢æĒĢ£ ļåŹļÅäņØś ĒÄĖļ░▒ņĀĢņ£Āļź╝ 8, 24, 48, 72ņŗ£Ļ░ä ļ░░ņ¢æĒĢśņśĆņØä ļĢī TNF-╬▒ņØś Ļ▓ĮņÜ░ ļ░░ņ¢æ 48ņŗ£Ļ░äņŚÉ ĒÄĖļ░▒ņĀĢņ£Ā 0.05%(129.5┬▒43.2 pg/mL)ņÖĆ 0.1%(90.0 ┬▒18.5 pg/mL)Ļ░Ć ļīĆņĪ░ĻĄ░(47.0┬▒12.7 pg/mL)ņŚÉ ļ╣äĒĢ┤ ņ£ĀņØśĒĢ£ ņ”ØĻ░Ć ņåīĻ▓¼ņØä ļ│┤ņśĆņ£╝ļ®░, INF-╬│ņØś Ļ▓ĮņÜ░ļŖö ļ░░ņ¢æ 24ņŗ£Ļ░äĻ│╝ 72ņŗ£Ļ░äņŚÉ ĒÄĖļ░▒ņĀĢņ£Ā 0.05%ņÖĆ 0.1%ņŚÉņä£ ņ£ĀņØśĒĢ£ ņ”ØĻ░Ć ņåīĻ▓¼ņØä ļ│┤ņśĆņ£╝ļ®░, IL-5ņØś Ļ▓ĮņÜ░ļŖö ļ░░ņ¢æ 24ņŗ£Ļ░äĻ│╝ 48ņŗ£Ļ░äņŚÉ ĒÄĖļ░▒ņĀĢņ£Ā 0.05%ņŚÉ ņØśĒĢ£ ņ£ĀņØśĒĢ£ ņ”ØĻ░ĆņåīĻ▓¼ņØä ļ│┤ņśĆņ£╝ļéś(p’╝£0.05) ĒÄĖļ░▒ņĀĢņ£ĀļŖö ļ¦Éņ┤łĒśłņĢĪ ļŗ©ĒĢĄĻĄ¼ņØś INF-╬│ņÖĆ IL-5 ņāØņä▒ņŚÉ Ļ░ĢĒĢśĻ▓ī ņśüĒ¢źņØä ļ»Ėņ╣śņ¦ĆļŖö ņĢŖņĢśļŗż(Fig. 2).
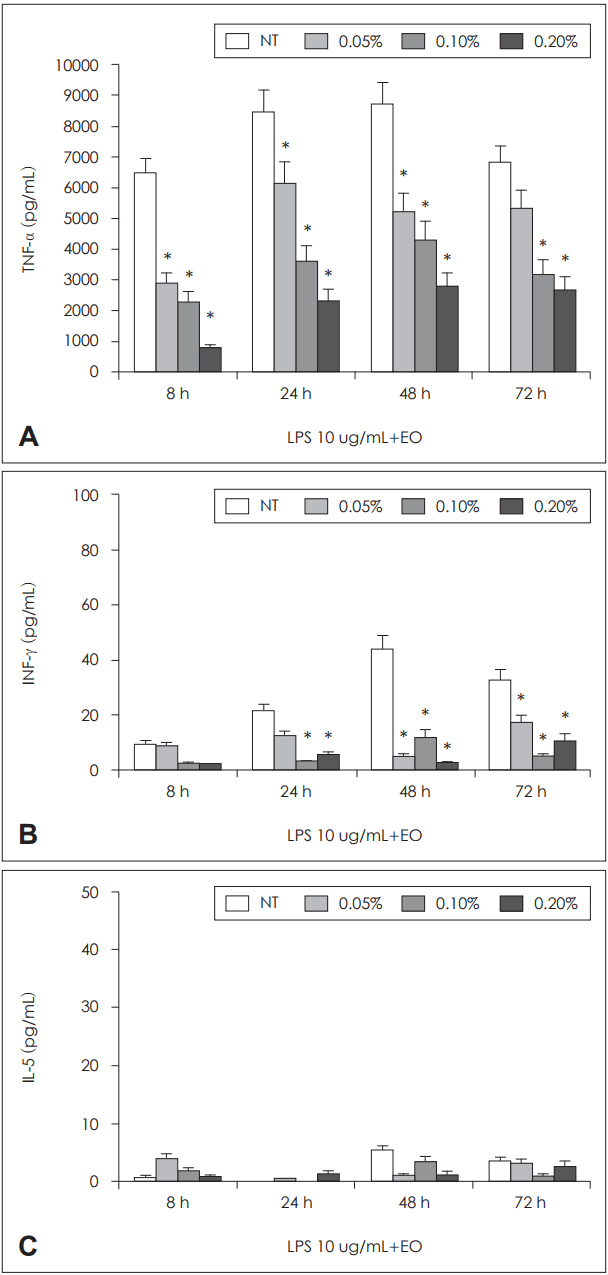
ļ¦Éņ┤łĒśłņĢĪ ļŗ©ĒĢĄĻĄ¼ļź╝ ĻĘĖļ×īņØīņä▒ĻĘĀņØś ņäĖĒżļ▓Į ņä▒ļČäņØĖ LPSļĪ£ ĒÖ£ņä▒ĒÖöļź╝ ņ£ĀļÅäĒĢ£ Ļ▓ĮņÜ░ LPSņŚÉ ņØśĒĢ£ TNF-╬▒ņØś ņāØņä▒ņØĆ ĒÄĖļ░▒ņĀĢņ£Ā ļåŹļÅäņØś ņ”ØĻ░ĆņŚÉ ļö░ļØ╝ ļ░░ņ¢æ 8, 24, 48, 72ņŗ£Ļ░ä ļ¬©ļæÉņŚÉņä£ ņ£ĀņØśĒĢśĻ▓ī Ļ░ÉņåīļÉ©ņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłĻ│Ā, INF-╬│ņØś ņāØņä▒ņØĆ ļ░░ņ¢æ 24ņŗ£Ļ░ä ņØ┤ĒøäļČĆĒä░ ĒÄĖļ░▒ņĀĢņ£ĀņŚÉ ņØśĒĢ┤ ņ£ĀņØśĒĢśĻ▓ī ņāØņä▒ņØ┤ ņ¢ĄņĀ£ļÉ©ņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłļŗż. ĒĢśņ¦Ćļ¦ī LPSļŖö ļ¦Éņ┤łĒśłņĢĪ ļŗ©ĒĢĄĻĄ¼ņØś IL-5ņāØņä▒ņØä ņ£ĀļÅäĒĢśņ¦Ć ļ¬╗ĒĢśņśĆņ£╝ļ®░ ĒÄĖļ░▒ņĀĢņ£Ā ļśÉĒĢ£ IL-5ņØś ņāØņä▒ņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣śņ¦ĆļŖö ļ¬╗ĒĢśņśĆļŗż(Fig. 3).
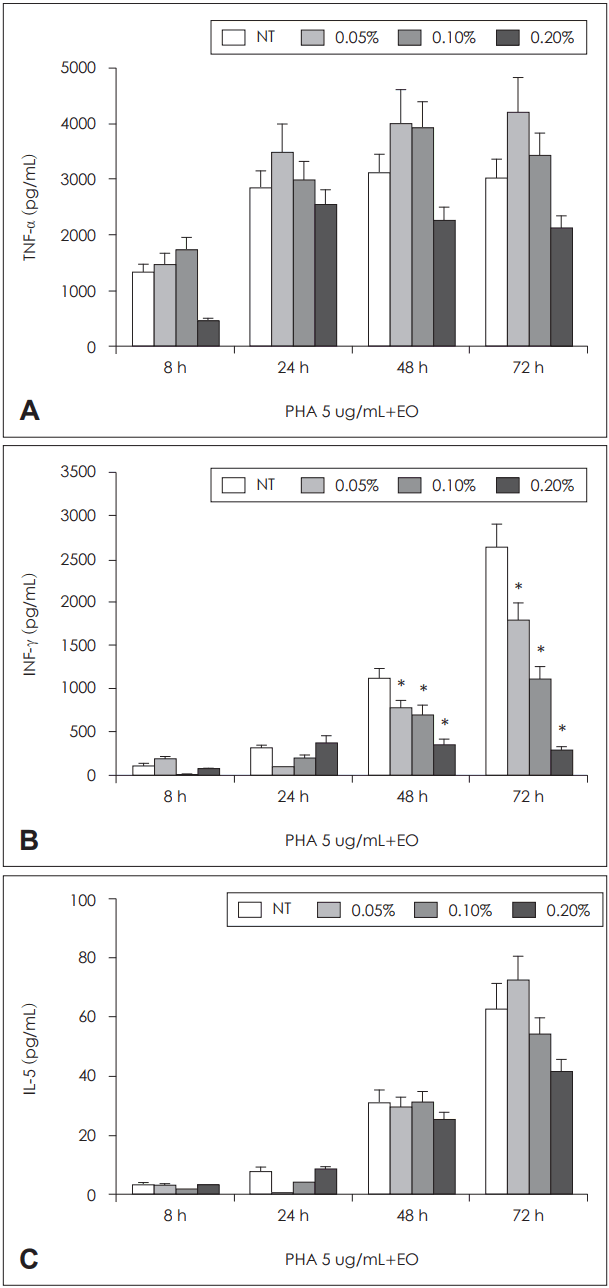
ļ”╝ĒöäĻĄ¼ ĒÖ£ņä▒ļ¼╝ņ¦łņØĖ PHAļĪ£ ļ¦Éņ┤łĒśłņĢĪ ļŗ©ĒĢĄĻĄ¼ņØś ĒÖ£ņä▒ĒÖöļź╝ ņ£ĀļÅäĒĢ£ Ļ▓ĮņÜ░ ņØīņä▒ļīĆņĪ░ĻĄ░ņŚÉ ļ╣äĒĢ┤ TNF-╬▒, IL-5, INF-╬│ ļ¬©ļæÉ ņāØņä▒ņØ┤ ņ”ØĻ░ĆĒĢśņśĆņ£╝ļ®░, PHAņŚÉ ņØśĒĢ£ INF-╬│ņØś ņāØņä▒ņØ┤ ļ░░ņ¢æ 48ņŗ£Ļ░äĻ│╝ 72ņŗ£Ļ░äņŚÉ ĒÄĖļ░▒ņĀĢņ£ĀņØś ļåŹļÅä ņ”ØĻ░ĆņŚÉ ļö░ļØ╝ ņ£ĀņØśĒĢśĻ▓ī ņ¢ĄņĀ£ļÉ©ņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłļŗż. PHAņŚÉ ņØśĒĢ£ TNF-╬▒ņÖĆ IL-5ņØś ņāØņä▒ņØĆ 0.2%ņØś ĒÄĖļ░▒ņĀĢņ£ĀļĪ£ ņ▓śļ”¼ĒĢ£ Ļ▓ĮņÜ░ņŚÉļ¦ī ņāØņä▒ ņ¢ĄņĀ£ļÉśļŖö Ļ▓ĮĒ¢źņØä ļ│┤ņśĆņ£╝ļéś ĒåĄĻ│äņĀü ņ£ĀņØśņä▒ņØä ļ│┤ņØ┤ņ¦ĆļŖö ņĢŖņĢśļŗż(Fig. 4).
Ļ│Ā ņ░░
ņŗØļ¼╝Ļ│╝ ļéśļ¼┤ņĀĢņ£ĀļŖö ņśżļלņĀäļČĆĒä░ ņØĖĻ░äņØś ņ¦łļ│æ ņ╣śļŻīļź╝ ņ£äĒĢ£ ļ»╝Ļ░äņÜöļ▓Ģņ£╝ļĪ£ ņé¼ņÜ®ļÉśņ¢┤ ņÖöļŗż. ļŗżņ¢æĒĢ£ ļéśļ¼┤ņĀĢņ£ĀļōżņØ┤ cyclooxygenase-2 ļō▒ņØś ĒÖ£ņä▒ĒÖö ņ¢ĄņĀ£ļź╝ ĒåĄĒĢ┤ ĒĢŁņŚ╝ņ”Ø ĒÜ©Ļ│╝ļź╝ Ļ░Ćņ¦ĆļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳Ļ│Ā, LPSņŚÉ ņØśĒĢ£ prostaglandin E2ņØś ņāØņä▒ ļśÉĒĢ£ ĒÄĖļ░▒ņĀĢņ£ĀņŚÉ ņØśĒĢ┤ ņ¢ĄņĀ£ļÉśņŚłņ£╝ļ®░, ĻĖ░Ļ┤Ćņ¦Ć ņ▓£ņŗØ ņāØņźÉļ¬©ļŹĖņØś ĒśĖĒØĪĻĖ░ Ļ│╝ļ»╝ļ░śņØæņØä ņ¢ĄņĀ£ĒĢśļŖö ĒĢŁņŚ╝ņ”Ø ĒÜ©Ļ│╝ņŚÉ ļīĆĒĢ┤ņä£ļÅä ņĢīļĀżņĀĖ ņ׳ļŗż[15,16]. ĒĢśņ¦Ćļ¦ī ļéśļ¼┤ņĀĢņ£ĀņØś Ļ▓ĮņÜ░ ļéśļ¼┤ņØś ņóģļźś, ļéśļ¼┤Ļ░Ć ņ×ÉļØ╝ļŖö ņ¦ĆņŚŁ, ļéśļ¼┤ņĀĢņ£Ā ņ▒äņĘ© ņŗ£ĻĖ░ ļō▒ņŚÉ ļö░ļØ╝ ĻĘĖ ņä▒ļČäņØś ņ░©ņØ┤Ļ░Ć ņ׳ņØä ņłś ņ׳ņ¢┤ ļéśļ¼┤ņĀĢņ£ĀņØś ņä▒ļČäņØ┤ ņØ╝ņĀĢĒĢśņŚ¼ņĢ╝ ĒĢ£ļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ ņé¼ņÜ®ĒĢ£ ĒÄĖļ░▒ņĀĢņ£ĀņØś Ļ▓ĮņÜ░ ļéśļ¼┤ņØś ņ×öĻ░Ćņ¦ĆņÖĆ ņ×ÄņØä 1ļģäĻ░ä ņ▒äņĘ©ĒĢśņŚ¼ Ļ│äņĀłņŚÉ ļö░ļźĖ ņä▒ļČä ņ░©ņØ┤ļź╝ ĒĢ┤Ļ▓░ĒĢĀ ņłś ņ׳ņŚłņ£╝ļ®░, ņĀĢņ£Ā ņ▒äņĘ© Ēøä ņĢĮ 12Ļ░£ņøöĻ░äņØś ņĢłņĀĢĻĖ░ļź╝ Ļ▒░ņ▓ś ņČöņČ£ Ļ│╝ņĀĢņŚÉņä£ ļ░£ņāØĒĢśļŖö ļéśļ¼┤ņĀĢņ£Ā ĒŖ╣ņä▒ņØś ļ│ĆĒÖöļź╝ ņĄ£ņåīĒÖöĒĢśņśĆļŗż. ļśÉĒĢ£ ļéśļ¼┤ņĀĢņ£ĀļŖö Ļ░üņóģ ĒĢ┤ņČ®, Ļ│░ĒīĪņØ┤, ļ░ĢĒģīļ”¼ņĢä ļō▒ņ£╝ļĪ£ļČĆĒä░ ļéśļ¼┤ļź╝ ļ│┤ĒśĖĒĢśļŖö ņŚŁĒĢĀņØä ĒĢśĻĖ░ ļĢīļ¼ĖņŚÉ ņØĖņ▓┤ņŚÉ ņĀüņÜ®ĒĢśļŖö Ļ▓ĮņÜ░, Ļ▓ĮņÜ░ņŚÉ ļö░ļØ╝ ļÅģņä▒ņØ┤ ļéśĒāĆļéś ņØĖņ▓┤ņŚÉ ņĢģņśüĒ¢źņØä ļü╝ņ╣Ā ņłś ņ׳ļŗż. 1% ņØ┤ņāüņØś ĒÄĖļ░▒ņĀĢņ£ĀļĪ£ ļ¦Éņ┤łĒśłņĢĪ ļŗ©ĒĢĄĻĄ¼ļź╝ ņ▓śļ”¼ĒĢ£ Ļ▓ĮņÜ░ ņäĖĒżļČäĒÖöĻ░Ć ĻĖēĻ▓®Ē׳ Ļ░ÉņåīĒĢ©ņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłĻ│Ā, ļ╣äĻĄÉņĀü ņĢłņĀäĒĢ£ 0.2% ņØ┤ĒĢśņØś ļåŹļÅäņŚÉņä£ ĒĢŁņŚ╝ņ”Ø ĒÜ©Ļ│╝ļź╝ ĒÖĢņØĖĒĢśĻ│Āņ×É ĒĢśņśĆļŗż.
ĒÄĖļ░▒ņĀĢņ£ĀņØś Ļ▓ĮņÜ░ ņĢĮ 68Ļ░Ćņ¦ĆņØś ĻĄ¼ņä▒ņä▒ļČä(╬▒-terpinyl acetate 13.78%, sabinene 13.6%, bornyl acetate 10.9% ļō▒)ņ£╝ļĪ£ ņØ┤ļŻ©ņ¢┤ņ¦ä ļ│ĄĒĢ®ņ▓┤ļĪ£ Ēģīļź┤ĒÄ£(terepene)ņØ┤ļØ╝ļŖö Ē£śļ░£ņä▒ ņ£ĀĻĖ░ĒÖöĒĢ®ļ¼╝ņŚÉ ņØśĒĢ┤ ņĀĢņ£ĀņØś Ļ│Āņ£ĀĒĢ£ Ē¢źĻĖ░ļź╝ Ļ░Ćņ¦äļŗż[17]. ĒÄĖļ░▒ņĀĢņ£ĀļŖö ņ×ÉņŚ░ņé┤ņäĖĒżņØś ĒÖ£ļÅÖņØä ņ”Øņ¦äņŗ£ĒéżĻ│Ā, ņŖżĒŖĖļĀłņŖżņÖĆ ĻĖ┤ņןņØä ņÖäĒÖöņŗ£ņ╝£ņŻ╝ļŖö ļō▒ ņØĖņ▓┤ ļ®┤ņŚŁĻĖ░ņĀäņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣śļ®░, ĻĘĖļ×ī ņ¢æņä▒ĻĘĀĻ│╝ ĻĘĖļ×ī ņØīņä▒ĻĘĀņŚÉ ļīĆĒĢ£ ĒĢŁĻĘĀĒÜ©Ļ│╝ļ┐É ņĢäļŗłļØ╝ ĒĢŁņ¦äĻĘĀņĀ£ņØś ĒŖ╣ņä▒ņØä Ļ░Ćņ¦ĆĻ│Ā ņ׳ļŗż[8,9,16,18,19]. ĒĢśņ¦Ćļ¦ī ĒÄĖļ░▒ņĀĢņ£ĀņØś ņĢīļĀłļź┤ĻĖ░ ļ░Å Ļ░ÉņŚ╝ņä▒ ņŚ╝ņ”Øļ░śņØæņØä ņĪ░ņĀłĒĢśļŖö ļ¦Éņ┤łĒśłņĢĪ ļŗ©ĒĢĄĻĄ¼ ĒÖ£ņä▒ĒÖö ņ¢ĄņĀ£ĒÜ©Ļ│╝ņŚÉ ļīĆĒĢ£ ļ│┤Ļ│ĀļŖö ļ¦Äļŗż. ļ│Ė ņŚ░ĻĄ¼ļŖö ņäĖĻĘĀ ļÅģņåīņØĖ LPSņÖĆ ņäĖĒżņ”ØņŗØ ņ£ĀļÅäļ¼╝ņ¦łņØĖ PHAļĪ£ ļ¦Éņ┤łĒśłņĢĪ ļŗ©ĒĢĄĻĄ¼ņØś ĒÖ£ņä▒ĒÖöļź╝ ņ£ĀļÅäĒĢśņśĆņ£╝ļ®░ ĒÖöĒĢÖļ¦żĻ░£ļ¼╝ņ¦ł ņāØņä▒ ņ¢ĄņĀ£ ņŚ¼ļČĆļź╝ ĒÖĢņØĖĒĢ©ņ£╝ļĪ£ņŹ© ĒÄĖļ░▒ņĀĢņ£ĀņØś ĒĢŁņŚ╝ņ”Ø ĒÜ©Ļ│╝ļź╝ ĒÖĢņØĖĒĢśĻ│Āņ×É ĒĢśņśĆļŗż. LPSļŖö Ļ░ÉņŚ╝ņä▒ ņŚ╝ņ”Øļ░śņØæ ļ¼╝ņ¦łņØĖ TNF-╬▒ņÖĆ Th1 ņé¼ņØ┤ĒåĀņ╣┤ņØĖņØĖ INF-╬│ņØä ņ”ØĻ░Ćņŗ£ĒéżĻ│Ā, PHAļŖö ņŚ╝ņ”Øņä▒ ĒÖöĒĢÖļ¦żĻ░£ļ¼╝ņ¦ł ļ¬©ļæÉļź╝ ņ”ØĻ░Ćņŗ£Ēé¼ ņłś ņ׳ļŗż. LPSņŚÉ ņØśĒĢ£ TNF-╬▒ņØś ņāØņä▒ņØĆ ĒÄĖļ░▒ņĀĢņ£ĀņØś ļåŹļÅä ņ”ØĻ░ĆņŚÉ ļö░ļØ╝ ņ£ĀņØśĒĢśĻ▓ī ņāØņä▒ņØ┤ ņ¢ĄņĀ£ļÉśņŚłņ£╝ļ®░, INF-╬│ļŖö ĒÄĖļ░▒ņĀĢņ£Ā 0.1%(77.8~85.7%)ņÖĆ 0.2%(68.9~95.6%)ņŚÉņä£ Ļ░ĢļĀźĒĢśĻ▓ī ņ¢ĄņĀ£ļÉśņŚłļŗż. PHAņŚÉ ņØśĒĢ£ INF-╬│ņØś ņāØņä▒ņØĆ ĒÄĖļ░▒ņĀĢņ£ĀņØś ļåŹļÅä ņ”ØĻ░ĆņŚÉ ļö░ļØ╝ ņ£ĀņØśĒĢśĻ▓ī ņāØņä▒ņØ┤ ņ¢ĄņĀ£ļÉśņŚłņ£╝ļ®░, TNF-╬▒ņØś Ļ▓ĮņÜ░ ļ░░ņ¢æ 48ņŗ£Ļ░ä(25.7%)Ļ│╝ 72ņŗ£Ļ░ä(30.0%)ņŚÉ ĒÄĖļ░▒ņĀĢņ£Ā 0.2%ņŚÉņä£, IL-5ņØś Ļ▓ĮņÜ░ļŖö ļ░░ņ¢æ 72ņŗ£Ļ░ä(33.2%)ņŚÉ ĒÄĖļ░▒ņĀĢņ£Ā 0.2%ņŚÉņä£ ņāØņä▒ņØ┤ ņ¢ĄņĀ£ļÉśļŖö Ļ▓ĮĒ¢źņØä ļ│┤ņśĆņ£╝ļéś ĒåĄĻ│äĒĢÖņĀü ņØśļ»ĖļŖö ņŚåņŚłļŗż. ĒĢśņ¦Ćļ¦ī ļ¦Éņ┤łĒśłņĢĪ ļŗ©ĒĢĄĻĄ¼ ĒÖ£ņä▒ĒÖö ņ£ĀļÅä ļ¼╝ņ¦ł ņŚåņØ┤ ĒÄĖļ░▒ņĀĢņ£ĀļĪ£ ņ▓śļ”¼ĒĢ£ Ļ▓ĮņÜ░ TNF-╬▒, INF-╬│, IL-5ņØś ņāØņä▒ņØ┤ ļé«ņØĆ ļåŹļÅäņØĖ 0.05%ņØś ĒÄĖļ░▒ņĀĢņ£ĀņŚÉ ņØśĒĢ┤ ņ”ØĻ░ĆļÉśņŚłļŗż. ņØ┤ļŖö ĒÄĖļ░▒ņĀĢņ£ĀĻ░Ć ņŚ╝ņ”Øņä▒ ĒÖśĻ▓ĮņŚÉņä£ļŖö ĒĢŁņŚ╝ņ”Ø ĒÜ©Ļ│╝ļź╝ ļéśĒāĆļé┤ņ¦Ćļ¦ī ĒÄĖļ░▒ņĀĢņ£Ā ņ×Éņ▓┤ļÅä ļ®┤ņŚŁņäĖĒżņØś ĒÖ£ņä▒ĒÖöļź╝ ņ£ĀļÅäĒĢĀ ņłś ņ׳ņØīņØä ņØśļ»ĖĒĢĀ Ļ▓āņØ┤ļŗż. ņØ┤ļŖö ļ®£ļØ╝ļŻ©ņ╣┤ ņĀĢņ£ĀņØś ņ×ÉņŚ░ņé┤ņäĖĒż ĒÖ£ņä▒ĒÖöļź╝ ņ£ĀļÅäĒĢśļŖö ĒÜ©Ļ│╝ņÖĆ ņ£Āņé¼ĒĢ£ ĒśäņāüņØ╝ Ļ▓āņØ┤ļŗż[20]. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ĒÄĖļ░▒ņĀĢņ£ĀņØś ĒĢŁņŚ╝ņ”Ø ĒÜ©Ļ│╝ļŖö ļ¦Éņ┤łĒśłņĢĪ ļŗ©ĒĢĄĻĄ¼ņØś TNF-╬▒ņÖĆ INF-╬│ ņāØņä▒ņØä ņ¢ĄņĀ£ĒĢ©ņØä ĒÖĢņØĖĒĢśņśĆņ£╝ļéś IL-5ņŚÉļŖö ņśüĒ¢źņØä ļ»Ėņ╣śņ¦Ć ņĢŖņĢä ņ¦æļ©╝ņ¦Ć ņ¦äļō£ĻĖ░ņÖĆ Ļ░ÖņØĆ ņĢīļĀłļź┤ĻĖ░ ņ£Āļ░£ļ¼╝ņ¦łņŚÉ ļīĆĒĢ£ ĒĢŁņŚ╝ņ”Øļ░śņØæņØĆ ĒÖĢņØĖĒĢśņ¦Ć ļ¬╗ĒĢśņśĆļŗż. ļśÉĒĢ£ ĒÄĖļ░▒ņĀĢņ£ĀņØś ĒĢŁņŚ╝ņ”Ø ĻĖ░ņĀäņØä ĒÖĢņØĖĒĢśņ¦Ć ņĢŖņØĆ ņĀ£ĒĢ£ņĀÉņØä Ļ░Ćņ¦ĆĻ│Ā ņ׳ļŗż. ĻĖ░ņĪ┤ ņŚ░ĻĄ¼ņŚÉ ļö░ļź┤ļ®┤ ļéśļ¼┤ņĀĢņ£Ā ĒĢŁņŚ╝ņ”Ø ĒÜ©Ļ│╝ļŖö ĒĢŁņé░ĒÖö ņ×æņÜ® ļ░Å ĒÖ£ņä▒ņé░ņåīņØś ņāØņä▒ņ¢ĄņĀ£ņÖĆ cyclooxygenase Ļ▓ĮļĪ£ņØś ņ░©ļŗ© ļō▒ņØ┤ Ļ┤ĆņŚ¼ĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż[3,16,19]. ĒÄĖļ░▒ņĀĢņ£ĀļŖö 40ņŚ¼ ņóģņØś ĒÖöĒĢÖļ¼╝ņ¦łļĪ£ ĻĄ¼ņä▒ļÉśņ¢┤ ņ׳ļŖöļŹ░ ņØ┤ļōż ņä▒ļČä ņżæ ņ¢┤ļ¢ż ļ¼╝ņ¦łņØ┤ ĒĢŁņŚ╝ņ”Ø, ĒĢŁĻĘĀ, ĒĢŁņ¦äĻĘĀ ļō▒ņØś ĒŖ╣ņä▒ņØä ļéśĒāĆļé┤ļŖöņ¦ĆņŚÉ ļīĆĒĢ£ ņČöĻ░ĆņĀüņØĖ ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢĀ Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż.
ņØ┤ņāüņØś Ļ▓░Ļ│╝ļź╝ ņóģĒĢ®ĒĢ┤ ļ│┤ļ®┤ ĒÄĖļ░▒ņĀĢņ£ĀļŖö ļ¦Éņ┤łĒśłņĢĪ ļŗ©ĒĢĄĻĄ¼ņŚÉ ļīĆĒĢ£ ļ®┤ņŚŁ ĒÖ£ņä▒ĒÖöņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣Ā ļ┐É ņĢäļŗłļØ╝ ļ¦Éņ┤łĒśłņĢĪ ļŗ©ĒĢĄĻĄ¼ņŚÉņä£ ļ¦īļōżņ¢┤ņ¦ĆļŖö ņŚ╝ņ”Øņä▒ ĒÖöĒĢÖļ¦żĻ░£ļ¼╝ņ¦łņØś ņāØņä▒ņØä ņ¢ĄņĀ£ĒĢĀ ņłś ņ׳ņØīņØä ĒÖĢņØĖĒĢśņśĆļŗż. ĒÄĖļ░▒ņĀĢņ£ĀņØś ĒĢŁņŚ╝ņ”Ø ĒÜ©Ļ│╝ļŖö Ē¢źĒøä ņØĖņ▓┤ņØś ņŚ╝ņ”Øņä▒ ņ¦łĒÖś ņ╣śļŻīņĀ£ļĪ£ņØś Ļ░£ļ░£ Ļ░ĆļŖźņä▒ņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ļŖö Ļ▓░Ļ│╝ļĪ£ ļŗżņ¢æĒĢ£ ņŚ╝ņ”Øņ¦łĒÖś ļ¬©ļŹĖņØä ņØ┤ņÜ®ĒĢ£ ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢĀ Ļ▓āņØ┤ļŗż.