 |
 |
AbstractWe report a case of a 31-year-old female presented with recurrent sore throat and dyspnea even after tonsillectomy and repeated adenoidectomy. Hypertrophic lingual tonsil was removed via transoral robotic surgery and was confirmed as lymphoid follicular hyperplasia by pathological examination. The analysis of the distribution and the mean fluorescence intensity of T cells after stimulation with relevant cytokines showed impaired differentiation of naïve T cells into memory T cells. As such, defective T cell immunity had made the patient susceptible to repetitive upper respiratory infection.
서 론T 세포는 골수에서 유래하고 흉선에서 성숙되는 림프구로, 세포매개면역(cell-mediated immunity)의 중추를 담당한다[1]. T 세포는 수용체 및 기능에 따라 다양한 유형으로 구분할 수 있으며, 미성숙 T 세포(naı¨ve T cell), CD4+를 발현하며 다른 면역세포를 활성화시키는 보조 T 세포(helper T cell), 감염된 세포를 직접적으로 제거하는 CD8+ 세포독성 T 세포(cytotoxic T cell), 기억 T 세포(memory T cell), 자연살상 T 세포(natural killer T cell) 등으로 분류된다. 이 중 기억 T 세포에는 central memory T 세포(TCM)와 effector memory T 세포(TEM), effector memory re-expressing CD45RA (TEMRA) 등이 있다. 기억 T 세포는 면역학적 기억(immunological memory)에 중요한 역할을 하며, 특정 항원에 반복적으로 노출되었을 때 신속하고 효과적인 면역 반응을 일으키는 것으로 알려져 있다[1,2].
T 세포의 결핍은 1차성인 중증복합면역결핍장애(severe combined immunodeficiency), 디조지증후군(DiGeorge syndrome) 및 2차성으로 분류되는 후천성면역결핍증(acquired immune deficiency syndrome) 등에 의해 유발된다. 상기 질환에 이환 시 T 세포의 기능, 개수가 저하되거나 면역글로불린 생성이 저하되는 등 면역 체계가 무너져 바이러스나균의 감염에 취약해진다. 본 증례에서는 원인을 알 수 없는 반복되는 상기도 감염 증세를 보이는 31세 여자 환자에서 발견된 기억 T 세포의 감소된 분화에 따른 면역 결핍을 문헌 고찰과 함께 보고하고자 한다.
증 례31세 여자 환자가 어릴 때부터 반복되는 목통증과 호흡곤란을 주소로 정밀 검사를 원하여 본원 이비인후과에 내원하였다. 내원 당시 상기도 관련 증상뿐 아니라 발열, 두통 등의 전신 증상이 동반되었다. 환자는 5세 이후 총 6회의 아데노이드 절제술 및 편도 절제술을 받았으며, 마지막 수술 시에는 입천장인두기능부전(velopharyngeal insufficiency) 및 호흡곤란으로 2주 동안 입원 치료를 받은 병력이 있었다. 또한 공황장애로 약물 투약 중이었으며, 다양한 항생제 및 소염진통제에 발진 등의 알레르기 반응을 보이고, 심할 때는 기도부종이 동반될 때도 있다고 하였다. 환자는 후두개염으로 1년에 1-2회 정도 입원 치료를 받았으며, 본원 이비인후과 외래에 내원하기 1주 전에도 상기도 감염 증세를 보여 응급실에 내원한 병력이 있었다.
내시경 검진상 특이소견은 없었으며, 구개편도와 아데노이드는 수술로 모두 제거된 상태였으나 설편도 비대가 관찰되었다(Fig. 1A and B). 경부 컴퓨터 전산화단층촬영에서 후두개, 피열후두개주름 및 후두 전반의 부종 소견이 보였다. 내시경상 관찰된 설편도 비대는 컴퓨터 전산화단층촬영에서도 두드러졌으며, 정식 판독상 림프증식질환(lymphoproliferative disease)이 의심되었다(Fig. 2).
임상 증상 및 검사 소견을 종합하여 림프증식질환을 감별하기 위해 로봇을 이용한 설근부절제술(tongue base resection)을 시행하였다. 경구 접근법으로 설편도를 절제했으며, 최종 병리 조직 결과상 림프구 소포성 증식증(lymphoid follicular hyperplasia) 외 특이소견을 보이지 않았고, 수술 후 재발 소견도 없었다(Fig. 1C). 이처럼 수술 후에도 뚜렷한 원인을 찾을 수 없어, 원인 감별을 위해 알레르기 내과와 류마티스 내과에 진료를 의뢰하였다.
알레르기 내과에서는 약물 과민반응(drug hypersensitivity) 의심하에 스테로이드를 유지하며 비스테로이드성소염진통제와 2세대 세팔로스포린계 항생제 처방을 권유하였다. 류마티스 내과에서는 지속적인 감염의 원인에 대해 면역학적인 평가가 필요하며 가족력을 파악하는 것이 좋겠다는 의견을 주었다. 환자의 가족력을 조사한 결과 돌아가신 할머니와 어머니가 비슷한 상기도 감염 증상을 나타낸 적이 있는 것으로 확인되었다(Fig. 3). 이에 유전적 관련성 여부를 밝히기 위해 환자와 환자의 부모 및 대조군을 대상으로 면역세포의 구성을 분석하였다. 상기 대조군은 환자와 동거 중인 같은 나이의 여성으로, 혈연 관계가 아니면서 비슷한 환경에 노출되어 있으므로 대조군으로 선택하였다. 본 연구에 참여한 환자 및 환자의 부모, 대조군은 연구에 대해 충분한 정보를 제공받고 이해했으며 연구 참여에 동의하였다.
본 증례에서는 유세포분석(flow cytometry)을 이용하여 T 세포의 subtype 구성을 분석했다. T 세포의 subtype은 CD45RA와 CCR7 표면 분자의 발현 정도에 따라 CD45RA+CCR7+ 미성숙 T 세포, CD45RA-CCR7+ TCM, CD45RA-CCR7- TEM, CD45RA+CCR7- TEMRA T 세포로 구분하였다. CD4+ T 세포 및 CD8+ T 세포 분석 결과 환부 및 대조군에 비해 환자에서 미성숙 T 세포의 비율이 훨씬 높았고, 미성숙 T 세포에서 기억 T 세포로의 분화가 잘 이루어지지 않았다. 따라서 환자의 TCM, TEM, TEMRA 모두 대조군 및 환부와 비교하여 낮은 비율로 관찰되었다. 환자와 비슷한 증상을 보였던 환모의 기억 T 세포도 감소된 분화를 보였다(Table 1 and Fig. 4).
또한 본 증례에서는 환자와 환모, 대조군의 CD4+ T 세포 및 CD8+ T 세포를 각각 interferon gamma (IFN-γ), interleukin (IL)-4 및 IL-17로 자극하여 자극 전후의 mean fluorescence intensity (MFI)를 분석하였다. 먼저 CD4+ T 세포 및 CD8+ T 세포 모두 대조군에 비해 환자에서 현저히 낮은 발현을 보였다(Fig. 5). 자극 전의 MFI와 자극 후의 MFI를 비교했을 때, IFN-γ, IL-4 및 IL-17 자극에도 불구하고 환자의 T 세포가 상대적으로 적게 증가함을 알 수 있었다(Table 2). 또한 같은 자극이 주어졌을 때 환모의 T 세포 분화가 대조군만큼 증가하지 않는 등 환자에서와 비슷한 양상이 관찰되었다.
이처럼 미성숙 T 세포의 감소된 분화로 인해 결핍된 기억 T 세포는 면역 기능을 저하시켜 반복적인 감염을 야기하였다. 기존에 면역결핍증 환자의 치료법으로 조혈모세포이식을 시행하는 사례들이 보고된 바 있으며, 본 증례의 환자 또한 류마티스 내과와 상의하에 추후 줄기세포 치료를 고려 중이다[3].
고 찰면역학적 기억은 어떤 항원에 재노출 되었을 때 더욱 빠르고 강한 면역반응을 일으키는 기능이다[4]. 특정 외부 항원에 노출되면 그 항원에 대한 기억 세포를 만들게 되며, 기억 세포는 같은 항원이 다시 침입하였을 때 재활성화되어 빠른 시간 내 다량의 면역 세포를 만들게 된다.
미성숙 T 세포는 아직 항원과 접촉하지 않은 상태로, 항원에 의해 활성화되어 작용 T 세포(effector T cell)나 기억 T 세포로 분화한다. T 세포는 CD45RA와 CCR7이라는 표면 분자에 따라 CD45RA+CCR7+ 미성숙 T 세포, CD45RACCR7+ TCM, CD45RA-CCR7- TEM, CD45RA+CCR7- TEMRA T 세포로 분류할 수 있다. TCM은 CCR7과 CD62L을 발현함으로써 2차 림프기관으로 이동할 수 있고, 항원에 대한 면역반응으로 IL-2 같은 사이토카인을 생산하며 빠르게 분열한다. 반면 TEM과 TEMRA는 혈액 및 염증반응이 일어나는 조직으로 이동할 수 있으며, 세포독성이 높다[5]. 따라서 미성숙 T 세포가 적절하게 기억 T 세포로 분화해야 외부 자극에 대한 면역 반응을 활성화시킬 수 있다.
본 증례의 경우 목 통증, 호흡곤란을 동반하는 상기도 감염 증상이 오랜 기간 동안 반복되었고, 이에 타원에서 편도염 등을 의심해 편도 및 아데노이드 절제술을 수차례 받았으나 호전되지 않았다. 로봇을 이용한 설편도 절제술 후 절제 부위의 병리 조직학적 검사에서도 림프구의 증식 외 이상 소견은 밝혀지지 않았다.
반복되는 감염에 대한 원인을 찾기 위해 시행한 면역학적 분석 결과 대조군에 비해 환자의 미성숙 T 세포의 비율이 훨씬 높았고, 실질적으로 면역 기억에 중요한 역할을 담당하는 기억 T 세포인 TEM, TCM, TEMRA가 상대적으로 적었다. 이전 연구에서도 Group A Streptococcus (GAS) 재발성 편도염에서 GAS에 특징적인 여포 보조 T 세포의 발현이 저하되어 있음이 밝혀졌고, 만성 편도염에 비해 편도 농양처럼 심한 감염에서 보조 T 세포의 비율이 더 높음이 보고된 바 있다[6,7]. 본 증례의 환자에서는 미성숙 T 세포의 과도한 분화와 기억 T 세포의 결핍으로 인해, 항원 자극에 노출되어도 적절한 면역 반응이 일어나지 못하여 빈번한 감염에 노출된 것으로 볼 수 있다.
IFN-γ는 주로 T 세포에 의해 외부 항원에 대한 면역 반응으로 생성되는 사이토카인이다. IFN-γ는 제 1형 및 제 2형 주조직 적합성 복합체(major histocompatibility complex)의 발현을 증가시키고 항원 전달을 촉진하는 역할을 한다. IL-4는 미성숙 T 세포에서 T helper 2 세포(Th2)로의 분화를 유도하며, 활성화된 Th2는 양성 피드백으로 IL-4를 생산한다[8]. IL-17은 도움 T 세포에 의해 분비되며, 염증반응과 밀접한 관계가 있다[9].
상기 환자에서 T 세포를 각각 IFN-γ, IL-4 및 IL-17로 자극해 활성화를 유도했음에도 T 세포가 상대적으로 적게 증가함을 확인할 수 있었다. 기존 문헌에서 CD8+ T 세포와 관련된 조절인자의 발현 저하가 편도염의 원인일 가능성을 제시한 바 있으며, 편도 농양 및 편도염에서 대조군에 비해 전염증성(proinflammatory) 사이토카인이 분비되는 것으로 알려졌다[10,11]. 본 환자에서는 사이토카인의 자극에도 불구하고 T 세포가 충분히 분화되지 않아 적절한 면역 반응이 이루어지지 않았던 것으로 생각된다. 또한 환모의 면역세포 분석이 환자와 유사한 결과를 보였으며, 외조모 또한 비슷한 임상증상을 보였던 것은 모계 유전이 면역 결핍의 원인일 수 있음을 시사한다. 이미 기존 연구에서 선천성 면역결핍증이 관련 유전자의 결함으로 인해 발생하는 수많은 사례가 보고된 바 있다[12,13]. 추후 상기 환자에서도 면역결핍을 유발한 원인 유전자 등이 있는지 후속 연구가 필요할 것으로 보인다.
본 증례에서는 이비인후과와 관련된 상기도 감염 증상에 초점을 맞추었으나, 환자는 발열 및 설사 등 중증복합면역결핍증(severe combined immunodeficiency disease)을 비롯한 다른 T 세포 관련 면역결핍질환에 흔히 동반되는 전신 증상도 호소하였다. 그러나 폐렴이나 발육부전 및 패혈증 등 심한 증상은 보이지 않았으며 일상 생활에도 큰 지장은 없었다. 이는 본 증례의 환자에서 B 세포 면역이나 다른 선천성 면역과 관련된 일부 면역 기능이 유지되었기 때문으로 보인다. 또한 중증복합면역결핍증 같은 중증면역질환에서는 T 세포의 수와 기능이 정상의 약 1/10 이하로 현저히 감소되어 있으나 상환은 T 세포의 분화가 저하되어 있긴 하지만 어느정도는 존재하여 심한 감염에 저항할 수 있었던 것으로 추정된다[14].
이전에 재발성 편도염 환자에서 체액성 면역결핍(humoral immunodeficiency)의 유병률이 높다는 결과가 있었으나, 기억 T 세포에 대해서는 연구된 바가 없었다[15]. 본 증례는 조절되지 않는 잦은 상기도 감염에서 기억 T 세포의 분화에 대해 분석한 첫 증례로, 재발성 편도염 환자에서 단순한 감염뿐 아니라 면역결핍의 가능성을 반드시 고려해야 함을 시사한다.
NotesAuthor Contribution Conceptualization: Suyeon Pyo, Hyun Jik Kim. Data curation: Suyeon Pyo. Formal analysis: Suyeon Pyo. Methodology: Hyun Tae Ryu. Supervision: Hyun Jik Kim. Validation: Hyun Tae Ryu. Writing—original draft: Suyeon Pyo. Writing—review & editing: Hyun Jik Kim. Fig. 1. Endoscopic photos of the patient (A and B). A: Palatine tonsils and adenoid were removed from previous tonsillectomy and adenoidectomy. B: Prominent lingual tonsil hypertrophy was observed. C: After lingual tonsillectomy, the wound was healed without recurrence (C). 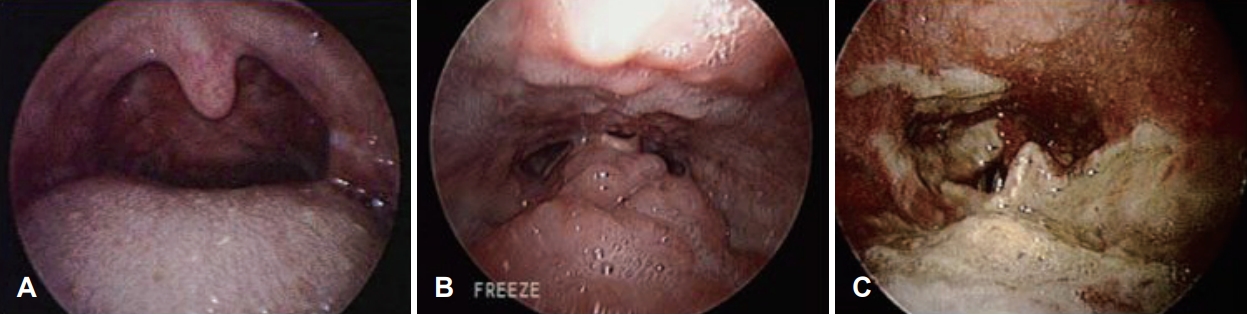
Fig. 2.Contrast-enhanced CT scans of neck. The CT findings show diffuse swelling of epiglottis, ariepiglottic fold and laryngeal wall. Prominent lingual tonsil hypertrophy suggests the possibility of lymphoproliferative disease involvement. 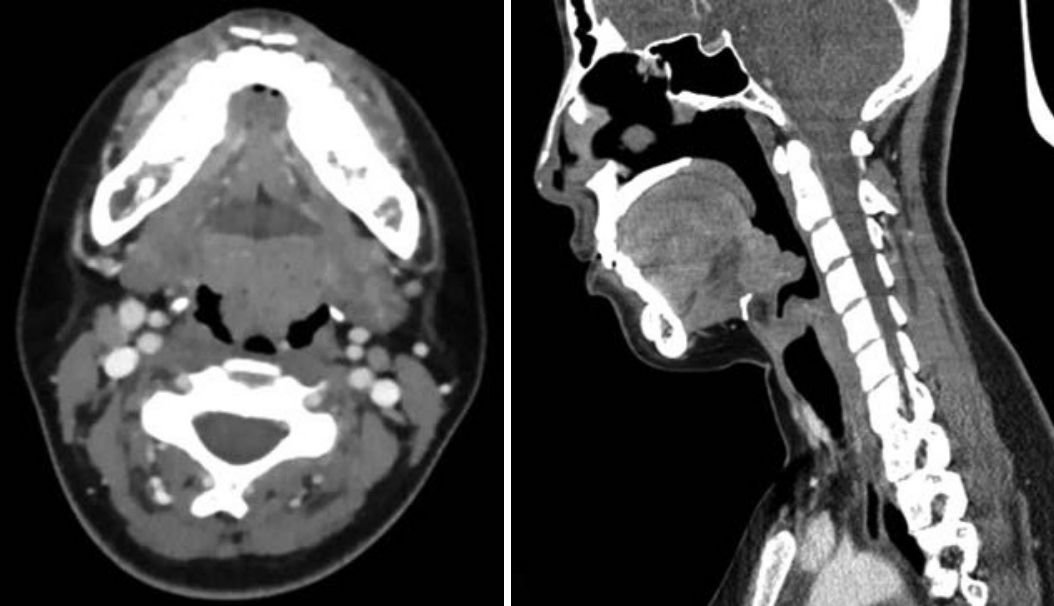
Fig. 3.Family tree of the patient. The patient’s grandmother and mother showed repeated upper respiratory symptoms, similar to those of the patient. 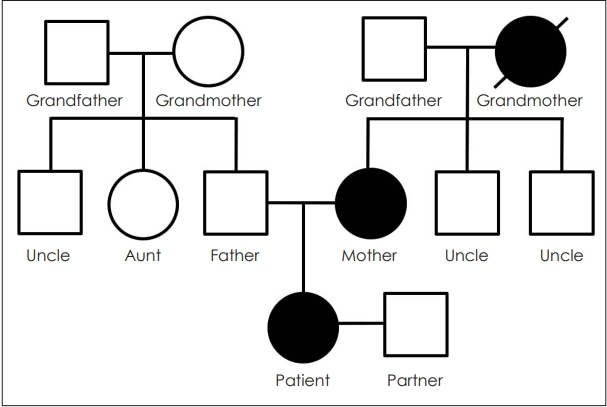
Fig. 4.T cell distribution of the patient. CD45RA+CCR7+ naïve T cell is highly expressed while differentiation into CD45RACCR7+ TCM, CD45RA-CCR7- TEM and CD45RA+CCR7- TEMRA is insufficient in both CD4+ and CD8+ T cells. 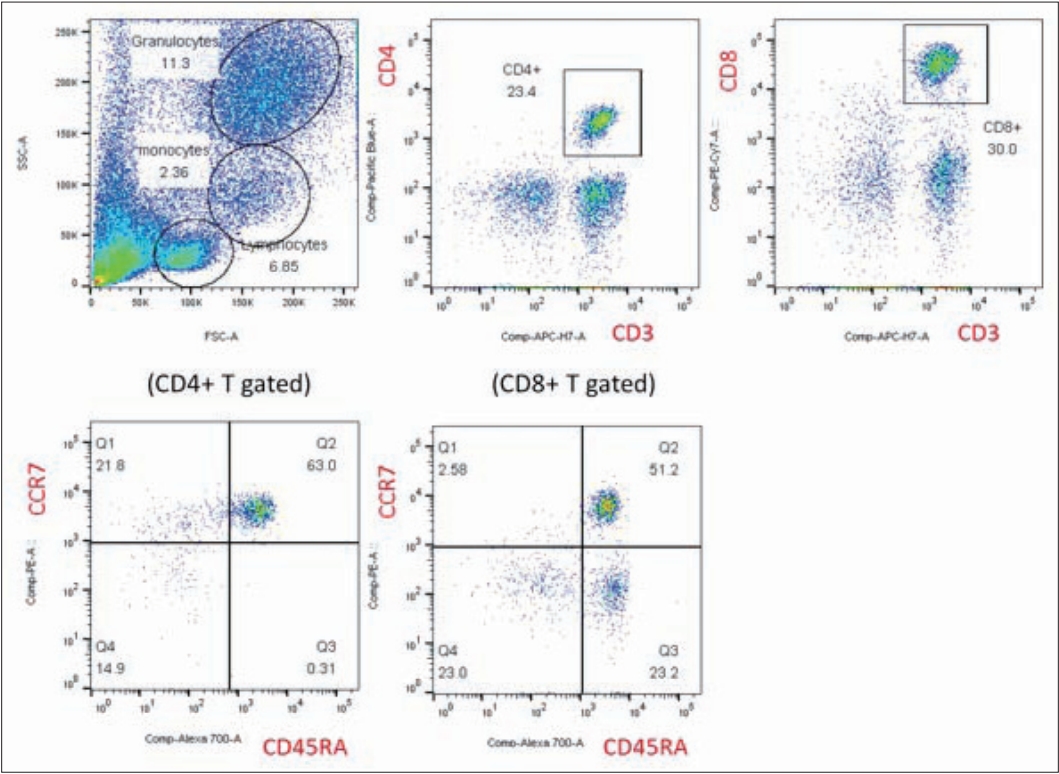
Fig. 5.MFI analysis of CD4+ T cell (A) and CD8+ T cell (B) before and after stimulation with IFN-γ, IL-4 and IL-17. Initial levels of both T cells are significantly lower in the patient compared to the control. Stimulation of all cytokines increases T cell production in all groups, but the amount of change in the patient is less than that of the control. IFN-γ, interferon gamma; IL, interleukin. 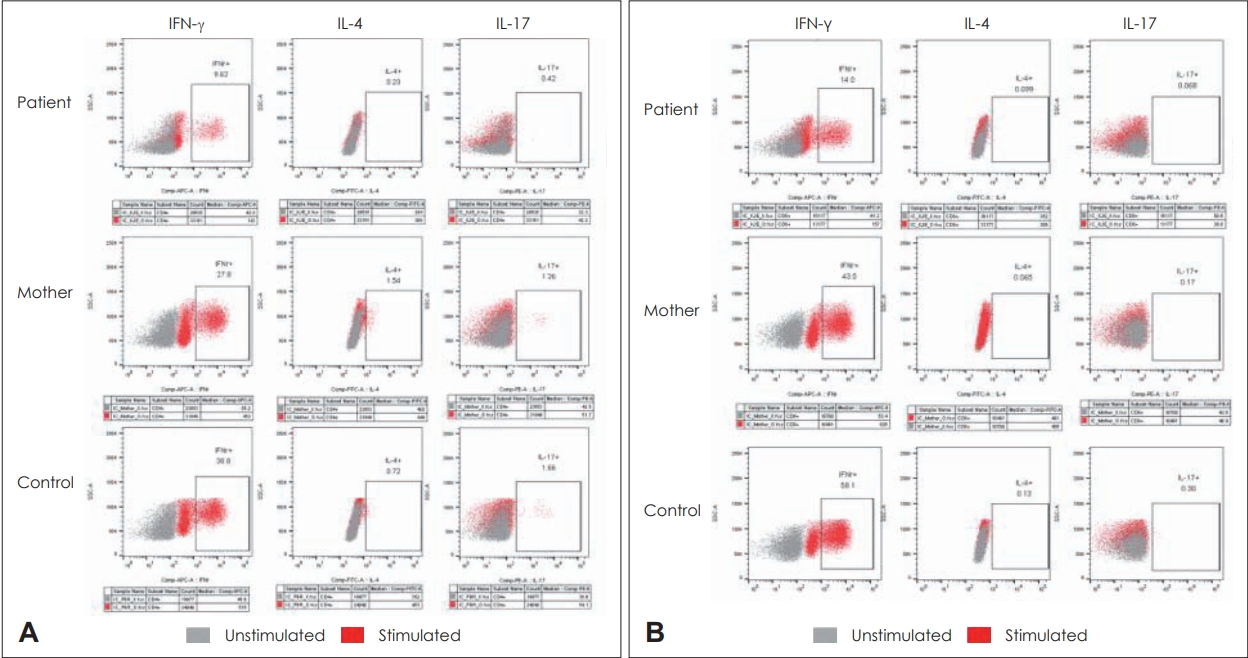
Table 1.T cell distribution of the participants Naïve T cell is more dominant while TCM and TEM are underexpressed in both CD4+ and CD8+ T cell in the patient. In contrast, adequate differentiation of memory T cells is observed in father and control. TCM, central memory T cell; TEM, effector memory T cell; TEMRA, effector memory re-expressing CD45RA Table 2.Summary of immunofluorescence analysis of T cells upon stimulation The initial levels of both CD4+ T cells and CD8+ T cells are lower in the patient compared to those of the control. Upon stimulation with IFN- γ , IL-4 and IL-17, both types of T cells show overexpression in all 3 subjects. However, the production of T cells in the patient is not elevated as much as in the control even after stimulation. IFN-γ, interferon gamma; IL, interleukin; MFI, mean fluorescence intensity REFERENCES3. Cowan MJ, Neven B, Cavazanna-Calvo M, Fischer A, Puck J. Hematopoietic stem cell transplantation for severe combined immunodeficiency diseases. Biol Blood Marrow Transplant 2008;14(1 Suppl 1):73-5.
4. Farber DL, Netea MG, Radbruch A, Rajewsky K, Zinkernagel RM. Immunological memory: Lessons from the past and a look to the future. Nat Rev Immunol 2016;16(2):124-8.
5. Roberts AD, Ely KH, Woodland DL. Differential contributions of central and effector memory T cells to recall responses. J Exp Med 2005;202(1):123-33.
6. Dan JM, Havenar-Daughton C, Kendric K, Al-Kolla R, Kaushik K, Rosales SL, et al. Recurrent group A Streptococcus tonsillitis is an immunosusceptibility disease involving antibody deficiency and aberrant TFH cells. Sci Transl Med 2019;11(478):eaau3776.
7. Geißler K, Markwart R, Requardt RP, Weigel C, Schubert K, Scherag A, et al. Functional characterization of T-cells from palatine tonsils in patients with chronic tonsillitis. PLoS One. 2017;12(9):e0183214.
10. Geißler K, Weigel C, Schubert K, Rubio I, Guntinas-Lichius O. Cytokine production in patients with recurrent acute tonsillitis: Analysis of tonsil samples and blood. Sci Rep 2020;10(1):13006.
11. Meng HX, Ohe R, Li HN, Yang SR, Kabasawa T, Kato T, et al. Immunoglobulin and CD8+ T-cell distribution in histologically distinctive tonsils of individuals with tonsillar focal infection. Acta Otolaryngol 2015;135(3):264-70.
12. Monafo WJ, Polmar SH, Neudorf S, Mather A, Filipovich AH. A hereditary immunodeficiency characterized by CD8+ T lymphocyte deficiency and impaired lymphocyte activation. Clin Exp Immunol 1992;90(3):390-3.
13. Tchilian EZ, Wallace DL, Wells RS, Flower DR, Morgan G, Beverley PC. A deletion in the gene encoding the CD45 antigen in a patient with SCID. J Immunol 2001;166(2):1308-13.
|
|
|||||||||||||||||||||||||||||||||||||||

 |
 |