ņä£ ļĪĀ
ļ░®ņé¼ņäĀ ņ╣śļŻīļŖö Ļ│ĀĒśĢņĢöņØś ņ╣śļŻīņŚÉ ņ׳ņ¢┤ Ļ░Ćņן ĒÜ©ņ£©ņĀüņØ┤Ļ│Ā ņżæņÜöĒĢ£ ņ╣śļŻīņØ┤ļŗż. ļ¬©ļōĀ ņĢöņØś 50% ņØ┤ņāüņØś ĒÖśņ×ÉļōżņØ┤ ļ░®ņé¼ņäĀ ņ╣śļŻīļź╝ ļ░øĻ▓ī ļÉśĻ│Ā[1], ļæÉĻ▓ĮļČĆ ņĢöņØś Ļ▓ĮņÜ░ ņĪ░ĻĖ░ņĢöņØś Ļ▓ĮņÜ░ ļŗ©ļÅģņ╣śļŻīļĪ£, ņ¦äĒ¢ēņĢöņØś Ļ▓ĮņÜ░ ĒĢŁņĢöņ╣śļŻīņÖĆ ļ│æĒĢ®ĒĢśņŚ¼ ĻĘ╝ņ╣śņĀü ņ╣śļŻīļĪ£ Ēś╣ņØĆ ņłśņłĀņØĆ ļ│┤ņĪ░ņ╣śļŻīļĪ£ ņŗ£Ē¢ēļÉ£ļŗż[2]. ļ░®ņé¼ņäĀ ņ╣śļŻīņŚÉ ļīĆĒĢ£ ņĀĆĒĢŁņä▒ņØĆ ļ░®ņé¼ņäĀ ņ╣śļŻī ņŗżĒī©ļź╝ ņ£Āļ░£ĒĢśņŚ¼ ņ×öņĪ┤ņĢöņØä ļ¦īļōżĻ▒░ļéś, ņ╣śļŻī ņóģļŻī Ēøä ņ×¼ļ░£ņØ┤ļéś ņøÉĻ▓®ņĀäņØ┤ļź╝ ņØ╝ņ£╝Ēé¼ņłś ņ׳ļŖö ņżæņÜöĒĢ£ ņÜöņåīņØ┤ļŗż[3]. ļö░ļØ╝ņä£ ļ░®ņé¼ņäĀ ņĀĆĒĢŁņä▒ņŚÉ ĻĖ░ņŚ¼ĒĢśļŖö ĻĖ░ņĀäņØä ņŚ░ĻĄ¼ĒĢśļŖö Ļ▓āņØĆ ņóģņ¢æ ņ×¼ļ░£ņØä ņżäņØ┤Ļ│Ā ļ░®ņé¼ņäĀ ņÜ®ļ¤ēņØä ņżäņŚ¼ ņéČņØś ņ¦ł Ē¢źņāüņØä ņ£ĀļÅäĒĢĀ ņłś ņ׳ļŗż. ļ│Ė ņóģņäżņŚÉņä£ļŖö ļæÉĻ▓ĮļČĆņĢöņŚÉņä£ ļ░®ņé¼ņäĀ ņĀĆĒĢŁņä▒ņŚÉ ņżæņÜöĒĢ£ ņŚŁĒĢĀņØä ĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņ¦ä ļŗżņ¢æĒĢ£ ņŗĀĒśĖņĀäļŗ¼ņ▓┤Ļ│ä ļ░Å ļ░öņØ┤ņśż ļ¦łņ╗żļź╝ ņĢīņĢäļ│┤Ļ│Ā, ņØ┤ņżæ ņżæņÜöĒĢ£ ņ╣śļŻī ĒāĆĻ╣āņØ┤ ļÉĀ ņłś ņ׳ļŖö PI3K/AKT ļ░Å EphA3ņØś ņŚŁĒĢĀņŚÉ ļīĆĒĢ┤ņä£ ņ×ÉņäĖĒ׳ ĻĖ░ņłĀĒĢśļĀżĻ│Ā ĒĢ£ļŗż.
DNA ņåÉņāü ļ░śņØæ ļ░Å ļ│ĄĻĄ¼
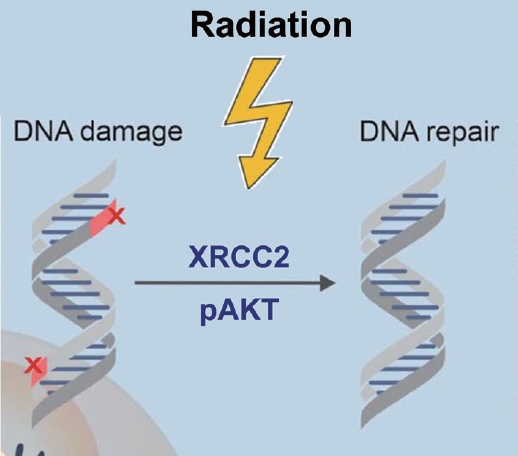
ļ░®ņé¼ņäĀ ņ╣śļŻīļŖö ņóģņ¢æ DNAņØś ņØ┤ņżæ ļéśņäĀņØä ĒīīĻ┤┤(Doublestrand break, DSB)ĒĢ©ņ£╝ļĪ£, ņäĖĒżņé¼ļ®ĖņØä ņ£ĀļÅäĒĢ£ļŗż. ĒĢśņ¦Ćļ¦ī ņĢöņäĖĒżļōżņØĆ DNA damage response (DDR)ļź╝ ĒåĄĒĢ┤ņä£ ņåÉņāüņØä ļ│ĄĻĄ¼ĒĢśĻ│Ā ņäĖĒżņāØņĪ┤ņØä ņ┤ēņ¦äĒĢ£ļŗż. DSBļŖö homologous recombination (HR) ļśÉļŖö nonhomologousņŚÉ ņØśĒĢ┤ņä£ ļ│ĄĻĄ¼ļÉśĻ│Ā, HRņØĆ ņĀĢĒÖĢĒĢ£ DSBņÖĆ ņ£ĀņĀäņĀü ņĢłņĀĢņä▒ ņ£Āņ¦ĆņŚÉ ĒĢäņłśņĀüņØ┤ļŗż[2,4,5]. DSBļź╝ ļ│ĄĻĄ¼ĒĢśļŖö ĻĖ░ņĀäņØĆ ļ░®ņé¼ņäĀ ņĀĆĒĢŁņä▒ņØś ņżæņÜöĒĢ£ ņÜöņåīĻ░Ć ļÉśļ®░, DSBņŚÉ Ļ┤ĆņŚ¼ĒĢśļŖö XRCC2 (pretreatment protein expression) ņØś ļ░£ĒśäņØ┤ DDRĻ│╝ Ļ┤ĆļĀ©ĒĢśņŚ¼ ļČłļ¤ēĒĢ£ ņśłĒøäņØĖņ×ÉņÖĆ Ļ┤ĆļĀ©ļÉśĻ│Ā(Fig. 1), ļ░®ņé¼ņäĀ ņĀĆĒĢŁņä▒ņØä ņśłņĖĪĒĢĀ ņłś ņ׳ļŗżĻ│Ā ņĢīļĀżņĀĖ ņ׳ņ£╝ļéś[6], ļæÉĻ▓ĮļČĆņĢöņŚÉņä£ ĻĘĖ ņŚŁĒĢĀņØĆ ņĢäņ¦ü ļ░ØĒśĆņ¦ä ļ░öĻ░Ć ņŚåļŗż. DDRņØĆ ļ¦żņÜ░ ļ│Ąņ×ĪĒĢ£ ņŗĀĒśĖņĀäļŗ¼ņ▓┤Ļ│äļōżņØ┤ Ļ┤ĆļĀ©ļÉśņ¢┤ ņ׳ņ¢┤, ņ×äņāüņĀüņ£╝ļĪ£ ņØ┤ņāüņĀüņØĖ ņśłņĖĪ ļ░öņØ┤ņśżļ¦łņ╗żņØś ņŚ░ĻĄ¼ļŖö ļ░®ņé¼ņäĀ ņ╣śļŻī ļ░śņØæņØä ņśłņĖĪĒĢśļŖö ļŹ░ ļÅäņøĆņØä ņżä ņłś ņ׳ņØä Ļ▓āņØ┤ļŗż.
ņäĖĒżņé¼ļ®Ė ļ░Å ņäĖĒż ĒżņŗØ
ņäĖĒżņé¼ļ®ĖņØ┤ļéś ņäĖĒżļČäņŚ┤ņØś ņĪ░ņĀłņŚÉ ņ׳ņ¢┤ ņżæņÜöĒĢ£ tyrosine kinases (TKs)ļŖö ļ░®ņé¼ņäĀ ņ╣śļŻīņÖĆ Ļ░ÖņØĆ ņŖżĒŖĖļĀłņŖż ņāüĒÖ®ņŚÉņä£ ņäĖĒżĻ░Ć ņØ┤ņŚÉ ļīĆņØæĒĢśņŚ¼ ņāØņĪ┤ĒĢśĻ▓ī ĒĢśļŖö ņŚŁĒĢĀņØä ĒĢ£ļŗż[7]. TKsļŖö receptor tyrosine kinases (RTKs) (e.g., EGFR, PDGFR, EPHA, HER-2)ņÖĆ non-receptor thyrosine kinase (NRTK: SRC, ABL, FAK, AKT)ļĪ£ ļČäļźśĒĢĀ ņłś ņ׳ļŗż. ņØ┤ļōżņØĆ ļ░®ņé¼ņäĀņŚÉ ņØśĒĢ£ DNA ļ│ĄĻĄ¼ ļ░Å ņäĖĒżņāØņĪ┤ņŚÉ ĒĢäņłśņĀüņØĖ ņŚŁĒĢĀņØä ĒĢśņŚ¼, ņäĖĒż ļé┤ ļ░£ĒśäņØ┤ ņ”ØĻ░ĆļÉśņ¢┤ ņ׳ļŖö Ļ▓ĮņÜ░ ļ░®ņé¼ņäĀ ņĀĆĒĢŁņä▒ ļ░Å ļČłļ¤ēĒĢ£ ņśłĒøä ĻĘĖļ”¼Ļ│Ā ņ×¼ļ░£ ņśłņĖĪ ļ░öņØ┤ņśżļ¦łņ╗żĻ░Ć ļÉĀņłś ņ׳ļŗż[2,3,5,7]. ļśÉĒĢ£ TK inhibitorļōżņØĆ ļŗżņ¢æĒĢ£ Ēæ£ņĀüņ╣śļŻīņĀ£ļĪ£ Ļ░£ļ░£ļÉśņ¢┤ ņé¼ņÜ®ļÉśņ¢┤ ņ׳ļŗż[7]. ĻĘĖ ņÖĖņŚÉ ņ×ÉĻ░ĆĒżņŗØ(autophagy)ņØĆ ļ░®ņé¼ņäĀĻ│╝ Ļ░ÖņØĆ ņäĖĒż ņŖżĒŖĖļĀłņŖż ņāüĒÖ®ņŚÉņä£ ņäĖĒż ņāØņĪ┤ņØś ļ®öņ╗żļŗłņ”śņØ┤ ļÉĀ ņłś ņ׳ņ¢┤, ņ×ÉĻ░ĆĒżņŗØņØ┤ Ļ│╝ļÅäĒĢśĻ▓ī ĒÖ£ņä▒ĒÖöļÉśļŖö Ļ▓ĮņÜ░ ļ░®ņé¼ņäĀņØś ĒÜ©ļŖźņØ┤ ļ¢©ņ¢┤ņĀĖņä£ ņĀĆĒĢŁņä▒ņØś ņøÉņØĖņØ┤ ļÉśĻĖ░ļÅä ĒĢ£ļŗż. ņØ┤ņĀä ņŚ░ĻĄ¼ņŚÉņä£ ļæÉĻ▓ĮļČĆņĢö ņäĖĒż ļ░Å ļÅÖļ¼╝ ļ¬©ļŹĖņŚÉņä£ ņ¦ĆņåŹņĀüņØĖ ņ×ÉĻ░ĆĒżņŗØņ”ØņāüņØś ĒÖ£ņä▒ĒÖöĻ░Ć ļ░®ņé¼ņäĀņŚÉ ņØśĒĢ┤ ņäĖĒż ņé¼ļ®ĖņØ┤ ņ£ĀļÅäļÉśļŖö Ļ▓āņØä ļ¦ēĻ│Ā, ļ░®ņé¼ņäĀ ņĀĆĒĢŁņä▒ņØ┤ ļ░£ņāØĒĢśĻ▓ī ļÉśļŖö ņżæņÜöĒĢ£ ņÜöņØĖņØ┤ ļÉ©ņØä ļ░ØĒ×ī ļ░ö ņ׳ļŗż[8].
ņĀĆņé░ņåīņ”Ø
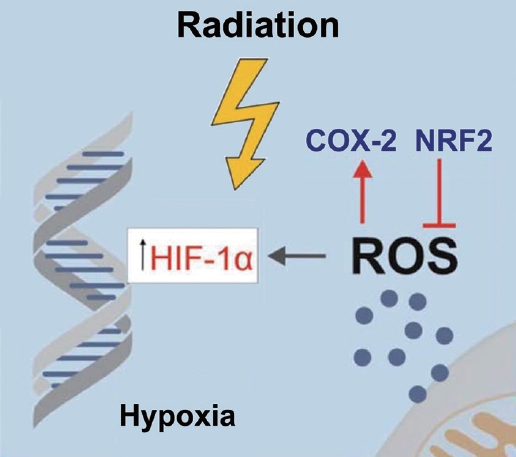
Hypoxic cancer cells (ņĀĆņé░ņåīņä▒ ņĢöņäĖĒż)ļŖö ņĢöņäĖĒżņØś Ļ│ĄĻ▓®ņä▒ ļ░Å ļ░®ņé¼ņäĀ ņ╣śļŻīņŚÉ ļīĆĒĢ£ ņĀĆĒĢŁņä▒ņØä ņ£ĀļÅäĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż. Hypoxia inducible factor (HIF)ļŖö ņĀĆņé░ņåī ņāüĒā£ņŚÉņä£ ļŗżņ¢æĒĢ£ ņäĖĒż ņāØņĪ┤ņŚÉ ĒĢäņÜöĒĢ£ ņŚ¼ļ¤¼ ņ£ĀņĀäņ×ÉļōżņØä ņĪ░ņĀłĒĢśļŖö ņżæņÜöĒĢ£ ļŗ©ļ░▒ņ¦łņØ┤ļ®░, ╬▒ subunit (HIF-1╬▒, HIF-2╬▒ and HIF-3╬▒), ĻĘĖļ”¼Ļ│Ā the ╬▓ s ubunit (HIF-1╬▓)ņ£╝ļĪ£ ļČäļźśļÉśļ®░, HIF-1╬▒ņÖĆ HIF-1╬▓ Ļ▓░ĒĢ®ņ▓┤Ļ░Ć ņĀĆņé░ņåī ņāüĒā£ņŚÉņä£ ņ”ØĻ░ĆĒĢśļŖö ņżæņÜöĒĢ£ ņĀäņé¼ņØĖņ×ÉņØ┤Ļ│Ā, ņĀĆņé░ņåī ņāüĒā£ļź╝ ļéśĒāĆļé┤ļŖö ļ░öņØ┤ņśżļ¦łņ╗żņØ┤ĻĖ░ļÅä ĒĢśļŗż. HIF-1╬▒ņØĆ ļ░®ņé¼ņäĀņŚÉ ņØśĒĢ£ ĒśłĻ┤Ć ņåÉņāüņØ┤ļéś reactive oxygen species (ROS)ņŚÉ ņØśĒĢ┤ ņ”ØĻ░ĆĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż[9,10]. ļŗżņ¢æĒĢ£ ņĢöņóģņŚÉņä£ HIF-1╬▒ņØś ņ”ØĻ░ĆļŖö ĒĢŁņĢöļ░®ņé¼ņäĀņŚÉ ļīĆĒĢ£ ņĀĆĒĢŁņä▒ ņśłņĖĪ ļ░Å ņśłĒøä ņØĖņ×ÉļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż(Fig. 2). ļśÉĒĢ£, HIF-1╬▒ļŖö fibroblast growth factor and vascular endothelial growth factors ļō▒ņØś ņŗĀņāØĒśłĻ┤ĆņØĖņ×ÉļōżņØä ņ×ÉĻĘ╣ĒĢśĻ│Ā ņØ┤ļź╝ ĒåĄĒĢ┤ ņŻ╝ļ│Ć ņĪ░ņ¦üņØś ņ╣©ļ▓öņØä ņ£ĀļÅäĒĢ£ļŗż[9,10]. HIF-1╬▒ņÖĆ ļŗ¼ļ”¼ HIF-1╬▓ļŖö ņäĖĒż ļé┤ ņŚÉņä£ ņØ╝ņĀĢĒĢśĻ▓ī ļ░£ĒśäļÉśĻ│Ā, ņäĖĒż ļé┤ņŚÉņä£ ņĪ┤ņ×¼ĒĢśĻ│Ā HIF-1╬▒ņØś Ļ▓░ĒĢ® ĒīīĒŖĖļäłņØ┤ļŗż. ņČöĻ░ĆņĀüņ£╝ļĪ£ HIF-2╬▒ļÅä ņĀĆņé░ņåī ņāüĒā£ņŚÉņä£ ĒāĆĻ╣āņØ┤ ļÉĀņłś ņ׳ļŖö mRNAņØś ņĀäņé¼ļź╝ ņ┤ēņ¦äĒĢśļŖö ņŚŁĒĢĀņØä ĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż[11-13]. ĒĢśņ¦Ćļ¦ī ņØ┤ļ¤¼ĒĢ£ ņĀĆņé░ņåīņä▒ ļ░śņØæņØ┤ ļæÉĻ▓ĮļČĆņĢöļ¬©ļŹĖņŚÉņä£ ļ░®ņé¼ņäĀ ņĀĆĒĢŁņä▒ņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņØ┤ ļČäļ¬ģĒĢśņ¦Ć ņĢŖĻ│Ā, ņØ┤ļź╝ ĒāĆĻ╣āņ£╝ļĪ£ ĒĢśļŖö ņĢĮļ¼╝ņØś ņ£ĀņÜ®ņä▒ņØĆ ņĢäņ¦ü ļ¬ģĒÖĢĒĢśņ¦Ć ņĢŖņ£╝ļ®░, ĒÖśņ×ÉņØś ņóģņ¢æņŚÉņä£ ņĀĆņé░ņåīņä▒Ļ│╝ ĻĘĖļĀćņ¦Ć ņĢŖņØĆ ņóģņ¢æņØä ĻĄ¼ļČäĒĢśļŖö ļ░®ļ▓ĢņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼ ļśÉĒĢ£ ĒĢäņÜöĒĢ£ ņāüĒÖ®ņØ┤ļŗż.
ņóģņ¢æļ»ĖņäĖĒÖśĻ▓Į
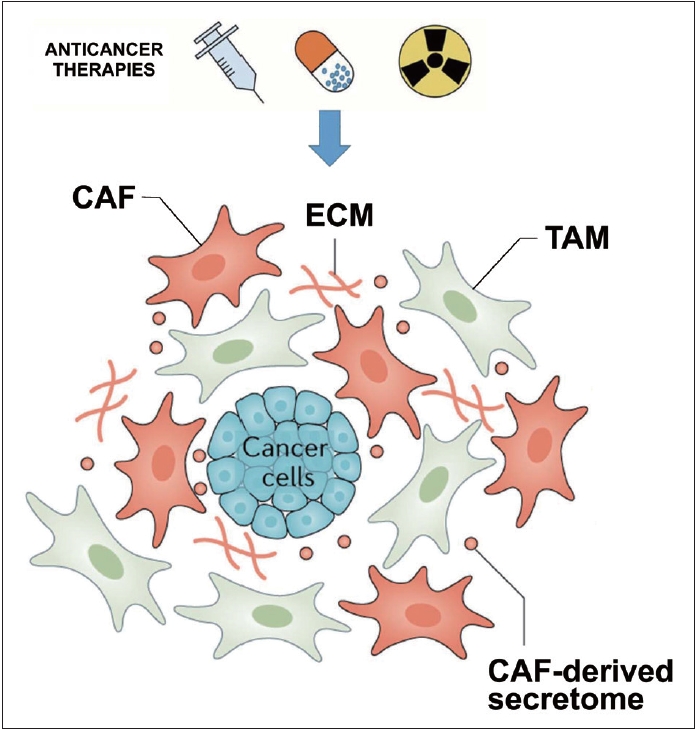
ļ░®ņé¼ņäĀ ņ╣śļŻīļŖö ņĢöņäĖĒżļ┐Éļ¦ī ņĢäļŗłļØ╝ ņŻ╝ļ│ĆņØś ņóģņ¢æļ»ĖņäĖĒÖśĻ▓Į(tumor microenvironment, TME)ņŚÉļÅä ņśüĒ¢źņØä ņżĆļŗż. ņóģņ¢æļ»ĖņäĖĒÖśĻ▓ĮņØĆ cancer-associated fibroblasts (CAFs), ļé┤Ēö╝ņäĖĒż, ļ®┤ņŚŁņäĖĒż, ĒśłĻ┤Ć, extracellular matrix (ECM, ņäĖĒżņÖĖļČĆņØś matrix ECM) ĻĄ¼ņĪ░ ļō▒ņ£╝ļĪ£ ĻĄ¼ņä▒ļÉśņ¢┤ ņ׳ļŗż(Fig. 3). ņĢöņäĖĒżņÖĆ TME ĻĄ¼ņä▒ņÜöņåīļōż Ļ░äņØś ļŗżņ¢æĒĢ£ ņāüĒśĖņ×æņÜ®ņØä ĒåĄĒĢ┤ ņóģņ¢æņØś ņä▒ņן, ĒśłĻ┤Ć ņ×¼ņāØ, ļ░®ņé¼ņäĀ ņĀĆĒĢŁņä▒ ĒÜŹļōØ ļō▒ņØä ņ┤ēņ¦äĒĢ£ļŗż[14-16]. CAFsļŖö ECM ļ”¼ļ¬©ļŹĖļ¦ü, ļīĆņé¼ ļ░Å ĒśłĻ┤ĆņāØņä▒ņĪ░ņĀł, ļŗżņ¢æĒĢ£ chemokineĻ│╝ cytokineņØś ņāØņä▒ņŚÉ ņØśĒĢ┤ ņĢöņäĖĒżņÖĆ ņŻ╝ļ│Ć ļ®┤ņŚŁņäĖĒżņÖĆņØś crosstalk Ļ░ÖņØĆ ļŗżņ¢æĒĢ£ ĻĖ░ļŖźņØä ĒĢśļŖö ņżæņÜöĒĢ£ TMEņØś ĻĄ¼ņä▒ņÜöņåīņØ┤ļŗż[15,16]. ļśÉĒĢ£, CAFļŖö DNA repair response ļ░Å anti-apoptotic signaling pathway, epithelial mesenchymal transition (EMT)ņØś ĒÖ£ņä▒ĒÖöļź╝ ĒåĄĒĢ┤ ĒĢŁņĢö ļ░®ņé¼ņäĀ, ļ®┤ņŚŁņ╣śļŻīņŚÉ ļīĆĒĢ£ ņĀĆĒĢŁņä▒ņØä ņ£Āļ░£ĒĢśļŖö ņżæņÜöĒĢ£ ņŚŁĒĢĀņØä ĒĢśĻ│Ā, ņØ┤ņÖĖņŚÉ ņĢöņäĖĒżņØś ņØ┤ļÅÖĻ│╝ ņ╣©ņŖĄņĀü ĒŖ╣ņä▒ņØä ņ┤ēņ¦äĒĢśņŚ¼ ņĀäņØ┤ļź╝ ņ”ØĻ░Ćņŗ£ĒéżļŖö ņŚŁĒĢĀņØä ĒĢ£ļŗż. ļ░®ņé¼ņäĀ ņ╣śļŻī Ēøä ņ”ØĻ░ĆļÉ£ CXCL-1, CXCL-12, FAP, TGF-╬▓ņÖĆ procollagen-lysine, 2-oxoglutarate 5-dioxygenase 3ņØś ļ░£ĒśäņØ┤ CAFņØś ņ”ØĻ░Ćļź╝ ļéśĒāĆļé┤ļŖö ļ░öņØ┤ņśżļ¦łņ╗żņØ┤Ļ│Ā ļŗżņ¢æĒĢ£ ņĢöņŚÉņä£ ļČłļ¤ēĒĢ£ ņśłĒøäņÖĆ Ļ┤ĆļĀ©ļÉśņ¢┤ ņ׳ļŗż[15,16]. CAFņØä ĒāĆĻ╣āņ£╝ļĪ£ ĒĢśļŖö ĒĢŁņĢöĻĖ░ņĀäņØĆ ņØ╝ņ░©ņĀüņ£╝ļĪ£ ĒŖ╣ņØ┤ņĀü Ēæ£ļ®┤ ļ¦łņ╗żļź╝ ĒāĆĻ╣āņ£╝ļĪ£ ĒĢśņŚ¼ CAFļź╝ ņĀ£Ļ▒░ĒĢśļŖö Ļ▓āņŚÉ ņżæņĀÉņØä ļæÉĻ│Ā ņ׳ļŗż. Fibroblast activation protein-╬▒ (FAP5)-DM1ņØĆ FAPņÖĆ CAFļź╝ ļÅÖņŗ£ņŚÉ ĒāĆĻ╣āņ£╝ļĪ£ ĒĢśļŖö monoclonal antibodyļĪ£ ļÅÖļ¼╝ņŗżĒŚśņŚÉņä£ ņ£ĀņØśĒĢśĻ▓ī ņóģņ¢æ ņ¢ĄņĀ£ Ēś╣ņØĆ ņÖäņĀä Ļ┤ĆĒĢ┤ļź╝ ņ£ĀļÅäĒĢśņśĆļŗż. ĻĘĖ ņÖĖņŚÉļÅä CAFņŚÉ ņØśĒĢ£ ĒĢśņ£ä ņŗĀĒśĖ ļ¼╝ņ¦łļōż ņśłļź╝ ļōżļ®┤ IL-6, IL-6R, JAK/STAT3 ļō▒ņØä ĒāĆĻ╣āņ£╝ļĪ£ ĒĢśļŖö ņĢĮļ¼╝ļōżņØ┤ FAPņÖĆ CAPņŚÉ ņØśĒĢ£ ļŗżņ¢æĒĢ£ cytokineļōżņØä ņ¢ĄņĀ£ĒĢśĻĖ░ ņ£äĒĢ┤ Ļ░£ļ░£ļÉśĻ│Ā ņ׳ļŗż. ļ│æĒĢ®ņ╣śļŻīļĪ£ņŹ©ņØś ļŗżņ¢æĒĢ£ ņŚŁĒĢĀņØ┤ ĻĖ░ļīĆļÉśĻ│Ā ņ׳ņ£╝ļéś, Ēśäņ×¼ ņŚ¼ļ¤¼ ņ×äņāüņŗ£ĒŚśņØ┤ ņ¦äĒ¢ē ņżæņØ┤ļŗż[15,16]. Tumor-associated macrophagesņØĆ ĒĢŁņĢöļ░®ņé¼ņäĀ ņ╣śļŻī Ēøä ņĀäņØ┤ļéś ņóģņ¢æņØś ņ×¼ņä▒ņןņŚÉ ņżæņÜöĒĢ£ ņŚŁĒĢĀņØä ĒĢśļŖö innate immunityņØś ņżæņÜöĒĢ£ ņÜöņåīņØ┤ļŗż[17]. MacrophageņØś ņóģļźśļŖö macrophage ļČäĻĘ╣ĒÖö(polarization)ņŚÉ ņØśĒĢ┤ ĻĘĖ ĒāĆņ×ģņØ┤ ļéśļłäņ¢┤ņ¦ĆĻ│Ā, M1 macrophageļŖö ĻĖ░ļ│ĖņĀüņ£╝ļĪ£ ĒĢŁņøÉņØä ņĀ£ņŗ£ĒĢĀ ņłś ņ׳ļŖö ļŖźļĀźņØä Ļ░Ćņ¦ĆĻ│Ā, ņŚ╝ņ”Øņä▒ ņé¼ņØ┤ĒåĀņ╣┤ņØĖņØś ĒÖ£ņä▒ĒÖöņØä ĒåĄĒĢ┤ ņĢöņØä ņ¢ĄņĀ£ĒĢśļŖö ļŖźļĀźņØä Ļ░Ćņ¦ĆļŖö ļ░śļ®┤, M2 macrophageļŖö ĒĢŁņŚ╝ņ”Ø ņä▒ņ¦łņØä Ļ░Ćņ¦Ćļ®░ ĒĢŁņøÉņØä ņĀ£ņŗ£ĒĢśļŖö ļŖźļĀźņØ┤ ļé«Ļ│Ā, ņĢöļ®┤ņŚŁņØä ņ¢ĄņĀ£ĒĢśļ®░, ņŗĀņāØĒśłĻ┤ĆĒśĢņä▒, ņĀĆņé░ņåīņ”Ø ņ£ĀļÅä, ļ®┤ņŚŁ ņ¢ĄņĀ£, ņäĖĒżņ”ØņŗØ ļ░Å ņĀäņØ┤ļź╝ ņ£ĀļÅäĒĢśļŖö ņĢīļĀżņĀĖ ņ׳ļŗż. ņØ┤ļ¤¼ĒĢ£ macrophageņØś ļČäĻĘ╣ĒÖöļŖö ņóģņ¢æļ»ĖņäĖĒÖśĻ▓ĮņŚÉ ņØśĒĢ┤ ņĪ░ņĀłļÉśļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż[18]. ļśÉĒĢ£, ĻĖ░ņĪ┤ņØś ņŚ░ĻĄ¼ļōżņŚÉņä£ M2 macrophageņØś ņČĢņĀüņØĆ ņóģņ¢æņØś ņŗĀņāØĒśłĻ┤Ć ĒśĢņä▒ ļ░Å macrophageņØś ņĀĢņāüņĀüņØĖ ĒżņŗØņ×æņÜ®ņØä ņ¢ĄņĀ£ĒĢśņŚ¼ ļ░®ņé¼ņäĀ ņ╣śļŻī ĒÜ©Ļ│╝ļź╝ ņĀ£ĒĢ£ĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż[14]. ļ│Ė ņŚ░ĻĄ¼ņ×ÉļōżņØĆ macrophageņŚÉ ņØśĒĢ£ ĒżņŗØņ×æņÜ®ņØä ņ¢ĄņĀ£ĒĢśļŖö CD47ņØś ļ░£ĒśäņØ┤ ļ░®ņé¼ņäĀ ņĀĆĒĢŁņä▒ ļ¬©ļŹĖņŚÉņä£ ņ”ØĻ░ĆļÉśņ¢┤ ņ׳ļŖö Ļ▓āņØä ļ░£Ļ▓¼ĒĢśņśĆĻ│Ā[19], ņØ┤ļŖö ņóģņ¢æ ļé┤ CD47ņØ┤ ļ░£Ēśäņ”ØĻ░ĆĻ░Ć ļ»ĖņäĖņóģņ¢æĒÖśĻ▓Į ļé┤ macrophageņØś ĻĖ░ļŖźņØä ņ¢ĄņĀ£ĒĢśļ»ĆļĪ£, ļ░®ņé¼ņäĀņŚÉ ļīĆĒĢ£ ņĀĆĒĢŁņä▒ņØ┤ ņāØĻĖĖ ņłś ņ׳ņØīņØä ņŗ£ņé¼ĒĢśļŖö Ļ▓░Ļ│╝ņØ┤ļŗż.
PI3K/AKT pathway
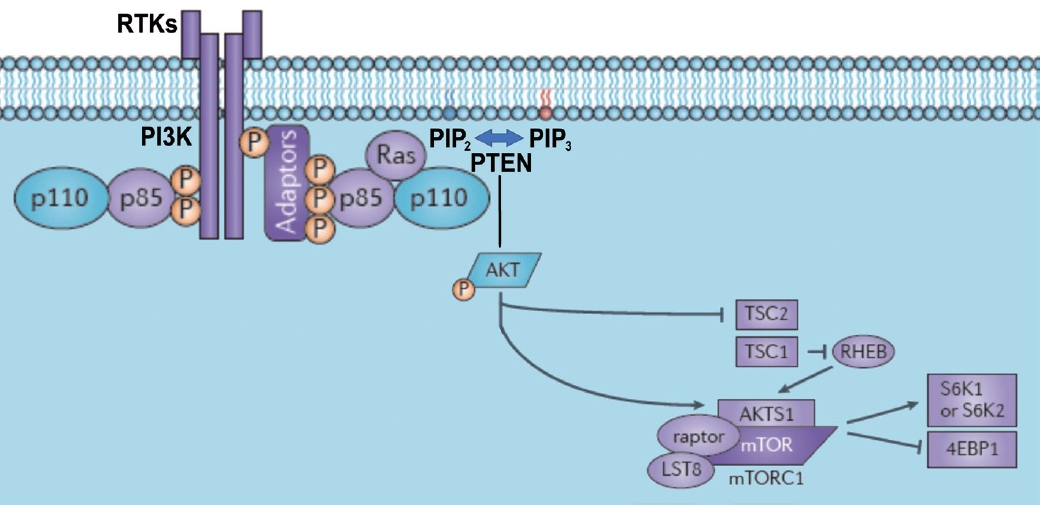
Phosphatidylinositol-3-kinase (PI3-K)/protein kinase B(AKT) ņŗĀĒśĖņĀäļŗ¼ņ▓┤Ļ│äļŖö ļ░®ņé¼ņäĀņĀĆĒĢŁņä▒ņØä ĒÜŹļōØĒĢ©ņŚÉ ņ׳ņ¢┤ ļé┤ņ×¼ņĀü ņĀĆĒĢŁņä▒, ņóģņ¢æ ņäĖĒż ņä▒ņן ĻĘĖļ”¼Ļ│Ā ņĀĆņé░ņåīņ”ØņØś 3Ļ░Ćņ¦Ć ļ®öņ╗żļŗłņ”śņŚÉ ņØśĒĢ┤ņä£ ņØ┤ļŻ©ņ¢┤ņ¦äļŗż. PI3K/AKT pathwayļŖö ļæÉĻ▓ĮļČĆņĢöņØä ĒżĒĢ©ĒĢ£ Ļ│ĀĒśĢņĢöņŚÉņä£ ĒÖ£ņä▒ĒÖöļÉśņ¢┤ ņäĖĒżņØś ņä▒ņןĻ│╝ ņ╣©ļ▓ö, ņäĖĒżņé¼ļ®Ė ņ¢ĄņĀ£ ĻĘĖļ”¼Ļ│Ā ņĀĆņé░ņåī Ļ┤ĆļĀ© ļŗ©ļ░▒ņ¦łņØś ĒÖ£ņä▒ĒÖö ņ£ĀļÅäņŚÉ Ļ┤ĆņŚ¼ĒĢ£ļŗż. ņØ╝ļ░śņĀüņ£╝ļĪ£ ņāüņ£äņŗĀĒśĖļĪ£ļŖö EGFRĻ│╝ Ļ░ÖņØĆ receptor t yrosine kinaseņŚÉ ņØśĒĢ┤ ĒÖ£ņä▒ĒÖöļÉśļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż(Fig. 4) [20-25]. PI3K/AKT ņŗĀĒśĖņ▓┤Ļ│äļŖö ļæÉĻ▓ĮļČĆņĢöņØś 90% ņØ┤ņāüņŚÉņä£ ĒÖ£ņä▒ĒÖöļÉśņ¢┤ ņ׳Ļ│Ā, ņØ┤ļŖö EGFR ĒÖ£ņä▒ĒÖö(47%), PIK3CA ļÅīņŚ░ļ│ĆņØ┤(8.6%), PIK3CA ņ”ØĒÅŁ(14.2%), PI3K Ļ│╝ļ░£Ēśä(27.2%) ļō▒ņŚÉ ņØśĒĢ┤ ņ£ĀļÅäļÉ£ļŗż[25]. ĻĘĖņÖĖņŚÉ phosphatase and tensin homolog (PTEN)ņØĆ ņØ┤ ņŗĀĒśĖņĀäļŗ¼ņ▓┤Ļ│äņØś Ļ░Ćņן Ļ░ĢļĀźĒĢ£ ņ¢ĄņĀ£ ņØĖņ×ÉļĪ£, ļæÉĻ▓ĮļČĆņĢöņØś 15%ņŚÉņä£ PTENņØś ļÅīņŚ░ļ│ĆņØ┤Ļ░Ć ņ׳Ļ│Ā, ļŗżņ¢æĒĢ£ ņĀäņé¼ņØĖņ×ÉļĪ£ ņØĖĒĢ┤ ļŗ©ļ░▒ņ¦ł ļ░£Ēśä ņĀĆĒĢśĻ░Ć ņ׳ļŖö Ļ▓ĮņÜ░ phosphatidylinositol (3,4,5)-trisphosphate (PIP3)ņØś ļ╣äĒÖ£ņä▒ĒÖöĻ░Ć Ļ░ÉņåīĒĢśņŚ¼, AKTņØś ĒÖ£ņä▒ĒÖöĻ░Ć ņ£ĀļÅäļÉśļ®┤ņä£ ĒĢŁņĢö ļ░®ņé¼ņäĀ ņ╣śļŻī ņĀĆĒĢŁņä▒ņØ┤ ļ░£ņāØĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż[21]. Class IA PI3KļŖö a catalytic subunit (p110)ņÖĆ a regulatory subunit (p85)ņ£╝ļĪ£ ĻĄ¼ņä▒ļÉ£ heterodimeric proteinņ£╝ļĪ£ p85 regulatory subunitņØĆ phosphatidylinositol(4,5)-bisphosphateņØä PIP3ļĪ£ ņĀäĒÖśĒĢśļŖö ņŚŁĒĢĀņØä ĒåĄĒĢ┤ AKTļź╝ ĒÖ£ņä▒ĒÖöĒĢśļŖö ĻĖ░ļŖźņØä ĒĢ£ļŗż[22,26]. ļæÉĻ▓ĮļČĆņĢöņŚÉņä£ AKT, PI3K ņ¢ĄņĀ£ņĀ£ļź╝ ņØ┤ņÜ®ĒĢ£ ņ×äņāüņŚ░ĻĄ¼ļŖö Ēśäņ×¼ phase I IĻ╣īņ¦Ć ņ¦äĒ¢ēļÉśņ¢┤ ņ׳ļŗż. ņŻ╝ļĪ£ļŖö ĻĖ░ņĪ┤ņØś ĒĢŁņĢöņĀ£ļéś cetuximabĻ│╝ņØś ļ│æĒĢ® ņÜöļ▓ĢņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼ļĪ£ ņ¦äĒ¢ēļÉśņ¢┤ ņÖöļŗż. PI3K inhibitorsļŖö 2Ļ░Ćņ¦Ć ņóģļźśĻ░Ć ņ׳Ļ│Ā, alpelisib (BYL-719), buparlisib (BKM-120), copanlisib (BAY 80-6946), LY294002, pilaralisib (XL147) and taselisib (GDC 0032) ļō▒ņØ┤ ņ׳ņ£╝ļ®░, ļīĆļČĆļČä pan-class l PI3K inhibitorsņØ┤ļ®░, BYL-719ņØĆ p110╬▒ņŚÉ ĒŖ╣ņØ┤ņĀüņØĖ inhibitorsņØ┤ļŗż[21,27,28]. PI3K inhibitorsļŖö ņØ┤ļĪĀņāüņ£╝ļĪ£ ļ│┤ļ®┤ ļ░®ņé¼ņäĀ ņĀĆĒĢŁņä▒ņØä ĻĘ╣ļ│ĄĒĢĀ ņłś ņ׳ļŖö ļ¦żļĀźņĀüņØĖ ņĢĮļ¼╝ņØ┤ņ¦Ćļ¦ī ņŗżņĀ£ļĪ£ Ļ│ĀĒśĢņĢöņŚÉņä£ PI3K inhibitors ļŗ©ļÅģ ņ╣śļŻīļŖö ņĢĮļ¼╝ņŚÉ ļīĆĒĢ£ ņĀĆĒĢŁņä▒ņØ┤ ļ░£ņāØĒĢśņŚ¼ ņŗżļ¦ØņŖżļ¤¼ņÜ┤ ņ╣śļŻī Ļ▓░Ļ│╝ļź╝ ļ│┤ņØ┤Ļ│Ā ņ׳ļŗż. ņØ┤ļ¤¼ĒĢ£ ņĀĆĒĢŁņä▒ ĻĖ░ņĀäņ£╝ļĪ£ PI3K pathwayņØś ļČłņÖäņĀäĒĢ£ ņ¢ĄņĀ£ļéś ņ×¼ĒÖ£ņä▒ĒÖö ļśÉļŖö ļ│┤ņÖäņĀüņØĖ pathwayņØś ĒÖ£ņä▒ĒÖö ļō▒ņØ┤ ņøÉņØĖņ£╝ļĪ£ ņāØĻ░üļÉśĻ│Ā ņ׳ļŗż. ļśÉĒĢ£ in vitroļéś in vivo ļÅÖļ¼╝ņŗżĒŚśņŚÉņä£ļŖö cisplatin, 5-FU, docetaxel ļō▒Ļ│╝ņØś ļ│æĒĢ®ņ╣śļŻīņŚÉņä£ ĒÜ©ļŖźņØ┤ ņ׳ņØīņØ┤ ņ”Øļ¬ģļÉśņŚłņ£╝ļéś, ĒÖśņ×ÉņŚÉņä£ņØś ņé¼ņÜ®ņŗ£ ņ×”ņØĆ ļČĆņ×æņÜ®ņØ┤ ņ׳ņ£╝ļ®░, ļæÉĻ▓ĮļČĆņĢöņŚÉņä£ļŖö ņĢäņ¦ü ĒÜ©Ļ│╝ņĀüņØĖ Ļ▓░Ļ│╝ļź╝ ĒÖĢņØĖĒĢśņ¦Ć ļ¬╗ĒĢśņśĆļŗż[21,27]. ņØ┤ņĀä ņŚ░ĻĄ¼ņŚÉņä£ ļ░®ņé¼ņäĀ ņĀĆĒĢŁņä▒ ļæÉĻ▓ĮļČĆņĢöņŚÉņä£ PI3K p85ņØś Ļ│╝ļ░£ĒśäņØ┤ ņżæņÜöĒĢ£ ņŚŁĒĢĀņØä ĒĢ©ņØä ĒÖĢņØĖĒĢśņśĆĻ│Ā, ĒØźļ»ĖļĪŁĻ▓īļÅä, PI3K p85 Ļ│╝ļ░£ĒśäņØ┤ ļ░£Ļ▓¼ļÉśņŚłņ£╝ļéś PI3K inhibitorņŚÉ ņĀĆĒĢŁņä▒ņØ┤ ņ׳ņØīņØä ļ░£Ļ▓¼ĒĢśņśĆļŗż. ņØ┤ļŖö PI3K pathwayņŚÉ ņłśļ¦ÄņØĆ crosstalk signalņØ┤ ņĪ┤ņ×¼ĒĢśĻĖ░ ļĢīļ¼ĖņŚÉ PI3K ņ×Éņ▓┤ļź╝ ņ¢ĄņĀ£ĒĢ┤ļÅä ļŗżļźĖ pathwayņØś ĒÖ£ņä▒ĒÖöļĪ£ ņĀĆĒĢŁņä▒ņØ┤ ļ░£ņāØĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉśņŚłĻ│Ā, ļæÉĻ▓ĮļČĆņĢöņŚÉņä£ļŖö SrcņØś ņ¦ĆņåŹņĀü ĒÖ£ņä▒ĒÖöļź╝ ĒåĄĒĢ£ PI3K/AKT pathwayņØś ĒÖ£ņä▒ĒÖöĻ░Ć ņ£Āņ¦ĆļÉ£ļŗżļŖö Ļ▓āņØä ļ░£Ļ▓¼ĒĢśņŚ¼, ņØ┤ļź╝ ĻĘ╝Ļ▒░ļĪ£ Src inhibitorļź╝ ļ│æĒĢ® ņ▓śļ”¼ĒĢśņśĆņØä ļĢī PI3K i nhibitorņŚÉ ļīĆĒĢ£ ņĀĆĒĢŁņä▒ņØ┤ ĻĘ╣ļ│ĄļÉ©ņØä ĒÖĢņØĖĒĢśņśĆļŗż. ņØ┤ļŖö p85ņØś ĒÖ£ņä▒ĒÖöĻ░Ć PI3K inhibitorņŚÉ ļīĆĒĢ£ ņĀĆĒĢŁņä▒ņØä ņśłņĖĪĒĢĀ ņłś ņ׳ļŖö ļ░öņØ┤ņśżļ¦łņ╗żĻ░Ć ļÉĀ ņłś ņ׳ņØīņØä ņŗ£ņé¼ĒĢśļŖö Ļ▓░Ļ│╝ņØ┤ĻĖ░ļÅä ĒĢśļŗż[29]. ļśÉĒĢ£ PTENņØ┤ ļÅīņŚ░ļ│ĆņØ┤ņŚÉ ņØśĒĢ┤ ĻĖ░ļŖźņØ┤ ņŚåņ¢┤ņ¦ĆĻ▒░ļéś Ēś╣ņØĆ Ēøäņä▒ĒĢÖņĀüņ£╝ļĪ£ ņ¢ĄņĀ£ļÉśļŖö Ļ▓ĮņÜ░ņŚÉļÅä PI3KņØś ĒÖ£ņä▒ĒÖöļź╝ ņ£ĀļÅäĒĢĀ ņłś ņ׳ļŗż. PTENņØś ņ£ĀņĀäņ×É ļÅīņŚ░ļ│ĆņØ┤ļź╝ ĒÅēĻ░ĆĒĢśļŖö Ļ▓āļ¦īņ£╝ļĪ£ ļ│Ąņ×ĪĒĢ£ ņĪ░ņĀłĻĖ░ņĀäņØä ņÖäņĀäĒ׳ ļ░ØĒśĆļé┤ĻĖ░Ļ░Ć ņ¢┤ļĀĄĻ│Ā, ņ£ĀņĀäņ×ÉņØś ļ│ĆĒÖö, ņĀäņé¼ņĪ░ņĀł, ļ╣äņĢöĒśĖĒÖö RNA ļō▒ ļŗżņ¢æĒĢ£ ņĪ░ņĀł ĻĖ░ņĀäņØ┤ ņĪ┤ņ×¼ĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż[30-32]. ņĀĆņ×ÉļŖö ņØ┤ņĀäņŚÉ ņØ┤ļ¤¼ĒĢ£ ļ│Ąņ×ĪĒĢ£ ņĪ░ņĀł ĻĖ░ņĀä ņżæ Ēøäņä▒ ņ£ĀņĀäĒĢÖņĀü ĻĖ░ņĀäņŚÉ ņ┤łņĀÉņØä ļæÉĻ│Ā ņŚ░ĻĄ¼ļź╝ ĒĢśņśĆĻ│Ā, PTENņØś CpG hypermethylationĻ│╝ H3K27meņŚÉņä£ņØś histone methylation ņØś Ļ░ĢļĀźĒĢ£ Ēøäņä▒ĒĢÖņĀü ņ¢ĄņĀ£ļź╝ ĒåĄĒĢ┤ņä£ ļ░®ņé¼ņäĀ ņĀĆĒĢŁņä▒ ļæÉĻ▓ĮļČĆņĢö ļ¬©ļŹĖņŚÉņä£ PTENņØś ņāüņŗżņØ┤ ļ░£ņāØĒĢ©ņØä ņ”Øļ¬ģĒĢśņśĆļŗż[33]. ņØ┤ļ¤¼ĒĢ£ ņé¼ņŗżļōżņØä ĒåĄĒĢ┤ņä£, PI3K/AKT signal ņĀäļŗ¼ ņ▓┤Ļ│äņØś ļ│Ąņ×Īņä▒ ļ░Å ļŗżņ¢æĒĢ£ crosstalk signalņØś ņĪ┤ņ×¼Ļ░Ć PI3K Ēś╣ņØĆ AKT inhibitorsņŚÉ ļīĆĒĢ£ ņĀĆĒĢŁņä▒ņØä ņ£Āļ░£ĒĢśĻ▓ī ļÉśĻ│Ā, ļŗ©ļÅģ ņ╣śļŻīļĪ£ņŹ©ņØś ņ£ĀņÜ®ņä▒ņØś ĒĢ£Ļ│äļź╝ Ļ░ĆņĀĖņśżĻ▓ī ĒĢ£ļŗżļŖö Ļ▓āņØä ņĢīņłś ņ׳ļŗż. ļö░ļØ╝ņä£, ļ░®ņé¼ņäĀ ņĀĆĒĢŁņä▒ņØ┤ ņ׳ļŖö ļæÉĻ▓ĮļČĆņĢöņŚÉņä£ ļŗ©ļÅģņ╣śļŻīļ│┤ļŗżļŖö ļ│æĒĢ®ņ╣śļŻīļĪ£ņŹ© ņŚŁĒĢĀņØä ĻĖ░ļīĆĒĢĀ ņłś ņ׳ļŗż.
EphA3
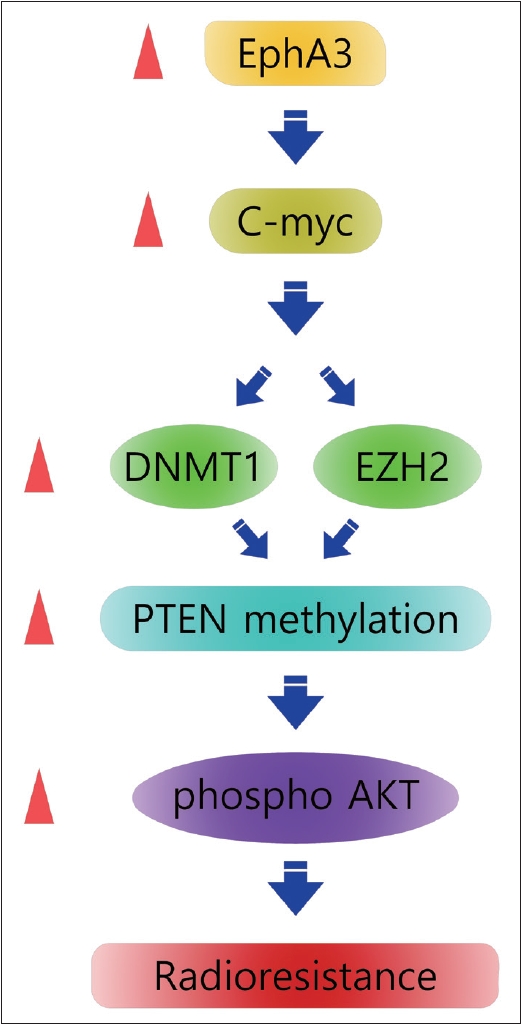
Eph receptorsļŖö RTKņŚÉ ņåŹĒĢśļ®░, ņäĖĒż Ļ░ä Ļ▓░ĒĢ®Ļ│╝ EMTļź╝ ņ£ĀļÅäĒĢśņŚ¼ ņóģņ¢æ ņ¦äĒ¢ē, ņŻ╝ļ│ĆņĪ░ņ¦ü ņ╣©ļ▓ö ļ░Å ņĀäņØ┤ņŚÉ ņżæņÜöĒĢ£ ņŚŁĒĢĀņØä ĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳Ļ│Ā, ļŗżņ¢æĒĢ£ ĒĢśņ£ä ņŗĀĒśĖņ▓┤Ļ│äļź╝ ņĪ░ņĀłĒĢĀ ņłś ņ׳ļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż[34-39]. Eph receptorļōżņØĆ 2Ļ░£ņØś ĒĢśņ£äļČäļźś(A and B)ņÖĆ 16Ļ░£(A1-A10, B1-B6)ņØś ļ®żļ▓äļĪ£ ļéśļłäņ¢┤ņ¦äļŗż. EphA3 (3p11.2)ļŖö 983Ļ░£ņØś ņĢäļ»ĖļģĖņé░ņØä Ļ░Ćņ¦ä ļ¦ēĒåĄĻ│╝ ļŗ©ļ░▒ņ¦ł(transmembrane protein)ļĪ£ ĻĄÉļ¬©ņäĖĒżņóģņØä ĒżĒĢ©ĒĢ£ ļŗżņ¢æĒĢ£ Ļ│ĀĒśĢņĢöņŚÉņä£ ļ░£ĒśäņØ┤ ņ”ØĻ░ĆĒĢśņŚ¼ Ļ│ĄĻ▓®ņĀüņØĖ ņä▒Ē¢źņØä ņ£ĀļÅäĒĢśĻ│Ā, ņ╣śļŻīņØś ņĀĆĒĢŁņä▒ņØä ņ£Āļ░£ĒĢ£ļŗżĻ│Ā ņĢīļĀżņĀĖ ņ׳ļŗż[40,41]. ļśÉĒĢ£ agonistic ╬▒-EphA3 antibodyļź╝ ņé¼ņÜ®ĒĢśņŚ¼ EphA3ņØś ĻĖ░ļŖźņØä ņ¢ĄņĀ£ĒĢ£ Ļ▓ĮņÜ░ ņóģņ¢æņØś ņŗżņ¦ł ļ░Å ļ»ĖņäĖĒśłĻ┤Ć ņāØņä▒ņØä ļ░®ĒĢ┤ĒĢśņŚ¼ ņóģņ¢æņä▒ņןņØä ĒÜ©Ļ│╝ņĀüņ£╝ļĪ£ ņ¢ĄņĀ£ĒĢĀ ņłś ņ׳ņØīņØ┤ ļ│┤Ļ│ĀļÉśņŚłļŗż[42]. ļæÉĻ▓ĮļČĆņĢöņŚÉņä£ EphA3ņØś ļ░£ĒśäĻ│╝ Ļ┤ĆļĀ©ļÉ£ ņŚ░ĻĄ¼ļéś ļ░®ņé¼ņäĀ ņĀĆĒĢŁņä▒ņŚÉ Ļ┤ĆĒĢ£ ņŚ░ĻĄ¼Ļ░Ć ņĀäļ¼┤ĒĢ£ ņāüĒÖ®ņŚÉņä£ ņĀĆņ×ÉļŖö EphA3ņØś ņŚŁĒĢĀņØä ņŚ░ĻĄ¼ĒĢśĻ│Ā ļ░ØĒśĆļé┤ņŚłļŗż[33,39]. ļ│Ė ņŚ░ĻĄ¼ĻĘĖļŻ╣ņØĆ ļæÉĻ▓ĮļČĆņĢö ļ¬©ņäĖĒżņŚÉ 2 GyņØś ļ░®ņé¼ņäĀņØä 70 GyĻ╣īņ¦Ć ļ¦żņØ╝ ņĪ░ņé¼ĒĢśĻ│Ā ņØ┤ Ļ│╝ņĀĢņŚÉņä£ ņé┤ņĢäļé©ņØĆ ņäĖĒżļōżņØ┤ ņØ┤ņĀäņØś ļ¬©ņäĖĒżņÖĆļŖö ļŗżļźĖ ļ░®ņé¼ņäĀņŚÉ ņĀĆĒĢŁņä▒ņØä Ļ░Ćņ¦ÉņØä ĒÖĢņØĖĒĢśņŚ¼, ņĢłņĀĢņĀüņØĖ ļ░®ņé¼ņäĀ ņĀĆĒĢŁņä▒ ņäĖĒżņŻ╝ļź╝ ĒÖĢļ”ĮĒĢśņśĆĻ│Ā ņØ┤ņŚÉ ĻĖ░ņĪ┤ ņäĖĒżņŚÉ R ņØä ļČÖņŚ¼ ļ¬ģļ¬ģĒĢśņśĆļŗż[43]. ĻĘĖļ”¼Ļ│Ā AMCHN-3 ņäĖĒżņŻ╝ņÖĆ AMC HN3R ņäĖĒżņŻ╝ Ļ░äņŚÉ ļŗ¼ļØ╝ņ¦ä DNA ļ░£ĒśäņØä ĒÖĢņØĖĒĢśĻ│Āņ×É microarrayļź╝ ņŗ£Ē¢ēĒĢśņśĆļŗż. ļæÉ ņäĖĒżņŻ╝ Ļ░äņŚÉ ļ░®ņé¼ņäĀ ņÜ®ļ¤ēņŚÉ ļö░ļØ╝ ĻĘĖ ļ░£ĒśäņØ┤ ņ”ØĻ░ĆĒĢśļŖö ļ¬ć Ļ░Ćņ¦Ć ļ¼╝ņ¦łņØä ļ░£Ļ▓¼ĒĢśņśĆĻ│Ā, ĻĘĖņżæ ļ░®ņé¼ņäĀ ņĀĆĒĢŁņä▒Ļ│╝ Ļ┤ĆļĀ©ĒĢśņŚ¼ EMTļź╝ ņ£ĀļÅäĒĢśļŖö ņżæņÜöĒĢ£ ļ¼╝ņ¦łņØ┤ EphA3ņ×äņØä ļ░£Ļ▓¼ĒĢśņśĆļŗż. EphA3ļŖö ļŗżņ¢æĒĢ£ ļ░®ņé¼ņäĀ ņĀĆĒĢŁņä▒ ņäĖĒżņŻ╝ņŚÉņä£ ļ░£ĒśäņØ┤ ņ”ØĻ░ĆļÉśņ¢┤ ņ׳ņŚłņ£╝ļ®░, EphA3 siRNAļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņ¢ĄņĀ£ņŗ£ ļ░®ņé¼ņäĀ Ļ░Éņłśņä▒ņØ┤ ņ”ØĻ░ĆĒĢśļŖö ņé¼ņŗżņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ļŗż. ļśÉĒĢ£ ņØ┤ļ¤¼ĒĢ£ ļ░®ņé¼ņäĀ ņĀĆĒĢŁņä▒ ņĪ░ņĀłņŚÉ Ļ░Ćņן ņżæņÜöĒĢ£ ņÜöņØĖņØ┤ EMTļź╝ ņĪ░ņĀłĒĢ©ņ£╝ļĪ£ ĻĖ░ņØĖļÉ£ļŗżļŖö Ļ▓āņØä ļ░ØĒśĆļé┤ņ¢┤, EphA3Ļ░Ć ļ░®ņé¼ņäĀ ņĀĆĒĢŁņä▒ņØ┤ ņ׳ļŖö ļæÉĻ▓ĮļČĆņĢöņŚÉņä£ ņżæņÜöĒĢ£ ņ╣śļŻī ĒāĆĻ╣āņØ┤ ļÉĀņłś ņ׳ņØīņØä ĒÖĢņØĖĒĢśņśĆļŗż[39]. ņØ┤ņÖĖņŚÉ, EphA3Ļ░Ć PI3KņØś ĒÖ£ņä▒ĒÖö ļ¼╝ņ¦łņØĖ p-AKTļź╝ ņ¦ĆņåŹņĀüņ£╝ļĪ£ ĒÖ£ņä▒ĒÖöņŗ£Ēé┤ņØä ļ░£Ļ▓¼ĒĢśĻ│Ā ĻĘĖ ĻĖ░ņĀäņŚÉ PTENņØś ņ¢ĄņĀ£ņŚÉ ņżæņÜöĒĢ£ ņŚŁĒĢĀņØä ĒĢ©ņØä ļ░£Ļ▓¼ĒĢśņśĆļŖöļŹ░, DNA methylationĻ│╝ histone methylationņØś ļæÉ Ļ░Ćņ¦Ć ĻĖ░ņĀäņØä ĒåĄĒĢ┤ PTENņØä Ēøäņä▒ņ£ĀņĀäĒĢÖņĀüņ£╝ļĪ£ Ļ░ĢĒĢśĻ▓ī ņ¢ĄņĀ£ĒĢśĻ│Ā ņ׳ņŚłļŗż[33]. PTENņØś Ļ░ĢļĀźĒĢ£ ņ¢ĄņĀ£ļŖö AKTļź╝ ņ¦ĆņåŹņĀüņ£╝ļĪ£ ĒÖ£ņä▒ĒÖöņŗ£ņ╝£ ļ░®ņé¼ņäĀ ņĀĆĒĢŁņä▒ņŚÉ ņżæņÜöĒĢ£ ĻĖ░ņĀäņØ┤ ļÉ©ņØä ņĢī ņłś ņ׳ņŚłļŗż(Fig. 5). ņØ┤ļ¤░ ļæÉ Ļ░Ćņ¦Ć ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ļŖö EphA3Ļ░Ć ļ░®ņé¼ņäĀ ņĀĆĒĢŁņä▒ņØ┤ ņ׳ļŖö ļæÉĻ▓ĮļČĆņĢö Ēś╣ņØĆ ļ░®ņé¼ņäĀ ņ╣śļŻīĒøä ņ×¼ļ░£ĒĢ£ ņĢöņŚÉņä£ ņżæņÜöĒĢ£ ņ╣śļŻī ĒāĆĻ╣āņØ┤ ļÉĀ ņłś ņ׳ņØīņØä ņŗ£ņé¼ĒĢśļŖö Ļ▓░Ļ│╝ņØ┤ļŗż. ļśÉĒĢ£ PI3K/AKTĻ░Ć ĒÖ£ņä▒ĒÖöļÉśņ¢┤ ņ׳ļŖö ņĢöņóģņŚÉņä£ EphA3Ļ░Ć ĒÖ£ņä▒ĒÖöļÉśņ¢┤ ņ׳ļŖö Ļ▓ĮņÜ░ ņ¦ĆņåŹņĀüņØĖ PTEN ņ¢ĄņĀ£ļĪ£ AKT ĒÖ£ņä▒ĒÖöĻ░Ć Ļ░ĢļĀźĒĢśĻ▓ī ņ£ĀļÅäļÉśļ»ĆļĪ£, PI3K Ēś╣ņØĆ AKT inhibitorsļōżņŚÉ ļīĆĒĢ£ ņĀĆĒĢŁņä▒ņØ┤ ņāØĻĖ░ļŖö ĻĖ░ņĀäņØ┤ ļÉĀ ņłśļÅä ņ׳ļŗż. ļö░ļØ╝ņä£, ļ░®ņé¼ņäĀ ņĀĆĒĢŁņä▒ ņĢöņóģņŚÉņä£ Ēæ£ņĀü ņ╣śļŻīņĀ£ļź╝ Ļ│ĀļĀżĒĢĀ ļĢī EphA3ņØś ĒÖ£ņä▒ĒÖöļź╝ ĒÖĢņØĖĒĢśņŚ¼, ļ░®ņé¼ņäĀ Ēś╣ņØĆ Ēæ£ņĀüņ╣śļŻīņĀ£ņŚÉ ļīĆĒĢ£ ņĀĆĒĢŁņä▒ņØä ņśłņĖĪĒĢśļŖö ļ░öņØ┤ņśżļ¦łņ╗żļĪ£ ņØ┤ņÜ®Ļ░ĆļŖźĒĢśļŗż. ņĄ£ĻĘ╝ Eph/ephrinņØä ĒāĆĻ╣āņ£╝ļĪ£ ĒĢśļŖö ņĢĮļ¼╝ļōżņØĆ ĒĢŁņ▓┤, ņ×¼ņĪ░ĒĢ® ļŗ©ļ░▒ņ¦ł ļō▒ņØ┤ ņ׳ņ£╝ļ®░, ļŗżņ¢æĒĢ£ ņĢöņóģ ļÅÖļ¼╝ ļ¬©ļŹĖņŚÉņä£ ĒÜ©Ļ│╝Ļ░Ć ņ×ģņ”ØļÉśĻ│Ā ņ׳ļŗż[44]. Ēśäņ×¼ tyrosine kinase EphA3 ņłśņÜ®ņ▓┤ļź╝ ĒāĆĻ╣āĒĢśļŖö monoclonal antibody ņØĖ KB004Ļ░Ć ļīĆĒæ£ņĀüņ£╝ļĪ£ ņé¼ņÜ®ļÉśĻ│Ā ņ׳ļŗż. ņØ┤ņĀä ņŚ░ĻĄ¼ņŚÉņä£ EphA3 mAb IIIA4Ļ░Ć acute lymphoblastic leukemia ņäĖĒżņŻ╝ņÖĆ ļÅÖļ¼╝ļ¬©ļŹĖņŚÉņä£ ņóģņ¢æ ņä▒ņןĻ│╝ ņ╣©ņŖĄņØä ņ¢ĄņĀ£ĒĢśņśĆĻ│Ā[45], ļŗżļ░£ņä▒ Ļ│©ņłśņä▒ ļÅÖļ¼╝ļ¬©ļŹĖņŚÉņä£ļÅä ņ£ĀņØśĒĢ£ ņóģņ¢æ ņ¢ĄņĀ£ļź╝ ļ│┤ņśĆļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŗż[46]. Ēśäņ×¼ EphA3 monoclonal antibodyļź╝ Ļ│ĀĒśĢņĢöņŚÉņä£ ņé¼ņÜ®ĒĢ£ ņ×äņāüņŚ░ĻĄ¼ļŖö ņŚåņ£╝ļéś, ĒśłņĢĪņĢöņŚÉņä£ KB004 monoclonal antibodyļź╝ ņØ┤ņÜ®ĒĢ£ Ļ▓ĮņÜ░ 1ņŻ╝ņØ╝ņŚÉ ĒĢ£ ļ▓łņö® 3ņŻ╝Ļ░ä ņŻ╝ņé¼ĒĢ£ Ļ▓ĮņÜ░ ĻĖēņä▒ļ░▒Ēśłļ│æ ĒÖśņ×ÉņØś ļīĆļČĆļČäņŚÉņä£ ļ░śņØæņØä ļ│┤ņØ┤ļŖö ĻĖŹņĀĢņĀüņØĖ Ļ▓░Ļ│╝ļź╝ ļ│┤Ļ│ĀĒĢśņśĆļŗż[47]. ļæÉĻ▓ĮļČĆņĢöņŚÉņä£ ļ░®ņé¼ņäĀ ņĀĆĒĢŁņä▒Ļ│╝ Ļ┤ĆļĀ©ļÉ£ ņżæņÜöĒĢ£ ņŚŁĒĢĀņØ┤ ņ”Øļ¬ģļÉ£ ļ░öļź╝ ļ░öĒāĢņ£╝ļĪ£ ļ░®ņé¼ņäĀ ņ╣śļŻīņÖĆ ļ│æĒĢ® ļśÉļŖö ņČöĻ░ĆņĀüņØĖ Ēæ£ņĀü ĒĢŁņĢöņĀ£ Ēś╣ņØĆ ļ®┤ņŚŁņ╣śļŻīņĀ£ņÖĆņØś ļ│æĒĢ®ņ╣śļŻīļź╝ ĒåĄĒĢ£ ņŚŁĒĢĀņØ┤ ĻĖ░ļīĆļÉśļŖö ļ░öņØ┤ļŗż.
ņóģņ¢æ ņżäĻĖ░ ņäĖĒż
Cancer stem cell (CSC)ņØĆ ļ░®ņé¼ņäĀņŚÉ ļīĆĒĢ£ ņäĖĒż ļÅģņä▒ņŚÉ ņĀüņØæĒĢ£ ņØ╝ļČĆ ņäĖĒżĻĄ░ņØ┤ ņ×ÉĻ░Ćņ×¼ņāØĻ│╝ ļČäĒÖö ļŖźļĀźņØä Ļ░Ćņ¦ĆĻ│Ā, ņĀäņØ┤ ļ░Å ņóģņ¢æņ×¼ņāØ ĻĘĖļ”¼Ļ│Ā ĒĢŁņĢöļ░®ņé¼ņäĀņŚÉ ļīĆĒĢ£ ņĀĆĒĢŁņä▒ņØä Ļ░¢Ļ▓ī ļÉśļŖö Ļ▓āņØä ņØ╝ņ╗½ļŖöļŗż. ļæÉĻ▓ĮļČĆņĢöņŚÉņä£ stem cell ļ¦łņ╗żļĪ£, CD44, ALDH, ĻĘĖļ”¼Ļ│Ā CD133ņØ┤ ļ░ØĒśĆņĀĖ ņ׳Ļ│Ā, ņŚ¼ļ¤¼ ņ×äņāü ņŚ░ĻĄ¼ņŚÉņä£ļÅä ļ░®ņé¼ņäĀ ņĀĆĒĢŁņä▒ņŚÉ ņżæņÜöĒĢ£ ņŚŁĒĢĀņØä ĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż[2,48]. ņ×äņāüņĀüņ£╝ļĪ£ CD44ņØś ļ░£Ēśäņ”ØĻ░ĆĻ░Ć ļ░®ņé¼ņäĀņ╣śļŻī Ēøä ņ×¼ļ░£ņØ┤ļéś ņ╣śļŻī ņŗżĒī©ļź╝ ņśłņĖĪĒĢĀ ņłś ņ׳ļŖö ņ£äĒŚś ņØĖņ×ÉĻ░Ć ļÉ©ņØ┤ ļ│┤Ļ│ĀļÉśņŚłļŗż[49]. CSCļŖö DDR, ĒÖ£ņä▒ ņé░ņåī(ROS), ĻĘĖļ”¼Ļ│Ā Wnt, Notch ļō▒ ņŚ¼ļ¤¼Ļ░Ćņ¦Ć ņŗ£ĻĘĖļäÉņØä ĒåĄĒĢ┤ņä£ ļ░®ņé¼ņäĀ ņĀĆĒĢŁņä▒ņØä ĒÜŹļōØĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż[26]. ļ░®ņé¼ņäĀ ņĀĆĒĢŁņä▒ņŚÉņä£ņØś CSCņØś ņŚŁĒĢĀņØĆ ņČöĻ░ĆņĀüņØĖ ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢ£ļŹ░, ļŗżņ¢æĒĢ£ ņäĖĒżĻĄ░ņØś Ēæ£ĒśäĒśĢĻ│╝ ĻĖ░ļŖźņĀü ĒŖ╣ņ¦ĢņØ┤ ļŗżņ¢æĒĢśĻĖ░ ļĢīļ¼ĖņŚÉ ĻĘĖ ņ░©ņØ┤ņŚÉ ļö░ļźĖ ļ░®ņé¼ņäĀ ņĀĆĒĢŁņä▒ņŚÉņä£ņØś ņŚŁĒĢĀ ĻĘ£ļ¬ģņØ┤ ĒĢ┤Ļ▓░ĒĢ┤ņĢ╝ ĒĢĀ ļ¼ĖņĀ£ņØ┤ļŗż.
Ļ▓░ ļĪĀ
ļ░®ņé¼ņäĀ ņĀĆĒĢŁņä▒ņØĆ ļæÉĻ▓ĮļČĆņĢö ĒÖśņ×ÉņØś ņśłĒøäņŚÉ Ļ░Ćņן Ēü░ ņśüĒ¢źņØä ņŻ╝ļŖö ņÜöņØĖņ£╝ļĪ£ ļ░®ņé¼ņäĀ ņĀĆĒĢŁņä▒ņØĆ ĒĢśļéśņØś ĒĢĄņŗ¼ ņĪ░ņĀł ļ¼╝ņ¦łņØ┤ļéś ņŗĀĒśĖņĀäļŗ¼ņ▓┤Ļ│äļ¦īņ£╝ļĪ£ ņäżļ¬ģĒĢśĻĖ░ ņ¢┤ļĀżņÜ┤ ļ│Ąņ×ĪĒĢśĻ│Ā, ļŗżņ¢æĒĢ£ ņ£ĀņĀäņ×ÉļōżņØś ļ│ĆņØ┤ņŚÉ ņØśĒĢ£ ĻĖ░ļŖźņØś ņāüņŗż Ēś╣ņØĆ ĒÜŹļōØņ£╝ļĪ£ ņØ┤ļŻ©ņ¢┤ņ¦äļŗż. Ļ░Ćņן ļīĆĒæ£ņĀüņØĖ ņŗĀĒśĖņĀäļŗ¼ņ▓┤Ļ│äĻ░Ć EGFR, EphA3, PI3K/AKT ņØ┤ņ¦Ćļ¦ī, ņĄ£ĻĘ╝ņŚÉļŖö ņØ┤ļ¤¼ĒĢ£ ņŗĀĒśĖņĀäļŗ¼ņ▓┤Ļ│äļ┐É ņĢäļŗłļØ╝ ļ░®ņé¼ņäĀņŚÉ ņØśĒĢ£ ņóģņ¢æ ļ»ĖņäĖĒÖśĻ▓ĮņØś ļ│ĆĒÖö ņ”ē CAFņØś ņ”ØĻ░Ć ļō▒ņØ┤ ņżæņÜöĒĢ£ ņÜöņØĖņ£╝ļĪ£ Ļ▒░ļĪĀļÉśĻ│Ā ņ׳ļŗż. ņ”ē ļæÉĻ▓ĮļČĆņĢöņŚÉņä£ ļ░®ņé¼ņäĀ ņĀĆĒĢŁņä▒ņŚÉ ĻĖ░ņØĖĒĢśļŖö ļ®öņ╗żļŗłņ”śņØĆ ļäłļ¼┤ļéś ļ¦ÄĻ│Ā, ņĄ£ĻĘ╝ņŚÉ ļ¦ÄņØĆ ļ░®ņé¼ņäĀ Ļ░ÉņłśņĀ£ļōżņØ┤ ņŚ░ĻĄ¼Ļ░Ć ļÉśĻ│Ā ņ׳ņ¦Ćļ¦ī, ņĢäņ¦üĻ╣īņ¦ĆļÅä ļ¦ÄņØĆ ņ╣śļŻīņĀ£ļōżņØ┤ ņ×äņāü ļŗ©Ļ│äņŚÉņä£ļŖö Ēü░ ĒÜ©Ļ│╝ļź╝ ļ│┤ņ¦Ć ļ¬╗ĒĢśĻ│Ā ņ׳ļŖö ņŗżņĀĢņØ┤ļŗż. ņĄ£ĻĘ╝ņŚÉļŖö ņĢö ņäĖĒżņØś ļ®┤ņŚŁĒÖśĻ▓ĮļōżņØś ļ│ĆĒÖöļÅä ļ░®ņé¼ņäĀ ņĀĆĒĢŁņä▒Ļ│╝ Ļ┤ĆļĀ©ļÉśņ¢┤ ņŚ░ĻĄ¼ļōżņØ┤ ņØ┤ļŻ©ņ¢┤ņ¦ĆĻ│Ā ņ׳ņ£╝ļ®░, ņĢäņ¦ü ĒÜŹĻĖ░ņĀüņØĖ ļ░®ņé¼ņäĀ ņĀĆĒĢŁņä▒ ĻĘ╣ļ│Ą ļ░®ņĢłņØ┤ ņŚåļŖö ņāüĒÖ®ņŚÉņä£, ļ░®ņé¼ņäĀ ņĀĆĒĢŁņä▒ņŚÉ ļīĆĒĢ£ Ļ╣ŖņØ┤ ņ׳ļŖö ņŚ░ĻĄ¼ļōżņØ┤ ņØ┤ļŻ©ņ¢┤ņĀĖņĢ╝ ĒĢĀ Ļ▓āņØ┤ļŗż.