 |
 |
AbstractNuclear protein in testis midline carcinoma (NMC) is an extremely aggressive subtype of squamous cell carcinoma characterized by chromosomal rearrangements of the nuclear protein in testis (NUT) gene. NMC predominantly arises in the anatomical midline locations of the body, with a high occurrence in the thoracic, head and neck regions. However, NMC remains a rarely reported disease, making its inclusion in the initial differential diagnosis challenging. This case involves a 4-year-old boy who presented with a neck mass initially diagnosed as a poorly differentiated carcinoma originating from the larynx with the cervical Lymph node metastasis. However, further tests confirmed the diagnosis of NUT midline carcinoma. This case highlights the importance of conducting NUT immunohistochemistry in cases of squamous cell carcinoma and undifferentiated carcinoma occurring in the head and neck, as it can provide meaningful insights for diagnosis and treatment decisions.
ΉΕε ΈκιNuclear protein in testis midline carcinoma (NMC)ΈΛΦ ΊΟ╕ΊΠΚΉΕ╕ΊΠυΉΧΦΉζα ΈπνΉγ░ Ά│╡Ά▓σΉιΒΉζ╕ ΊΧε ΉΧΕΉλΖΉε╝Έκε, nuclear protein in testis (NUT) ΉειΉιΕΉηΡΉζα ΉΩ╝ΉΔΚΉ▓┤ ΉηυΈ░░ΉΩ┤ΉζΕ ΊΛ╣ΉπΧΉε╝Έκε ΊΧεΈΜν[1]. ΈΝΑΈ╢ΑΈ╢ΕΉζα Ά▓╜Ήγ░ΉΩΡΉΕε bromodomain-containing protein 4 (BRD4)-NUT fusion oncogene ΊαΧΊΔεΉζα ΉηυΈ░░ΉΩ┤ΉζΕ Έ│┤Ήζ┤Έσ░, BRD3, nuclear receptor binding SET domain protein 3 (NSD3) ΈΥ▒Ήζα ΉειΉιΕΉηΡ Έ│ΑΉζ┤ΈΠΕ Ά░ΑΈΛξΊΧε Ά▓ΔΉε╝Έκε ΉΧΝΈινΉι╕ ΉηΙΈΜν[2]. Ήζ╝Έ░αΉιΒΉζ╕ ΊΟ╕ΊΠΚΉΕ╕ΊΠυΉΧΦΉλΖΉζα Έ│╡ΉηκΊΧε ΊΧ╡ΊαΧΆ│╝ΈΛΦ ΈΝΑΉκ░ΉιΒΉε╝Έκε NMCΈΛΦ t(15;19) ΉηυΈ░░ΉΩ┤Ήε╝Έκε ΈΝΑΊΣεΈΡαΈΛΦ Ά░ΕΈΜρΊΧε ΊΧ╡ΊαΧΉζΕ Έ│┤Ήζ╕ΈΜν. MidlineΉζ┤Έζ╝ΈΛΦ ΉγσΉΨ┤ΈΛΦ NMCΆ░Α Ήμ╝Έκε Ές╕ ΉνΣΉΧβΉζα ΊΧ┤Έ╢ΑΊΧβΉιΒ Έ╢ΑΉεΕΉΩΡΉΕε Έ░εΉΔζΊΧαΆ╕░ ΈΧΝΈυ╕ΉΩΡ ΉΓυΉγσΈΡαΉΩΙΉε╝Έσ░, ΊζΚΈ╢Α(51%), ΈΣΡΆ▓╜Έ╢Α(41%), Ά│ρΈ╢Α Έ░Π ΉΩ░Ήκ░ΉπΒ(6%)ΉΩΡΉΕε Έ░εΉΔζΊΧεΈΜν[1-3]. ΉπΕΈΜρΉζΑ Ά░ΕΈΜρΊΧαΆ▓ΝΈΛΦ NUT proteinΉΩΡ ΈΝΑΊΧε ΊΧ╡ Έσ┤ΉΩφΈ░αΉζΣΉζΕ Ά┤ΑΉ░░ΊΧαΈΛΦ Ά▓ΔΉζ┤Έσ░, ΉλΖΉΨΣ ΉειΉιΕΉηΡΈξ╝ ΊΛ╣ΉιΧΊΧαΆ╕░ ΉεΕΊΧε Ή╢ΦΆ░ΑΉιΒΉζ╕ ΉΩ░Ά╡υΈΥνΉζ┤ Ά╢ΝΉηξΈΡαΉπΑΈπΝ ΊΧΕΉΙαΉιΒΉζ╕ Ά▓ΔΉζΑ ΉΧΕΈΜΙΈΜν. ΉαΙΊδΕΈΛΦ ΉλΜΉπΑ ΉΧΛΉΧΕ ΊΠΚΆ╖ι ΉΔζΉκ┤Ά╕░Ά░ΕΉζΑ 6.7Ά░εΉδΦΈκε Έ│┤Ά│ιΈΡαΉΩΙΉε╝Έσ░, Ή┤ΙΆ╕░Ήζα ΊΧφΉΧΦΈ░σΉΓυΉΕι Έ│╡ΊΧσΉγΦΈ▓ΧΉΩΡΈΛΦ Έ░αΉζΣΉζ┤ ΉηΙΉε╝ΈΓα ΈΝΑΈ╢ΑΈ╢ΕΉζα Ά▓╜Ήγ░ΉΩΡΉΕε ΉηυΈ░εΊΧαΈσ░ Ήζ┤ΊδΕΉζα Ή╣αΈμΝΉΩΡΈΛΦ Έ░αΉζΣΉζ┤ ΉλΜΉπΑ ΉΧΛΉζΑ Ά▓ΔΉε╝Έκε ΉΧΝΈινΉι╕ ΉηΙΈΜν[3].
ΉΧΕΉπΒΆ╣ΝΉπΑ NMCΈΛΦ ΈΥεΈυ╝Ά▓Ν Έ│┤Ά│ιΈΡαΆ│ι ΉηΙΉε╝Έσ░ ΊΛ╣ΊηΙ ΊδΕΈΣΡΉΩΡ Έ░εΉΔζΊΧε NMCΈΛΦ ΉπΑΆ╕ΙΆ╣ΝΉπΑ 8ΉαΙΆ░Α Έ│┤Ά│ιΈΡαΉΩΙΈΜν. Έ│╕ ΉιΑΉηΡΈΥνΉζΑ Ή▓τ ΉΙαΉΙι ΊδΕ Ά▓╜Έ╢Α ΈΜρΉΙε ΈΗΞΉΨΣΉε╝Έκε ΉπΕΈΜρΈΡαΉΩΙΉε╝ΈΓα ΈΣΡ Έ▓ΙΉπ╕ ΉΙαΉΙιΉΩΡΉΕε ΊδΕΈΣΡ ΊΟ╕ΊΠΚΉΕ╕ΊΠυΉΧΦΉλΖ Ά▓╜Έ╢ΑΉιΕΉζ┤Έκε ΊβΧΉζ╕ΈΡαΉΩΙΆ│ι, Ή╢ΦΆ░ΑΈκε ΉΜεΊΨΚΊΧε Ά▓ΑΉΓυΉΔΒ NMCΈκε ΉπΕΈΜρΈΡε ΉοζΈκΑΈξ╝ Έ│┤Ά│ιΊΧαΆ│ιΉηΡ ΊΧεΈΜν.
Ήοζ ΈκΑΊΛ╣Ήζ┤ Ά│╝Ά▒░ΈιξΉζ┤ ΉΩΗΈΛΦ 4ΉΕ╕ ΈΓρΊβαΉζ┤ ΈΓ┤ΉδΡ 4Ήζ╝ ΉιΕΈ╢ΑΊΕ░ ΈπΝΉι╕ΉπΕ ΉλΝΉ╕κ ΉΧΖΊΧαΈ╢ΑΉζα ΉλΖΉ░╜ΉζΕ Ήμ╝ΉΗΝΈκε ΈΓ┤ΉδΡΊΧαΉαΑΈΜν. Ήβ╕ΈηαΉΩΡΉΕε ΉΜεΊΨΚΊΧε ΉΜιΉ▓┤Ά▓ΑΉπΕΉΔΒ ΉλΝΉ╕κ ΉΧΖΊΧαΈ╢ΑΉΩΡ ΈΦ▒ΈΦ▒ΊΧαΆ▓Ν ΈπΝΉι╕ΉπΑΈΛΦ ΉλΖΈυ╝Ήζ┤ Ή┤ΚΉπΕΈΡαΉΩΙΆ│ι Έ░εΉπΕΉζ┤ ΈΠβΈ░αΈΡαΉΩΙΉε╝Έσ░ Έ░εΉΩ┤ΉζΑ ΉΩΗΉΩΙΈΜν. Ά╡υΆ░Χ ΉΜεΉπΕ ΉΔΒΉΩΡΉΕε ΊΛ╣Ήζ┤ ΉΓυΊΧφΉζΑ Έ░εΆ▓υΈΡαΉπΑ ΉΧΛΉΧαΉε╝Έσ░ ΊδΕΈΣΡΈΛΦ ΊβαΉΧΕΉζα ΊαΣΉκ░Ά░Α ΉΨ┤ΈινΉδΝ Ά▓ΑΉΓυΊΧαΉπΑ Ές╗ΊΧαΉαΑΈΜν. ΈπΡΉ┤ΙΊαΙΉΧκΆ▓ΑΉΓυΉΔΒ Έ░▒ΊαΙΆ╡υ ΉΙαΉ╣αΈΛΦ 15310Ά░ε/mm3, C-Έ░αΉζΣΉΕ▒ ΈΜρΈ░▒ ΉΙαΉ╣αΈΛΦ 1.25 mg/dLΉαΑΈΜν. ΉιΕΉΓ░ΊβΦΈΜρΉ╕╡Ή┤υΉαΒΆ▓ΑΉΓυ(CT)ΉΩΡΉΕε ΉλΝΉ╕κ Ά▓╜Έ╢Α(Level III)ΉΩΡ 3.0├Ω2.8├Ω2.3 cmΉζα Ήκ░ΉαΒ ΉοζΆ░ΧΉζ┤ Ήηα ΈΡαΉπΑ ΉΧΛΈΛΦ Έ╢ΑΈ╢ΕΉζΕ ΈΠβΈ░αΊΧε, ΉιΕΈ░αΉιΒΉε╝Έκε Ήκ░ΉαΒ ΉοζΆ░ΧΉζ┤ Ήηα ΈΡαΈΛΦ ΈΜνΈ░εΉΕ▒ Ά▓σΈ▓╜ΉζΕ Ά░ΑΉπΕ ΉλΖΈυ╝Ήζ┤ Ά┤ΑΉ░░ΈΡαΉΩΙΉε╝Έσ░ Ήζ┤Ήβ╕ΉΩΡ ΉΨΣΉ╕κ Ά▓╜Έ╢ΑΉΩΡ ΈΜνΈ░εΉΕ▒Ήζα ΉηΕΊΝΝΉΕι Έ╣ΕΈΝΑΆ░Α Ά┤ΑΉ░░ΈΡαΉΩΙΈΜν(Fig. 1). Ήζ┤ΉΩΡ ΉηΕΊΝΝΉΕι ΈΗΞΉΨΣΉε╝Έκε ΉπΕΈΜρΊΧαΆ│ι ΉΙαΉΙι ΉΜεΊΨΚΊΧαΉαΑΆ│ι ΈΜνΈθΚΉζα ΈΗΞΉζ┤ Έ░░ΉΧκΈΡαΉΩΙΈΜν. Ήκ░ΉπΒ Ά▓ΑΉΓυ Ά▓░Ά│╝ΉΔΒ ΉΩ╝ΉοζΉζΕ ΈΠβΈ░αΊΧε ΈΗΞΉΨΣΉε╝Έκε ΉπΕΈΜρΈΡαΉΩΙΈΜν.
ΊΘ┤ΉδΡ Ήζ┤ΊδΕ Ά▓╜Ά│╝ Ά┤ΑΉ░░ΊΧαΈΞα ΉνΣ ΉΙαΉΙι 1Ά░εΉδΦ ΈΤνΈ╢ΑΊΕ░ Ήγ░Ή╕κ Ά▓╜Έ╢Α ΉλΖΈυ╝Ήζα ΊΒυΆ╕░ ΉοζΆ░ΑΈξ╝ Έ│┤ΉΩυ ΈΜνΉΜε ΉιΕΉΓ░ΊβΦΈΜρΉ╕╡Ή┤υΉαΒ Ά▓ΑΉΓυΈξ╝ ΉΜεΊΨΚΊΧαΉαΑΉε╝Έσ░, Ήζ┤ΉιΕΉζα Ή┤υΉαΒΆ│╝ Έ╣ΕΆ╡ΡΊΧαΉαΑΉζΕ ΈΧΝ Ήγ░Ή╕κΉΩΡ ΉηΙΈΞα ΉηΕΊΝΝΉΕιΈΥνΉζα ΊΒυΆ╕░Ά░Α ΉοζΆ░ΑΊΧαΉαΑΆ│ι ΈΝΑΈ╢ΑΈ╢Ε Έ╢ΑΈ╢Ε Ά┤┤ΉΓυΈξ╝ ΈΠβΈ░αΊΧαΉαΑΈΜν. Ήζ┤ΉβΑ ΊΧρΆ╗α Ήζ┤ΉιΕΉΩΡΈΛΦ Έ│┤Ήζ┤ΉπΑ ΉΧΛΈΞα ΊδΕΈΣΡΉζα ΉλΖΈυ╝Ήζ┤ CTΉΩΡΉΕε Ά┤ΑΉ░░ΈΡαΉΩΙΉε╝Έσ░(Fig. 2), ΊδΕΈΣΡΈΓ┤ΉΜεΆ▓╜ΉΔΒ ΉλΝΉ╕κ ΊδΕΈΣΡ ΉΔΒΈ╢ΑΉΩΡ ΈΣξΆ╖╝ ΈςρΉΨΣΉζα ΉλΖΈυ╝Ήζ┤ ΊβΧΉζ╕ΈΡαΉΩΙΈΜν(Fig. 3). ΊδΕΈΣΡ ΉλΖΈυ╝Ήζα ΉπΕΈΜρΉζΕ ΉεΕΊΧ┤ ΊδΕΈΣΡΈψ╕ΉΕ╕ΉΙαΉΙι Ήκ░ΉπΒΆ▓ΑΉΓυ Έ░Π Ήγ░Ή╕κ Ά▓╜Έ╢Α ΉηΕΊΝΝΉΕι ΉιΙΉιεΉΙιΉζΕ ΉΜεΊΨΚΊΧαΉαΑΉε╝Έσ░ ΊδΕΈΣΡΉΩΡΉΕεΈΛΦ Έ╢ΕΊβΦΆ░Α ΉΧΙ ΉλΜΉζΑ ΊΟ╕ΊΠΚΉΔΒΊΦ╝ΉΕ╕ΊΠυΉΧΦ(squamous cell carcinoma, poorly differentiated), Ά▓╜Έ╢Α ΉηΕΊΝΝΉΕιΉΩΡΉΕεΈΛΦ ΉιΕΉζ┤ΉΕ▒ ΊΟ╕ΊΠΚΉΔΒΊΦ╝ΉΕ╕ΊΠυΉΧΦ ΉΗΝΆ▓υΉζΕ Έ│┤ΉαΑΈΜν. Έσ┤ΉΩφΉκ░ΉπΒΊβΦΊΧβΆ▓ΑΉΓυ Ά▓░Ά│╝ P40Ά│╝ P16ΉΩΡ ΉΨΣΉΕ▒, Epstein-Barr virus (EBV)ΉΩΡ ΉζΝΉΕ▒ Έ░αΉζΣΉζΕ Έ│┤ΉαΑΈΜν(Fig. 4). ΉΙαΉΙι ΊδΕ MRIΉβΑ PET Ά▓ΑΉΓυΈξ╝ ΉΜεΊΨΚΊΧαΉαΑΉε╝Έσ░ ΊδΕΈΣΡ Έ░Π ΉΨΣΉ╕κ Ά▓╜Έ╢ΑΈο╝ΊΦΕΉιΙΉΩΡ hot uptakeΆ░Α Ά┤ΑΉ░░ΈΡαΈΓα ΉδΡΆ▓σ ΉιΕΉζ┤Έξ╝ ΉΜεΉΓυΊΧαΈΛΦ ΉΗΝΆ▓υΉζΑ Ά┤ΑΉ░░ΈΡαΉπΑ ΉΧΛΉΧαΈΜν. Έ│ΣΈουΆ│╝ΉΩΡΉΕε Ή╢ΦΆ░ΑΈκε NUT midline carcinomaΉΩΡ ΈΝΑΊΧε Έ╢ΕΉηΡΈ│ΣΈου Ά▓ΑΉΓυΈξ╝ ΉπΕΊΨΚΊΧαΉαΑΆ│ι NUT positiveΈκε NUT midline carcinomaΈκε ΉπΕΈΜρΈΡαΉΩΙΈΜν(Fig. 5). Ήζ┤ΊδΕ ΊΧφΉΧΦΈ░σΉΓυΉΕι Ή╣αΈμΝΈΛΦ ΊΔΑΈ│ΣΉδΡΉε╝Έκε ΉιΕΉδΡΊΧαΉΩυ ΉπΕΊΨΚΊΧαΉαΑΉε╝Έσ░ 16Ά░εΉδΦ ΈΤν ΉΓυΈπζΊΧαΉαΑΈΜν.
Ά│ι Ή░░ΉΔΒΈ╢Α Ία╕Ίζκ-ΉΗΝΊβΦΆ╕░ ΉΔΒΊΦ╝ΉΩΡΉΕε Έ░εΉΔζΊΧαΈΛΦ ΈΝΑΈ╢ΑΈ╢ΕΉζα ΉΧΦΉλΖΉζΑ ΊΟ╕ΊΠΚΉΔΒΊΦ╝ΉΧΦΉλΖΉε╝Έκε, conventional typeΉζ┤ΈΓα variant type ΈςρΈΣΡΉΩΡΉΕε ΊζκΉΩ░Ήζ┤ΈΓα ΉζΝΉμ╝Ά░Α Ά┤ΑΈιρΉζ┤ ΉηΙΈΛΦ Ά▓ΔΉε╝Έκε ΉΧΝΈινΉι╕ ΉηΙΈΜν. Έ░ΦΉζ┤ΈθυΉΛνΈΥνΈΠΕ Ήζ┤ΈθυΊΧε ΉΧΖΉΕ▒ΉλΖΉΨΣΉζα Έ░εΉΔζΉΩΡ ΉΩφΊΧιΉζΕ ΊΧαΈΛΦΈΞ░ Ήζ╕Ά░ΕΉειΈΣΡΉλΖΈ░ΦΉζ┤ΈθυΉΛν(human papillomavirus, HPV)ΉβΑ ΉΩκΉΛνΊΔΑΉζ╕-Έ░Φ Έ░ΦΉζ┤ΈθυΉΛν(EBV)Ά░Α Ήζ┤ΉΩΡ ΊΠυΊΧρΈΡεΈΜν. Ά╖╕ΈθυΈΓα Έ│╕ ΉοζΈκΑΉζα ΊβαΉηΡΈΛΦ ΉΗΝΉΧΕΈκε Ήζ┤ΈθυΊΧε ΉεΕΊΩαΉγΦΉζ╕ΈΥνΆ│╝ΈΛΦ Ά┤ΑΆ│ΕΆ░Α ΉΩΗΉΩΙΈΜν. ΈαΡΊΧε Έ░εΈ│Σ ΉΩ░Έι╣ ΈαΡΊΧε 4ΉΕ╕Έκε Ήζ╝Έ░αΉιΒΉζ╕ ΊδΕΈΣΡΉΧΦΉζα Έ░εΈ│Σ ΉΩ░Έι╣Ήζα Έ▓ΦΉεΕΉΩΡΉΕε Έ▓ΩΉΨ┤ΈΓα ΉηΙΈΜν. Ή▓αΉζΝΉΩΡΈΛΦ NMCΆ░Α ΉΗΝΉΧΕ ΈαΡΈΛΦ ΉιΛΉζΑ ΉΕ▒Ήζ╕ΉΩΡΉΕε Έ░εΉΔζΊΧαΈΛΦ Ά▓ΔΉε╝Έκε Ήμ╝Έκε Έ│┤Ά│ιΈΡαΉΩΙΉε╝ΈΓα, Ή╡εΆ╖╝ΉΩΡΈΛΦ NMCΉζα Έ░εΉΔζΉζΑ ΉΕ▒Έ│ΕΉΩΡ ΉΔΒΆ┤ΑΉΩΗΉζ┤ ΉΜιΉΔζΉΧΕΈ╢ΑΊΕ░ 80ΈΝΑΆ╣ΝΉπΑ Ά│ιΈξ┤Ά▓Ν Έ░εΉΔζΈΡαΈΛΦ Ά▓ΔΉε╝Έκε ΉΧΝΈινΉι╕ ΉηΙΈΜν[4]. ΈΣΡΆ▓╜Έ╢Α ΉαΒΉΩφΉζα poorly differentiated Ία╣ΉζΑ undifferentiated carcinomaΈκε ΊβαΉηΡΈΥνΉζα ΉηΕΉΔΒΈ│ΣΈουΊΧβΉιΒ ΊΛ╣ΉΕ▒ Έ░Π NUT expressionΉζΕ Έ╢ΕΉΕζΊΧε ΉΩ░Ά╡υΉΩΡΉΕε, Ή┤ζ 362ΈςΖ ΉνΣ 4ΈςΖ(1.1%)Ήζ┤ NUT-specific monoclonal antibodyΉΩΡΉΕε strong nuclear expressionΉζΕ Έ│┤ΉαΑΉε╝Έσ░, Ήζ┤ΈΛΦ ΈςρΈΣΡ Έ╢ΑΈ╣ΕΈΠβΉΩΡΉΕε Έ░εΉΔζΊΧε ΉλΖΉΨΣΉζ┤ΉΩΙΈΜν. 4ΈςΖ ΉνΣ 1ΈςΖΉζ┤ ΉιΛΉζΑ ΈΓρΉΕ▒(29ΉΕ╕)Ήζ┤ΉΩΙΉε╝Έσ░ ΈΓαΈρ╕ΉπΑΈΛΦ 50-60ΈΝΑΈκε ΊβΧΉζ╕ΈΡαΉΩΙΈΜν[5].
ΊδΕΈΣΡΉΩΡ Έ░εΉΔζΊΧε NMCΈΛΦ Ά╖╣ΊηΙ ΈΥεΈυ╝ΉΨ┤ ΊαΕΉηυΆ╣ΝΉπΑ Έ░εΊΣεΈΡε Ά▓ΔΉζΑ 8ΉαΙΉζ┤Έσ░, Έ│╕ ΈΖ╝Έυ╕Ήζα ΉοζΈκΑ 1Ά▒┤ΉζΕ Ή╢ΦΆ░ΑΊΧαΉΩυ Ήζ┤ΈΥνΉζα ΉηΕΉΔΒΈ│ΣΈουΊΧβΉιΒ ΊΛ╣ΉΕ▒ΉζΕ ΉιΧΈουΊΧαΉαΑΈΜν(Table 1) [4,6-9]. 9ΈςΖ ΉνΣ ΈΓρΉΕ▒Ήζ┤ 5ΈςΖ, ΉΩυΉΕ▒Ήζ┤ 4ΈςΖΉζ┤Έσ░ ΊΠΚΆ╖ι ΉπΕΈΜρ ΉΩ░Έι╣ΉζΑ 29.4ΉΕ╕Ήζ┤ΈΜν. Έ░εΈ│Σ ΉεΕΉ╣αΈΛΦ supraglottisΆ░Α 5ΈςΖΉε╝Έκε Ά░ΑΉηξ ΈπΟΉΧαΈΜν. ΈΝΑΈ╢ΑΈ╢ΕΉζα ΉοζΈκΑΉΩΡΉΕε ΉΙαΉΙιΉζΕ ΉΜεΊΨΚΊΧαΉαΑΉε╝ΈΓα Έ│╕ ΉοζΈκΑΉΩΡΉΕεΈΛΦ Έ│┤Ία╕ΉηΡΉβΑ Ή╣αΈμΝ Έ░σΈ▓ΧΉΩΡ ΈΝΑΊΧε ΉΔΒΈΜ┤ ΊδΕ ΉΙαΉΙιΉζΑ ΉΜεΊΨΚΊΧαΉπΑ ΉΧΛΆ╕░Έκε Ά▓░ΉιΧΊΧαΉαΑΈΜν.
ΈΣΡΆ▓╜Έ╢ΑΉλΖΉΨΣΉΩΡΉΕε NMCΈΛΦ ΈπνΉγ░ ΈΥεΈυ╝Ά▓Ν Έ░εΉΔζΊΧαΉπΑΈπΝ ΉΔΒΈ╢Α ΉΗΝΊβΦ-Ία╕ΊζκΆ╕░Ά│ΕΈΓα Έ╢ΑΈ╣ΕΈΠβΉζα poorly differentiated Ία╣ΉζΑ undifferentiated carcinomaΈκε ΉλΒΊηΝΈΜνΈσ┤ Έυ┤ΉΜεΊΧι ΉΙα ΉΩΗΈΛΦ ΉΙαΉνΑΉζα ΉειΈ│ΣΈξιΉζΕ Έ│┤Ήζ┤ΈψΑΈκε, ΉζαΉΜυΉζ┤ ΈΡαΈΛΦ Ά▓╜Ήγ░ΉΩΡΈΛΦ NUTΉΩΡ ΈΝΑΊΧε immunohistochemistry (NUT IHC)Έξ╝ ΉΜεΊΨΚΊΧαΈΛΦ Ά▓ΔΉζ┤ Έ░ΦΈηΝΉπΒΊΧι Ά▓ΔΉζ┤ΈΜν[5]. Ή╡εΆ╖╝ΉΩΡΈΛΦ ΈςρΈΥι poorly differentiated non-cutaneous carcinomasΉΩΡΉΕε squamous differentiationΉζα ΉειΈυ┤ΉΩΡ ΉΔΒΆ┤Α ΉΩΗΉζ┤ NMCΉζα Ά░ΑΈΛξΉΕ▒ΉζΕ Έ░░ΉιεΊΧαΆ╕░ ΉεΕΊΧαΉΩυ NUT IHCΈξ╝ ΉΜεΊΨΚΊΧαΈΛΦ Ά▓ΔΉζΕ Ά╢ΝΆ│ιΊΧαΆ╕░ΈΠΕ ΊΧεΈΜν[10]. ΈαΡΊΧε ΈΓαΉζ┤ΉβΑ ΊζκΉΩ░ΉειΈυ┤ΈΛΦ NMCΉζα Ά░ΑΈΛξΉΕ▒ΉζΕ Έ░░ΉιεΊΧαΈΛΦΈΞ░ ΉΓυΉγσΈΡαΉΨ┤ΉΕεΈΛΦ ΉΧΙΈΡαΈσ░, glandular differentiationΉζΕ Έ│┤Ήζ┤ΈΛΦ ΉλΖΉΨΣΆ│╝ HPVΉβΑ EBVΉβΑ Ά░βΉζΑ viral etiologyΈΛΦ NMCΉβΑ Ά┤ΑΈιρΉζ┤ ΉΩΗΉε╝ΈψΑΈκε Έ░░Ήιε ΉπΕΈΜρΉΩΡ Ήζ┤ΉγσΊΧι ΉΙα ΉηΙΈΜνΈΛΦ ΉΩ░Ά╡υΆ▓░Ά│╝ΈΠΕ ΉηΙΈΜν[10].
NMCΉζα ΉπΕΈΜρΉζΑ ΊΧ╡ΊαΧ Έ╢ΕΉΕζΉζΕ ΊΗ╡ΊΧ┤ t(15;19) ΉηυΈ░░ΉΩ┤ΉζΕ Έ│┤ΉΩυΉμ╝ΈΛΦ Ά▓ΔΉε╝Έκε Ή╢σΈ╢ΕΊΧαΉπΑΈπΝ, NUT Έ░Π BRD4 ΉειΉιΕΉηΡΉΩΡ ΈΝΑΊΧε fluorescence in situ hybridization Ά▓ΑΉΓυΈΠΕ Ά░εΈ░εΈΡαΉΨ┤ ΉηΙΈΜν[11]. Ή╡εΆ╖╝ ΉΩ░Ά╡υΉΩΡΉΕε ΉΚ╜Ά▓Ν ΉΓυΉγσΊΧι ΉΙα ΉηΙΈΛΦ ΉπΕΈΜρ Ά▓ΑΉΓυΈξ╝ Ά░εΈ░εΊΧαΆ╕░ ΉεΕΊΧ┤ NUTΉΩΡ ΈΝΑΊΧε ΈΜρΉζ╝ ΊΧφΉ▓┤Έξ╝ ΉΔζΉΓ░ΊΨΙΆ│ι, Ήζ┤Ά▓ΔΉζ┤ IHCΉΩΡ ΉζαΊΧ┤ NUT Έ░εΊαΕΉζΕ Ά░ΡΉπΑΊΧαΈΛΦ Ά▓ΔΉζΕ ΊβΧΉζ╕ΊΧαΉαΑΈΜν. ΈΝΑΉκ░ Ήκ░ΉπΒΉζΕ ΊΠυΊΧρΊΧε ΉΩ░Ά╡υΉΩΡΉΕε NUT ΈΜρΉζ╝ ΊΧφΉ▓┤ΈΛΦ NMCΉζα ΉπΕΈΜρΉΩΡ ΉηΙΉΨ┤ 100%Ήζα ΊΛ╣Ήζ┤ΈΠΕΉβΑ 87%Ήζα Έψ╝Ά░ΡΈΠΕΈξ╝ Ά░ΑΉπΑΈΛΦ Ά▓ΔΉε╝Έκε ΊβΧΉζ╕ΈΡαΉΩΙΈΜν[12].
NMCΉζα Ή╣αΈμΝΉΩΡ ΉηΙΉΨ┤, ΉΧΕΉπΒΆ╣ΝΉπΑ ΊΣεΉνΑ Ή╣αΈμΝΈ▓ΧΉΩΡ ΈΝΑΊΧε consensusΈΛΦ ΉΩΗΉε╝Έσ░ ΊΧφΉΧΦΊβΦΊΧβΉγΦΈ▓Χ, Έ░σΉΓυΉΕιΉγΦΈ▓Χ, ΉΙαΉΙιΉζΕ ΊΠυΊΧρΊΧαΈΛΦ ΈΜνΉνΣ ΉιΣΆ╖╝Έ▓ΧΉζ┤ ΉηΕΉΔΒΉιΒΉε╝Έκε ΉΓυΉγσΈΡαΆ│ι ΉηΙΈΜν. ΉΙαΉΙιΉζ┤ Ά░ΑΈΛξΊΧε ΉΔΒΊβσΉζ┤Έζ╝Έσ┤ ΉΙαΉΙιΉζΕ ΉΜεΊΨΚΊΧαΈΛΦ Ά▓ΔΉζ┤ ΉαΙΊδΕΉΩΡ Ά╕ΞΉιΧΉιΒΉζ╕ ΉαΒΊΨξΉζΕ Έψ╕Ή╣αΈΛΦΈΞ░, 40ΈςΖΉζα ΈΣΡΆ▓╜Έ╢Α NMC ΊβαΉηΡΆ╡░ΉζΕ ΊΠυΊΧρΊΧε ΉΩ░Ά╡υΉΩΡΉΕε 2ΈΖΕ ΉΔζΉκ┤ΉερΉζΑ 30%ΉαΑΉε╝Έσ░, Ή┤ΙΆ╕░ΉΩΡ Ά╖╝Ή╣αΉιΒ ΉιΙΉιεΉΙιΉζΕ ΉΜεΊΨΚΊΧαΆ│ι Έ│┤Ήκ░ ΊΧφΉΧΦΈ░σΉΓυΉΕιΉγΦΈ▓ΧΉζΕ ΉΜεΊΨΚ Έ░δΉζΑ 3ΈςΖΉζ┤ Ά░ΒΆ░Β 35, 72, 78Ά░εΉδΦ ΉΔζΉκ┤ΊΧρΉε╝ΈκεΉΕε ΉηξΆ╕░ ΉΔζΉκ┤ΉηΡΆ░Α ΈΡαΉΩΙΈΜν[13]. Cisplatin, taxanes, alkylating agentΈξ╝ Ήζ┤ΉγσΊΧε ΊΧφΉΧΦΈ░σΉΓυΉΕι Έ│╡ΊΧσΉγΦΈ▓ΧΉζ┤ Ή▓αΉζΝΉΩΡΈΛΦ Έ░αΉζΣΉζ┤ ΉηΙΉε╝ΈΓα ΈΝΑΈ╢ΑΈ╢ΕΉζα Ά▓╜Ήγ░ΉΩΡΉΕε ΉηυΈ░εΊΧαΈσ░ Ά╖╕ Ήζ┤ΊδΕΉζα Ή╣αΈμΝΉΩΡΈΛΦ Έ░αΉζΣΉζ┤ ΉλΜΉπΑ ΉΧΛΉζΑ Ά▓ΔΉε╝Έκε ΉΧΝΈινΉι╕ ΉηΙΈΜν[14,15]. Ή╡εΆ╖╝ uniform ΊΧε ΉειΉιΕΉιΒ Έ│ΑΉζ┤Έξ╝ Έ░ΦΊΔΧΉε╝Έκε ΊΧε targeted therapyΆ░Α ΉΗΝΆ░εΈΡαΆ│ι ΉηΙΈΜν. BRD-NUT fusion protein sequenceΈΛΦ ΊΟ╕ΊΠΚΉΕ╕ΊΠυΈκεΉζα Έ╢ΕΊβΦΈξ╝ ΈπΚΈΛΦ Ά▓ΔΉε╝Έκε ΉΧΝΈινΉι╕ ΉηΙΆ│ι, Ήζ┤ΉΩΡ ΈΦ░Έζ╝ BRD-NUTΈξ╝ ΉΨ╡ΉιεΊΧαΈσ┤ ΊΟ╕ΊΠΚΉΕ╕ΊΠυ Έ╢ΕΊβΦΆ░Α ΉειΈΠΕΈΡαΈσ░, Ά▓░Ά╡φ ΉλΖΉΨΣ ΉΕ╕ΊΠυΈΥνΉζΑ ΉΕ▒ΉηξΉζΕ ΈσΙΉ╢ΦΆ│ι Ίε┤Έσ┤ ΉΔΒΊΔεΉζα ΊΟ╕ΊΠΚΉΕ╕ΊΠυΈκε Έ╢ΕΊβΦΈΡαΆ▓Ν ΈΡεΈΜν. Ήζ┤ΈθυΊΧε Έ░εΆ▓υΉζ┤ ΉΔΙΈκεΉγ┤ Ή╣αΈμΝΉζα Ά░ΑΈΛξΉΕ▒ΉζΕ ΉΩ┤ΉΩΙΆ│ι bromodomain and extraterminalmotif inhibitorΉβΑ histone deacetylase inhibitorsΆ░Α ΊαΕΉηυ Ήζ┤ΉγσΈΡαΆ│ι ΉηΙΈΜν[5].
Έ│╕ ΉοζΈκΑΈΛΦ 4ΉΕ╕ ΉΗΝΉΧΕΉΩΡΉΕε NMCΆ░Α ΊδΕΈΣΡΉΩΡ Έ░εΉΔζΊΧαΉΩυ Ά▓╜Έ╢Α Έο╝ΊΦΕΉιΙ ΉιΕΉζ┤Ά░Α ΈΡε Ήζ┤ΊδΕ Έ░εΆ▓υΈΡε ΈΥεΈυ╕ ΉοζΈκΑΉζ┤ΈΜν. NMCΉζα ΈΓχΉζΑ ΉειΈ│ΣΈξι Έ░Π Έ╣ΕΊΛ╣Ήζ┤ΉιΒΉζ╕ ΉηΕΉΔΒΉΨΣΉΔΒΉζΕ Ά│ιΈινΊΧ┤ Έ│┤ΉΧαΉζΕ ΈΧΝ, Ά░ΡΈ│ΕΉπΕΈΜρΉε╝Έκε NMCΈξ╝ ΉΔζΆ░ΒΊΧαΈΛΦ Ά▓ΔΆ│╝ Ήζ╝Έ░αΉιΒΉε╝Έκε ΉΜεΊΨΚΊΧαΈΛΦ Έ│ΣΈουΉκ░ΉπΒΊΧβΉιΒ Ά▓ΑΉΓυ Ά▓░Ά│╝Έξ╝ ΊΗ╡ΊΧ┤ΉΕε NMCΈξ╝ ΉπΕΈΜρΊΧαΈΛΦ Ά▓ΔΉζΑ ΉΨ┤ΈινΉγ┤ Ήζ╝Ήζ┤ΈΜν. Έ│╕ ΉοζΈκΑΈξ╝ ΊΗ╡ΊΧ┤ΉΕε ΊδΕΈΣΡ Έ░Π ΈΣΡΆ▓╜Έ╢ΑΉΩΡ Έ░εΉΔζΊΧαΈΛΦ ΊΟ╕ΊΠΚΉΕ╕ΊΠυΉΧΦΉλΖ Έ░Π Έψ╕Έ╢ΕΊβΦΉΧΦΉλΖΉζα Ά▓╜Ήγ░ΉΩΡ NUT Έσ┤ΉΩφΉκ░ΉπΒΊβΦΊΧβΆ▓ΑΉΓυΈξ╝ ΉΜεΊΨΚΊΧαΈΛΦ Ά▓ΔΉζ┤ ΉζαΈψ╕Ά░Α ΉηΙΉζΝΉζΕ ΉΧΝ ΉΙα ΉηΙΈΜν.
NotesAuthor contributions WritingέΑΦoriginal draft: Min Seok Kim. WritingέΑΦreview & editing: Seung Hoon Woo. Fig.┬ι1.Initial neck CT image of patient. A 3.0├Ω2.8├Ω2.3 cm lobulated multiseptated enhancing lesion with internal multiple non-enhancing portions and perinodal fatty infiltration in left neck level III, and several enhancing lymph nodes in both jugular chains. 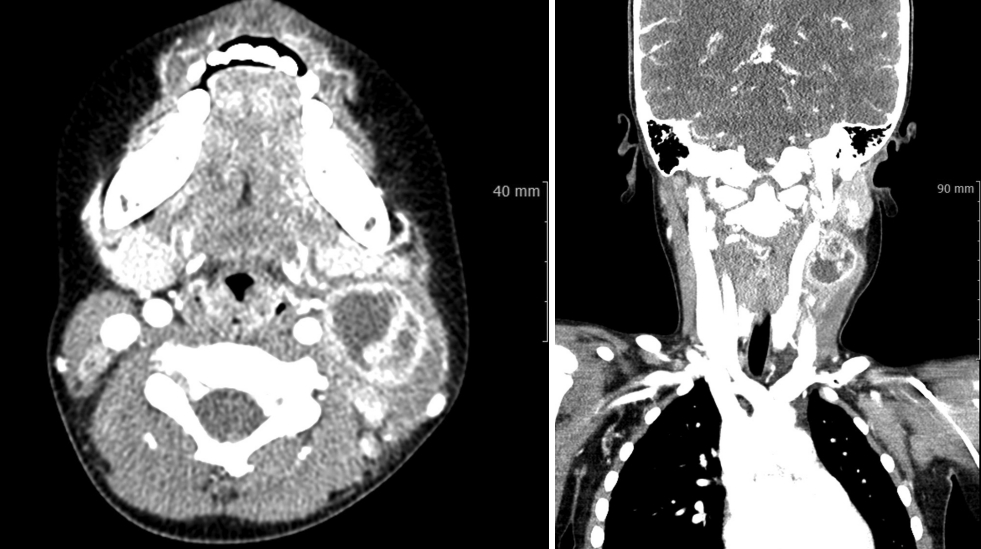
Fig.┬ι2.2nd neck CT image of patient, taken 2 month after initial exam. A: Markedly increased size of necrotic portions in enlarged conglomerated lymph nodes in right neck level IIέΑΥIV. B and C: Severe swelling of bilateral aryepiglottic folds (B) and mass in left supraglottis (C, arrow) was observed. 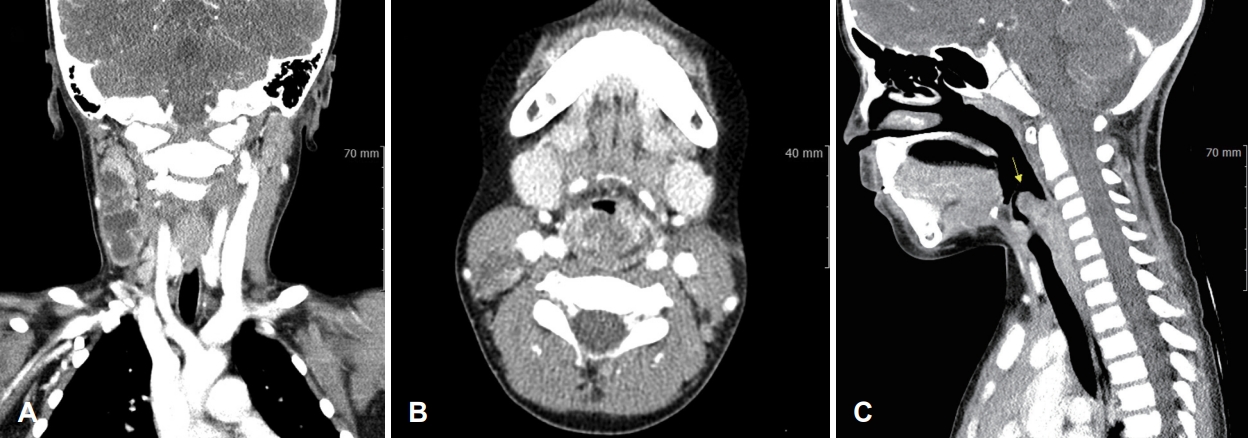
Fig.┬ι4.The result of immunohistochemical staining showed positive reactions for P40 and P16, and negative for Epstein-Barr virus (A: hematoxylin and eosin stain, ├Ω200; B: P16 stain, ├Ω200; C: P40 stain, ├Ω200). 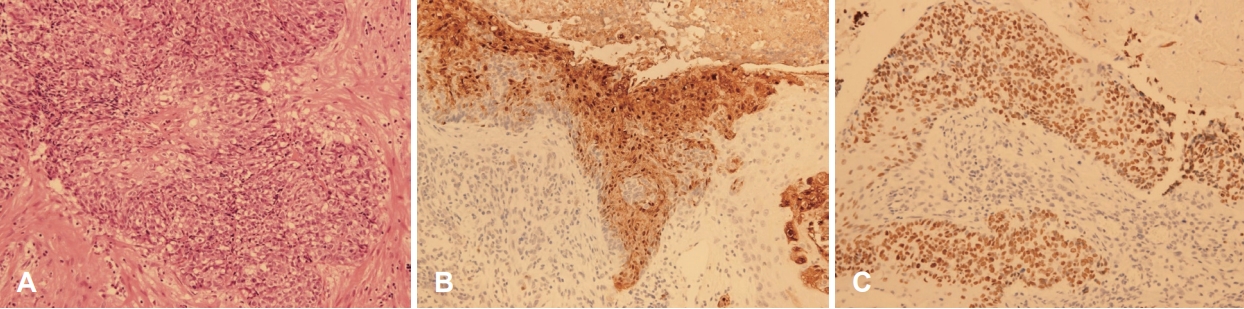
Fig.┬ι5.Nuclear protein in testis immunohistochemical staining of the specimen. Diffusely positive tumor nuclei with a speckled pattern. 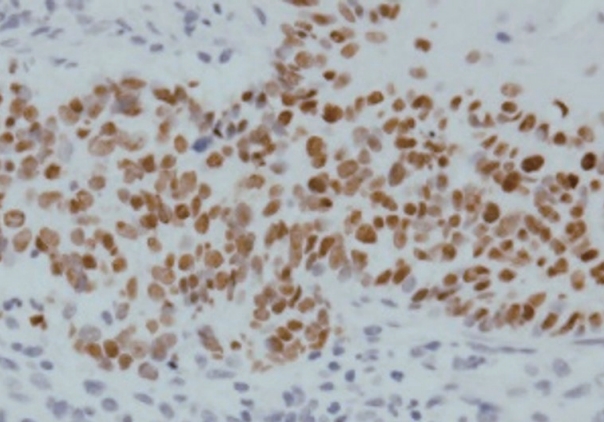
Table┬ι1.Clinicopathological characteristics of laryngeal NMC patients
NMC, nuclear protein in testis midline carcinoma; PDC, poorly differentiated carcinoma; UC, undifferentiated carcinoma; HGMN, high-grade malignant neoplasm; NA, not available; NUT, nuclear protein in testis; SCC, squamous cell carcinoma; AWD, Alive with disease; CRT, chemoradiotherapy; IMRT, intensity modulated radiation therapy; TCM, transoral CO2 laser microsurgery REFERENCES2. Chau NG, Ma C, Danga K, Al-Sayegh H, Nardi V, Barrette R, et al. An anatomical site and genetic-based prognostic model for patients with nuclear protein in testis (NUT) midline carcinoma: Analysis of 124 patients. JNCI Cancer Spectr 2019;4(2):pkz094.
3. French CA. Demystified molecular pathology of NUT midline carcinomas. J Clin Pathol 2010;63(6):492-6.
4. Stelow EB, Bellizzi AM, Taneja K, Mills SE, Legallo RD, Kutok JL, et al. NUT rearrangement in undifferentiated carcinomas of the upper aerodigestive tract. Am J Surg Pathol 2008;32(6):828-34.
5. Lee T, Cho J, Baek CH, Son YI, Jeong HS, Chung MK, et al. Prevalence of NUT carcinoma in head and neck: Analysis of 362 cases with literature review. Head Neck 2020;42(5):924-38.
6. Vargas SO, French CA, Faul PN, Fletcher JA, Davis IJ, Dal Cin P, et al. Upper respiratory tract carcinoma with chromosomal translocation 15;19: Evidence for a distinct disease entity of young patients with a rapidly fatal course. Cancer 2001;92(5):1195-203.
7. Kundra A, Andrei M, Westra W, Chaudhry R, Moussouris H, Gohari A, et al. Nuclear protein in testis midline carcinoma of larynx: An underdiagnosed entity. Head Neck 2016;38(8):E2471-4.
8. Hellquist H, French CA, Bishop JA, Coca-Pelaz A, Propst EJ, Paiva Correia A, et al. NUT midline carcinoma of the larynx: An international series and review of the literature. Histopathology 2017;70(6):861-8.
9. Zhang H, Liu MH, Zhang J, Luo SP, Wang CB, Zhao ZH, et al. Successful treatment of a case with NUT midline carcinoma in the larynx and review of the literature. Clin Case Rep 2019;8(1):176-81.
10. French CA. NUT carcinoma: Clinicopathologic features, pathogenesis, and treatment. Pathol Int 2018;68(11):583-95.
11. French CA, Miyoshi I, Kubonishi I, Grier HE, Perez-Atayde AR, Fletcher JA. BRD4-NUT fusion oncogene: A novel mechanism in aggressive carcinoma. Cancer Res 2003;63(2):304-7.
12. Haack H, Johnson LA, Fry CJ, Crosby K, Polakiewicz RD, Stelow EB, et al. Diagnosis of NUT midline carcinoma using a NUT-specific monoclonal antibody. Am J Surg Pathol 2009;33(7):984-91.
13. Chau NG, Hurwitz S, Mitchell CM, Aserlind A, Grunfeld N, Kaplan L, et al. Intensive treatment and survival outcomes in NUT midline carcinoma of the head and neck. Cancer 2016;122(23):3632-40.
14. Napolitano M, Venturelli M, Molinaro E, Toss A. NUT midline carcinoma of the head and neck: Current perspectives. Onco Targets Ther 2019;12:3235-44.
15. PDQ Pediatric Treatment Editorial Board. Childhood midline tract carcinoma involving the NUT gene (NUT midline carcinoma) treatment (PDQ┬χ): Health professional version. Bethesda, MD: National Cancer Institute (US); 2002.
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 |
 |