갑상선 협부 유두상 암의 양측 중심 경부 림프절 전이에 관여하는 인자 분석
The Factors Involved in Bilateral Central Lymph Node Metastasis of Isthmus Papillary Thyroid Cancer
Article information
Trans Abstract
Background and Objectives
The aims of this study were to evaluate the rate and risk factors involved in bilateral central lymph node metastasis in patients with papillary thyroid cancer (PTC) found in the isthmus and compared them to tumors located in other thyroid regions, using those findings to establish a surgical strategy for treating these tumors.
Subjects and Method
We compared the clinical and pathological data of 48 patients with isthmic PTC and 141 patients with PTC found in other thyroid regions, all of whom underwent total thyroidectomy and bilateral central neck dissection.
Results
The rates of bilateral central lymph node metastasis were higher in the isthmus group than in the non-isthmus group (29.2% vs. 9.9%; p=0.001). On multivariate analysis, the isthmic location of the tumor was an independent risk factor for bilateral central lymph node metastasis (OR=3.458 p=0.005). But the positional relationship between the tracheal midline and the nodule was not clear in lymph node metastasis in the isthmus group.
Conclusion
Bilateral central neck dissection should be considered for isthmic PTC regardless of the relation between nodule and tracheal midline because of the high rate of bilateral central lymph node metastasis.
서 론
갑상선 유두상암(papillary thyroid carcinoma)은 여포 세포(follicular cell)에서 기원하는 갑상선 암종의 대부분을 차지하는 조직 유형으로 일반적으로 예후가 매우 좋은 암이지만 종종 림프절 전이를 일으키기 때문에 수술적 치료를 결정하는 데 있어 림프절 전이의 양상을 명확히 아는 것이 중요하다[1]. 중심 경부 림프절(central neck lymph node)은 갑상선 유두상암의 전이가 가장 흔하게 일어나는 위치이며[2], 이는 국소재발률의 증가 및 생존율의 감소와 관련이 있다[3,4]. 현재까지 갑상선 유두상암의 치료적 중심 경부 림프절 청소술(therapeutic central-compartment neck dissection)의 개념은 잘 정립되어 있으나[5], 예방적 중심 경부 림프절 청소술(prophylactic central-compartment neck dissection)의 역할과 그 수술범위에 대한 것은 여전히 논란이 있다[6-9].
예방적 중심 경부 림프절 청소술 시행을 지지하는 입장에서 갑상선 유두상암은 림프절 전이의 유병률이 높으며[10], 때문에 중심 경부 림프절에서의 미세 전이암 제거는 재발을 예방하고 전체 생존율을 향상시킨다는 것이다[5,11,12]. 또한, 중심 경부 림프절 재발로 인해 재수술을 시행할 경우에는 이에 따른 합병증 발생률이 높아지며[13], 병기 설정을 위하거나 수술 후 방사성 요오드 치료(radioactive iodine therapy)의 필요 여부에 관한 결정을 위해서는 림프절 상태에 대한 병리 보고서가 필요하다는 점에서 예방적 중심 경부 림프절 청소술의 필요성이 제기되고 있다[14]. 하지만 통상적인 예방적 중심 경부 림프절 청소술은 영구적인 부갑상선 기능 저하증(hypoparathyroidism) 및 반회후두신경(recurrent laryngeal nerve) 손상의 가능성을 높인다[15,16]. American Thyroid Association의 최신 가이드라인에 따르면 예방적 중심 경부 림프절 청소술은 진행암(advanced primary tumor)인 경우(T3/T4), 임상적으로 외측 림프절 전이(lateral lymph node metastasis)가 의심되는 경우(cN1b), 추가 치료 계획을 위한 정보 획득이 목적인 경우에 시행할 수 있으며, 종양의 크기가 작은 경우(T1/T2), 침윤이 없거나 임상적으로 림프절 전이 소견이 없는 경우(cN0)에는 예방적 중심 경부 림프절 청소술을 시행하지 않을 수 있다[17]. 이 외에도 성별, 나이 등 중심 경부 림프절 전이에 관련이 있다고 알려진 위험인자를 가진 환자에서도 예방적 중심 경부림프절 청소술을 고려해야 한다[18].
모든 갑상선 유두상암의 대략 1~9%까지는 갑상선 협부(isthmus)에 위치해 있다[19-21]. 갑상선 협부는 기관(trachea)의 앞에 위치하고 있으며, 피대근(strap muscle), 근막(fascia) 및 피부(skin)와 인접하고 있어 갑상선 협부에서 발생한 유두상암의 경우 다른 부위보다 국소 침범(local invasion)의 가능성이 더 높은 것으로 알려져 있다[22,23]. 그러나 갑상선 협부 유두상암에서의 중심 경부 림프절 전이의 양상은 아직까지 충분한 연구가 이루어지지 않았으며[14,21], 명확한 치료 가이드라인도 결정되지 않았다[20]. Song 등[14]은 갑상선 협부에 발생한 유두상암의 경우, 양측 중심 경부 림프절 전이 빈도가 높기 때문에 중심 경부 림프절 청소술 시에 양측으로 시행할 것을 권유하고 있다. 하지만 이미 언급한 바와 같이 양측 중심 경부 림프절 청소술(bilateral central-compartment neck dissection)은 일측(unilateral)에 비해 수술 후 합병증의 발생률이 일반적으로 높아진다. 따라서 갑상선 협부 유두상암의 치료에 있어 양측 및 일측 중심 경부 림프절 청소술을 결정할 수 있는 인자들은 없는지, 특히 협부 내에서의 위치에 따른 차이는 없는지에 대한 논의가 필요하다.
따라서 본 논문에서는 갑상선 협부에 발생한 유두상암에서 중심 경부 림프절 전이의 빈도와 그와 관련된 인자에 대해 분석해 보고 아울러 중심 경부 림프절 청소술의 적절한 범위에 대해 알아보고자 하였다.
대상 및 방법
본 저자들은 주요 결절이 갑상선 협부에 위치한 갑상선 유두상암 환자 48명을 대상으로 후향적 연구를 진행하였다. 이들은 2011년 10월부터 2015년 12월까지 본원에서 갑상선 전절제술(total thyroidectomy) 및 경부 림프절 청소술을 시행받았다. 수술 전 갑상선 협부에 위치한 결절에 초음파 유도하 세침흡인세포검사(ultrasonography-guided fine needle aspiration cytology)를 시행하여 Bethesda system상 class V 혹은 class VI의 결과가 나온 환자 중 수술 후 병리조직검사에서 다발성으로 협부 외 결절이 유두상암으로 진단된 경우는 연구에서 배제하였다. 대조군은 2013년 2월부터 2015년 12월까지 협부 외에 위치한 갑상선 유두상암에 대하여 갑상선 전절제술 및 경부 림프절 청소술을 시행받은 141명이었다. 이들은 모두 단일 결절에서 유두상암으로 진단된 경우였다. 모든 환자에서 갑상선 전절제술 및 양측 중심 경부 림프절 청소술을 시행하였고, 외측 경부 림프절 청소술은 선택적으로 시행하였다. 협부 및 비협부(non-isthmus) 갑상선 유두상암 그룹에서 환자 성별(sex), 나이(age), 종양크기(tumor size), 갑상선외 침윤(extrathyroidal extension), TNM 병기(TNM stage), 신체질량지수(body mass index)를 비교하였다. 또한, 단변량 분석(univariate analysis)과 다변량 분석(multivariate analysis)을 통해 종양 협부 위치를 포함하여 중심 경부 림프절 전이와 관련된 잠재적 위험요인을 분석하였다.
모든 환자에서 수술 전 신체검진 및 컴퓨터단층촬영(computed tomography), 초음파 검사를 포함한 영상검사를 시행하였으며, 림프절 전이 유무를 평가하였다. 또한, 해당 갑상선 결절 및 전이가 의심되는 림프절에 대하여 초음파 유도하 세침흡인세포검사를 시행하였고, 치료적 외측 경부 림프절 청소술은 신체검진이나 영상검사에서 전이가 의심되거나 세침흡인세포검사에서 확진되었을 때만 시행하였다. 임상적으로 외측 경부 림프절 전이가 의심되지 않을 경우에는 예방적 외측 경부 림프절 청소술은 시행하지 않았다. 갑상선암의 다른 병리 조직 유형을 가지거나 재발인 경우, 이전 경부수술이나 방사선 치료를 받은 적이 있거나 갑상선 엽절제술(lobectomy)이나 일측 중심 경부 림프절 청소술만 시행받은 환자는 대상에서 제외하였다.
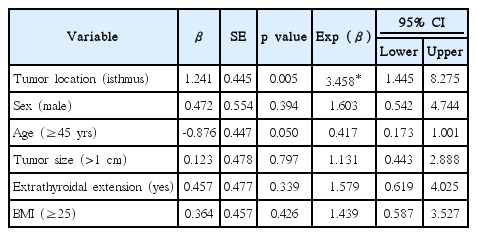
갑상선 협부 유두상암은 초음파 검사 소견을 바탕으로 기관의 외측에 가상의 선을 그려 주요 결절의 중심이 양측 선 안쪽 범위에 위치하는 종양으로 정의하였다. 또한, 갑상선 협부 내에서도 다양한 기준으로 결절 위치를 세분화하여 중심 경부 림프절 전이 유무를 분석하였는데 우선 기관의 중심부를 이은 가상의 선을 그어 협부 결절이 그 가상선을 통과하는지 유무에 따라 각각 중심 협부 종양(median isthmic tumor), 비중심 협부 종양(non-median isthmic tumor)으로 분류하였다(Fig. 1A and B). 이어 기관 중심부와 결절 사이의 거리에 따른 전이 유무를 알아보기 위해 결절 중심과 기관의 중심선 사이의 거리(Fig. 1C and D; 기준 1) 및 기관의 중심선과 수직으로 가장 가까운 결절의 변연부까지의 거리(Fig. 1E and F; 기준 2)를 측정하였다. 결절 중심과 기관 중심선 사이의 거리는 기관 중심선을 기준으로 양측으로 멀어질수록 양의 값을 가지는 것으로 하였고, 기관 중심선과 수직으로 가장 가까운 결절 변연부 사이의 거리는 결절이 중심선을 포함하지 않으면 음의 값을, 중심선을 포함하면 양의 값을 가지는 것으로 하였다. 종양의 방향은 중심 협부 종양인 경우, 결절의 중심이 위치한 방향으로 결정하였다.
Ultrasonographic axial view showing the location of the thyroid nodule. The margin of the nodule and the tracheal midline is marked with an asterisk and broken line, respectively. Median isthmic tumor. The nodule is beyond the tracheal midline (A). Non-median isthmic tumor. The nodule is located in thyroid isthmus but is not beyond the tracheal midline (B). The double arrow indicates the distance between the center of the nodule (full line) and the tracheal midline (criteria 1) (C and D). The double arrow indicates the distance to the nearest margin of the nodule (full line) on tracheal midline (criteria 2) (E and D). It has a negative value (E) and positive value (F) on the basis of the tracheal midline.
통계적 분석 방법으로는 범주형 자료(categorical data)는 빈도(frequency)와 백분율(percentage)을 이용하였고, 연속형 자료(numeric data)는 평균(mean)±표준편차(standard deviation)를 이용하여 요약하였다. 그룹 간 차이를 분석하기 위해 범주형 자료의 비교는 카이제곱 검정(chi-squared test) 및 Fisher 정확검정(Fisher’s exact test)을, 연속형 자료의 비교는 독립 t 검정(independent t-test)을 이용하였다. 중심 경부 림프절 전이와 관련된 인자의 오즈비(odds ratio) 산출을 위해 다중 로지스틱 회귀분석(multiple logistic regression analysis)을 이용하여 분석하고 receiver operating characteristic(ROC) 커브 분석을 통해 중심 경부 림프절 전이 예측인자의 cut-off값을 도출하였다. 통계 분석은 컴퓨터 통계분석 프로그램(SPSS version 21.0; IBM Corp., Armonk, NY, USA)을 이용하였으며, p값은 0.05 미만인 경우를 통계적으로 유의하다고 정의하였다. Cut-off 값을 구하기 위한 ROC 커브 분석은 MedCalc(version 16.8; MedCalc, Ostend, Belgium)을 이용하였다.
결 과
임상병리학적 특징
협부 및 비협부 환자군에 대한 임상적, 병리적 특징은 Table 1에 기술하였다. 환자의 성별, 나이, 종양크기, 갑상선 외 침윤 유무, TNM 병기, 신체질량지수에서 두 군 간 차이는 보이지 않았다. 절제한 림프절 개수 및 전이된 림프절 개수에서도 차이는 없었다. 갑상선 외 침윤 소견은 협부 유두상암의 60.4% (29 case)에서 존재한 반면 비협부 유두상암에서는 45.4%(64 case)에서 존재하였으나 통계적으로 의미는 없었다(p=0.072).
협부군과 비협부군의 중심 경부 림프절 전이 비율은 의미있는 차이는 없었다(72.9% vs. 83.0%; p=0.129). 림프절 전이양상을 세분화하여 살펴보았을 때(Table 2), 동측 기관주위림프절(ipsilateral paratracheal lymph node) 전이에서 두 군간 차이는 없었다(66.7% vs. 80.1%; p=0.056). 양측 기관주위림프절(bilateral paratracheal lymph node) 전이는 협부 29.2%, 비협부 9.9%로 의미 있는 차이를 보였으며(p=0.001), 반대측 기관주위 림프절(contralateral paratracheal lymph node) 전이의 경우에도 협부(35.4%)에서 비협부(12.8%)보다 전이율이 높았다(p=0.000).
치료적 외측 경부 림프절 청소술은 협부 그룹에서 8.3%(4 case), 비협부 그룹에서는 9.9%(14 case)에서 시행하였다. 외측 림프절 전이율은 두 군 간 차이가 없었으나(6.3% vs. 8.5%; p=0.764), 양측 외측 림프절 전이의 경우는 비협부 유두상암에서 없었으나 협부 유두상암에서는 2 case(4.2%)가 있었다 (p=0.063). 협부암군에서 1 case는 level III에서 수술 전 초음파 검사상 경계성(borderline) 전이 소견이 관찰되어 수술 시에 의심되는 림프절만 선택적으로 절제하여 동결절편검사를 시행하였다. 그 결과 전이가 아닌 것으로 확인되어 추가적인 외측 경부 림프절 청소술은 시행하지 않았다. 비협부 그룹의 1 case에서도 Level IV에 전이가 의심되는 소견이 있었으나 동결절편검사 후 전이가 확인이 되지 않아 추가적인 외측 경부 림프절 청소술은 시행하지 않았다. 또 다른 1 case에서는 외부 병원에서 Level II의 림프절에 대한 세침흡인세포검사상 전이가 확인되어 외측 경부 림프절 절제술을 시행하였으나 최종 병리조직검사에서 전이가 없음이 확인되었다.
양측 중심 경부 림프절 전이
단변량 분석에 따르면 양측 중심 경부 림프절 전이는 협부에 위치한 결절(p=0.001), 45세 미만(p=0.033)과 유의한 관련성이 있었으며, 그 외 1 cm 초과 종양크기(p=0.375), 남성(p=0.385), 갑상선 외 침윤(p=0.187) 소견은 통계적으로 의미가 없었다(Table 3). 다중 로지스틱 회귀분석을 시행하였을 때 종양의 위치(isthmus vs. non-isthmus)에 따른 양측 중심 경부 림프절 전이 발생 오즈는 3.458(p=0.005)로 협부에 위치한 결절일 경우에 양측 중심 경부 림프절 전이 발생 오즈가 높은 것으로 나타났다(Table 4).

Univariate analysis of clinicopathological factors associated with bilateral central lymph node metastasis
협부 종양 위치에 따른 비교 분석
갑상선 협부 유두상암 환자 48명만을 대상으로 종양의 위치 외에 중심 경부 림프절 전이에 관여하는 인자에 대한 단변량 및 다변량 분석을 시행하였다. 양측 및 반대측 중심 경부 림프절 전이에는 성별(p=0.400), 나이(p=0.057), 종양크기(p=0.738), 갑상선 외 침윤 유무(p=0.725), 신체질량지수(p=0.954) 모두 통계적으로 유의한 관련성을 보이지 않았다.
협부 종양 내에서도 그 위치를 세분화했을 때 림프절 전이비율에 차이가 있는지에 대한 분석을 시행하였다. 협부 종양의 위치를 기관 중심선과의 거리를 기준으로 ROC 커브 분석을 이용하여 민감도(sensitivity) 및 특이도(specificity)를 종합적으로 고려한 가장 의미가 있는 cut-off 값을 도출하고자 하였다. 우선, 앞서 설명한 기준 1을 이용하여 측정한 거리에서 양측 중심 경부 림프절 전이 여부와 관련된 기준 값은 0.44 cm(p=0.029)였고, 기준 2를 이용하여 측정한 거리로 ROC 커브 분석을 시행하였을 때 그 값은 -0.01 cm(p=0.029)였다(Fig. 2).
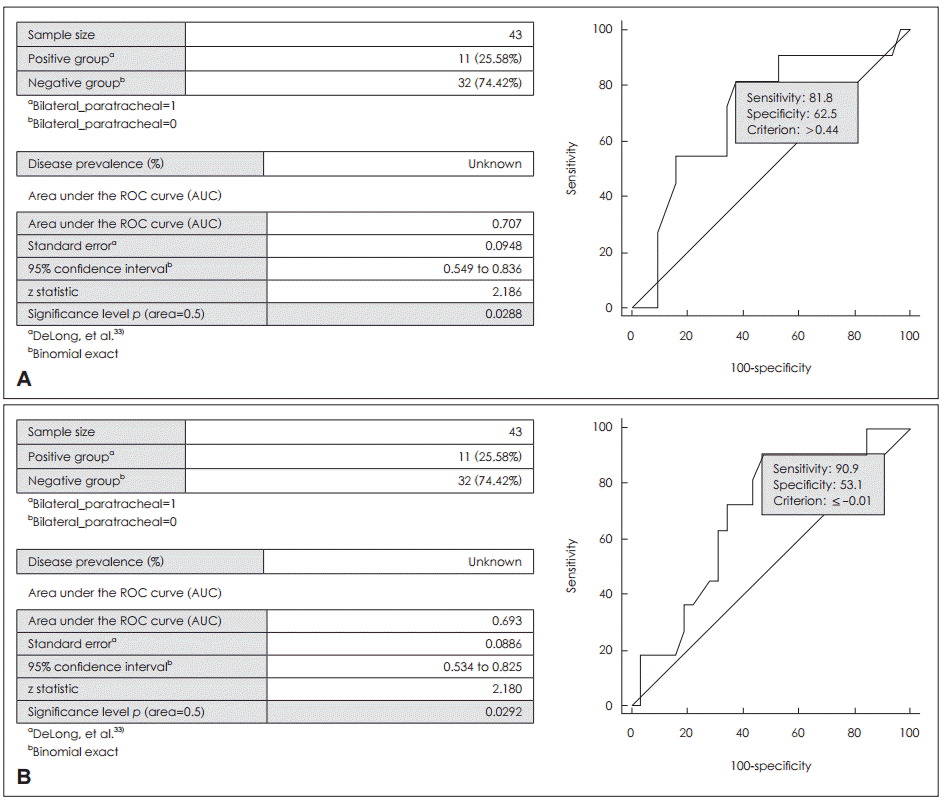
ROC curve analysis to derive the cut-off value related to the bilateral central lymph node metastasis using criteria 1 (A) and criteria 2 (B). ROC: receiver operating characteristic.
협부 종양을 중심 협부 종양과 비중심 협부 종양 두 그룹으로 나누어 양측 중심 경부 림프절 전이 유무를 비교하였고, 또한 앞서 측정한 거리 값을 기준으로도 양측 중심 경부 림프절 전이에 대한 단변량 분석을 시행하였다(Table 5). 양측 중심 경부 림프절 전이가 있는 그룹과 전이가 없는 그룹에서 기준 1에 따른 거리는 각각 0.55±0.23 cm, 0.40±0.27 cm로 의미가 없었으며(p=0.095), 기준 2에 따른 거리는 각각 -0.21±0.27 cm, 0.02±0.35 cm로 역시 의미가 없었다(p=0.053). 하지만 기준 1과 기준 2에서 ROC 커브 분석으로 도출하였던 cutoff 값을 기준으로 두 군으로 나누어 분석했을 때, 기준 1(p=0.011)과 기준 2(p=0.014) 모두 차이가 있었다. 그리고 중심 협부 종양과 비중심 협부 종양으로 나누어 분석한 결과도 양측 중심 경부 림프절 전이 여부에서 의미 있는 차이를 보였다(p=0.008). 중심 협부 종양은 21 case, 비중심 협부 종양은 27 case였으며 두 군 간에는 성별(p=0.959), 나이(p=0.771), 종양크기(p=0.126), 갑상선 외 침범(p=0.683)에서 통계적으로 유의한 차이가 없었다.
고 찰
현재까지 갑상선 분화암의 치료에 대한 전반적인 가이드라인은 다음과 같다. 단일(isolated) 결절로 일측(unilateral)의 갑상선내(intrathyroidal)에 있는 1 cm 이하의 미세암(microcarcinoma)를 가진 45세 미만의 환자에서는 임상적으로 경부 림프절 전이가 의심되지 않는다면 갑상선 엽절제술(lobectomy)로도 충분한 치료 결과를 얻을 수 있다. 반면, 갑상선 전절제술은 15세 미만 혹은 45세 이상의 환자에게서 갑상선암 가족력이 있고 두경부에 방사선 조사력이 있으며, 전이 소견이 보이고 반대측 갑상선 결절이 관찰되고 피막 침범소견이 있는 거대암(macrocarcinoma)인 경우에서 고려할 수 있다[24,25]. 하지만 협부에 위치한 갑상선암에 대한 연구는 현재까지 충분히 논의되지 않았다[17,26].
갑선선암은 협부에서는 비교적 드물게 발견된다. 갑상선 협부는 두개의 외측 엽을 연결하며, 사람의 67~97%까지 발견된다[27-30]. 보통 두 번째에서 네 번째 기관륜의 앞쪽에 위치해 있고 드물게는 첫 번째 및 여섯 번째 기관륜까지 발견된다. 크기는 나이 및 성별에 따라 차이가 있으며, 여러 논문에 의하면 갑상선 협부의 길이는 11~20 mm, 너비는 10.5~20 mm이며, 두께는 2~6 mm로 보고하고 있다[31,32]. 갑상선 협부는 피대근, 근막 및 피부와 인접하고 있어 다른 부위보다 갑상선유두상암 국소 침범의 가능성이 더 높은 것으로 알려져 있다[19,21-23]. Lee 등[19]은 협부에 위치한 갑상선암 그룹이 비협부갑상선암 그룹에 비해 피막침윤(capsular invasion) 및 다발성(multifocality) 비율이 더 높기 때문에 협부에 위치한 갑상선 유두상암의 수술적 치료 시 갑상선 엽절제술 또는 협부절제술(isthmectomy)보다는 갑상선 전절제술을 더 고려해야 한다고 하였다(capsular invasion, 70.2% vs. 60.8%; p=0.008; multifocality, 48.6% vs. 39.8%; p=0.006). 또한, Goldfarb등20)은 협부 갑상선암이 전체 그룹과 비교하여 높은 비율로 다발성(p=0.08), 피막침윤(p=0.09), 림프절 전이(p=0.09) 소견을 보였으며, 따라서 협부 갑상선 유두상암의 수술 시 갑상선 전절제술 및 중심 경부 림프절 청소술이 필요하다고 하였다. 하지만 이들 연구에서는 모두 중심 경부 림프절 청소술의 범위에 대한 합의는 이루어지지 않았다. 특히 대상 환자군이 갑상선 전절제술 및 일측 중심 경부 림프절 청소술을 시행받아 양측 중심 경부 림프절 전이에 대한 평가가 빠져 있다.
갑상선의 림프절은 혈관과 평행하게 주행하며, 아래쪽으로는 기관주위 림프절, 기관전 림프절, 쇄골상 림프절로 빠져나간다. 갑상선 유두상암의 경우 전이는 중심 경부 림프절로 이루어지는 경우가 많으며 그중 기관주위 림프절로의 전이가 가장 흔하다고 보고되었다[1]. 림프절 전이는 또 다른 림프절 전이의 위험인자로 알려져 있으며[2], 따라서 갑상선 유두상암에 있어 림프절 전이 양상에 대한 연구와 수술 시 림프절 청소술의 범위에 대한 논의가 필요하다. Song 등[14]은 반대측 기관주위 림프절을 포함한 양측 중심 경부 림프절 청소술을 시행한 환자만을 대상으로 한 연구에서 협부 갑상선 유두상암의 중심 경부 림프절 전이율은 71.1%로 비협부암보다 확연히 더 높았다고 하였다(40.3%, p<0.001). 또한, 일측과 양측 중심림프절 모두에서 조직학적 전이의 비율은 비협부 갑상선 유두상암에서보다 협부에서 더 높았다. 양측 중심 림프절 전이는 협부 종양의 중앙 위치 때문인 것으로 보여지며, 이것이 양측 중심 경부 림프절로 퍼질 수 있도록 하므로 협부에 위치한 갑상선암의 수술적 치료 시 양측 중심 경부 림프절 청소술을 해야 하는 근거로 제시하였다.
본 연구에서의 협부 갑상선 유두상의 중심 경부 림프절 전이 비율은 72.9%로 이전 연구와 비슷한 양상을 보였다. 하지만 비협부 갑상선 유두상암의 중심 경부 림프절 전이 비율은 83.0%로 협부에 위치한 그룹과 차이가 없었으며(p=0.129), 타 연구의 비협부 갑상선암 림프절 전이보다 높은 결과를 보였다. 이것은 본 연구의 대조군이 갑상선 전절제술 및 양측 중심 경부 림프절 청소술을 시행한 환자군만을 대상으로 시행하였으며, 본원에서 일측 혹은 양측 중심 경부 림프절 청소술의 범위를 결정할 때 수술 시 동측의 기관주위 림프절을 제거 후 동결절편검사를 통하여 림프절 전이가 확인된 경우에 반대측의 기관주위 림프절을 추가로 제거한 경우가 많았기 때문으로 생각된다. 따라서 기존에 알려진 일반적인 유두상암의 림프절 전이 비율보다 본 연구에서 림프절 전이 비율이 더 높게 나온 것으로 볼 수 있고 이것은 표본선택편의(selection bias)로 발생한 제한점이라고 할 수 있다. 하지만 이처럼 본 연구에서 협부 및 비협부 갑상선 유두상암 그룹에서 중심 경부 림프절 전이 비율이 비슷한 양상을 보였더라도 양측 림프절 전이 비율은 협부 그룹에서 통계적으로 유의하게 높은 결과를 보였다(29.2% vs. 9.9%; p=0.001). 다중 로지스틱 회귀분석을 통하여 다른 인자의 편향 가능성을 배제한 후에도 협부 위치는 중심 림프절 전이에 독립적인 위험인자인 것으로 나타났다(OR=3.458; p=0.005).
하지만 양측 경부 림프절 청소술의 일상적인 시행은 합병증 발생률의 상승을 동반할 수 있다. 협부에 위치한 갑상선암에서 위치 외 중심 경부 림프절 전이에 영향을 주는 다른 요인이 있다면 모든 협부 갑상선 유두상암 치료에서 양측 경부 림프절 청소술을 시행할 필요는 없을 것이고 불필요한 합병증 상승을 피할 수 있을 것이다. 따라서 본 연구에서는 협부에 위치한 갑상선암 그룹 내에서 성별, 나이, 종양크기, 갑상선 외침윤, 신체질량지수, 그리고 다발성에서 양측 중심 경부 림프절 전이와 통계적으로 유의한 관계가 있는지에 대한 평가를 시행하였다. 그 결과는 종양의 위치를 제외하고 통계적으로 유의한 다른 요인은 없었으며 종양이 협부에 위치한 것 자체가 강력한 독립 인자가 되었다.
또한 종양의 위치가 중심 경부 림프절 전이에 관련된 인자라면 그 위치 안에서 다시 림프절 전이에 영향을 주는 기준은 무엇인지 알아보기 위해 몇 가지 기준을 설정하였다. 먼저, 기관 중심선과 종양 중심까지의 거리를 기준(기준 1)으로 시행한 ROC 커브 분석에서 구한 cut-off 값은 0.44 cm였으며 이 값으로 나눈 두 군은 단변량 분석에서 의미 있는 차이가 있는 것으로 나타났다(p=0.011). 결절 중심까지의 거리는 결절의 위치에 대한 평가는 할 수 있지만 결절 크기에 따른 중앙선 침범 유무는 반영이 되지 않기 때문에 기관 중심선과 가장 가까운 결절 변연부까지의 거리도 측정해 보았는데(기준 2), cut-off 값은 -0.01로 이 역시 의미 있는 차이를 보였다(p=0.014). 마지막으로 중심 협부 종양과 비중심 협부 종양으로 나누어 분석한 결과도 의미 있는 차이를 보였다. 특히, 기준 2로 얻은 값은 기관의 중심선과 일치하여 같은 환자군을 포함하였다. 하지만 기관의 중심부와 가깝거나 더 나아가 중심부를 지나쳐 반대편 엽으로 침범되어 있는 결절일수록 양측 중심 경부 림프절 전이가 잘 일어날 것이라는 우리의 예상과는 반대로 기관 중심선과 결절 중심부위까지의 거리가 0.44 cm이상인 경우, 그리고 비중심 협부 종양인 경우에서 양측 중심 경부 림프절 전이율이 더 높았다. 비록 통계적으로 의미있는 결과를 보였다고 하더라도 본 연구에 포함된 협부 유두상암 환자는 총 48명으로 향후 충분한 수의 환자군을 대상으로 추가적인 연구가 진행되어야 할 것으로 생각된다.
우리는 임상적으로 협부 갑상선 유두상암이 의심될 경우 조직학적으로 양측 중심 경부 림프절 전이율이 높기 때문에 완전한 양측 중심 경부 림프절 청소술을 시행할 것을 제안한다. 협부 내에서의 위치에 따른 전이 유무의 차이는 본 연구에서는 명확히 설명할 수 있는 근거를 밝히지 못했다. 협부에 종양이 위치할 경우 후두전 림프절, 기관전 림프절 및 기관주위 림프절로의 전이에 강력한 위험인자가 되며, 림프절 전이는 또 다른 림프절 전이로의 가능성을 높이고 양측 림프절에서의 전이가 빈번하게 관찰되는 점은 수술적 치료를 고려할때 양측 중심 경부 림프절 청소술을 고려해야 하는 근거가 된다. 비록 현재 예방적 중심 경부 청소술에 대해서는 논란이 있으며 본 연구가 장기간 추적 결과를 보여주지는 못했지만 중심 경부 림프절에서 수술 전 전이 소견이 없었던 협부 갑상선암 38 case 중 28 case(73.7%)에서 최종 조직검사 결과상 전이가 확인이 되었다는 점에서 예방적 중심 경부 청소술은 고려되어야 한다. 협부 갑상선 유두상암에서 예방적 중심 경부 청소술의 정확한 역할을 확립하기 위해서는 장기간 추적관찰이 필요할 것으로 생각된다.
협부와 비협부에서 외측 림프절 전이 비율은 비슷하였다(6.3% vs. 8.5%; p=0.764). 협부 갑상선 유두상암에서의 외측 림프절 전이 비율은 다른 문헌에서와 유사하였다[19]. 외측 경부 절제술은 영상검사 및 세침흡인세포검사로 확인된 상태에서 비협부 갑상선 종양에서와 같은 전략으로 시행할 수 있었다.
이번 연구의 한계는 후향적인 연구라는 점, 무작위 표본검출이 아니라는 점, 장기추적검사 자료가 없다는 점이다. 앞으로 장기추적관찰을 포함한 무작위 대조군 연구가 필요하다. 또한 협부 내에서 림프절 전이에 관련된 다른 인자를 찾고 협부 종양 위치의 세부적인 기준점에 대한 연구도 좀 더 진행되어야 할 것이다.