안면신경 손상 후 안면신경 원위부에서 톨 유사 수용체(Toll-Like Receptor) Messenger Ribonucleic Acid의 발현 양상
Expression of Toll-Like Receptor Messenger Ribonucleic Acid in the Distal Facial Nerve After Facial Nerve Injury
Article information
Trans Abstract
Background and Objectives
This study aimed to evaluate whether Toll-like receptors (TLRs) messenger ribonucleic acid (mRNA) were expressed in the facial nerve after incurring a crush or an injury of the facial nerve.
Materials and Method
An adult Sprague-Dawley underwent a crush or injury of the unilateral facial nerve. The crush or injury was incurred by a cutting at the midpoint between the facial nerve trunk and its branch. The whisker movement of vibrissae muscle was examined 4 and 14 days after injury. Real-time polymerase chain reaction was performed for the normal facial nerve taken from the left side and the damaged nerve taken from the right side.
Results
On the 4th day of injury, the expression of TLR 9, 13 mRNA was significantly lower in the crush and injured groups than in the control group (p;<0.05). On the 14th day of injury, the expression of TLR 2 mRNA was significantly higher in the injured group than in the control group (p;<0.05).
Conclusion
The expressions of TLR 9, 13 mRNA in the distal facial nerve after injury in the crush and injured groups were significantly lower than that in the control group, but the expression of TLR 2 mRNA in the injured group was significantly higher. Therefore, TLRs may be involved in facial nerve damage and regeneration.
서 론
동물에서 발견되는 유형 인식 수용체(pattern recognition receptors, PRRs)는 톨 유사 수용체(Toll-like receptors, TLRs), nucleotide-binding and oligomerization domain (NOD) 유사 수용체(NOD-like receptors, NLRs), retinoic acid-inducible gene (RIG)-1 유사 수용체(RIG-1 like receptors, RLRs), C-형 렉틴 수용체(C-type lectin receptors, CLRs)의 4가지가 대표적이다[1,2]. 최근 들어 선천성 면역반응과 관련되어 다양한 질환에서 PRRs의 역할에 대한 연구가 활발히 진행 중에 있는데 특히 TLRs에 대해 많은 연구가 진행 중에 있다.
TLRs는 노랑초파리(Drosophila melanogaster)의 발생과정에서 배아의 등배극성(dorsal-ventral embryonic polarity)에 관여하는 수용체로 처음 발견되었다. 사람에게는 10종, 쥐(mouse)에는 13종이 있다. TLRs는 박테리아, 바이러스, 진균 및 원생동물을 감지하여 선천성 면역반응을 일으키는데, 각각의 TLRs는 존재하는 부위에 따라 서로 다른 병원체 연관 분자유형(pathogen-associated molecular patterns, PAMPs)을 인식한다. TLRs에 결핍이 발생하면 이러한 병원체를 인식하지 못해 다양한 감염성 면역질환이 유도되고, 비정상적인 TLRs 반응은 중이염, 천식, 동맥경화증, 자가면역질환, 면역 결핍, 패혈증 등의 질병과도 관련이 있다[3-5].
TLRs는 주로 B 세포, T 세포, 대식세포(macrophage) 등과 같은 면역세포에 존재하여 선천성 면역반응의 신호전달과정을 활성화하는 역할을 하지만 면역세포가 아닌 상피세포, 혈관 내피 세포에서도 발현되며, 특히 최근에는 중추신경계의 미세아교세포(microglia), 성상세포(astrocyte), 뉴런(neuron) 등에서의 발현도 보고되고 있다. 신경계의 TLRs는 병원체 연관 분자유형(PAMPs)뿐만 아니라 신경 손상 후 생성되는 내인성 손상 연관 분자유형(damage-associated molecular patterns, DAMPs)이나 알츠하이머병(Alzheimer’s disease)의 아밀로이드 베타(amyloid beta) 같은 단백질에 의해서도 활성화되어 신경의 손상과 재생 과정에 관련된 신호 전달 과정에 관여하게 된다[6,7]. 특히 TLR 4는 중추신경과 말초신경에서 신경 손상 시에 신경전구세포(neuronal progenitor cell)의 증식을 억제하고, 신경변성(neurodegeneration)을 촉진하는 역할을 한다는 것이 여러 연구에서 보고되었다[6,8].
말초신경에 발생하는 질환인 안면마비는 생명을 위협하는 질환은 아니지만, 회복이 불완전할 경우 심리적, 정서적, 그리고 사회적으로 삶의 질을 많이 떨어뜨려 환자의 사회활동에 매우 영향을 미칠 수 있는 질환이므로 무엇보다 완치가 중요하다[9,10]. 다양한 원인의 안면마비 환자들에서 완치를 위해 여러 연구를 진행하고 있지만 아직까지 안면마비에 특이적인 바이오마커(biomarker)가 없고, 안면신경 재생에 영향을 주는 생물학적 인자들에 대한 연구도 다른 분야에 비해서는 지지 부진한 상태이다. 이에 본 연구는 안면신경의 손상 및 재생에 관여하는 생물학적 인자들을 탐구하고자, 안면마비 동물모델을 구현하여 안면신경 손상 후 손상 원위부에서 TLRs의 messenger ribonucleic acid (mRNA)의 발현양상을 알아보고자 하였다.
재료 및 방법
대 상
체중 200-250 g 내외의 성숙한 수컷 Sprague-Dawley (S-D)를 압박군 10마리, 절단군 9마리, 총 19마리를 1주간의 검역과 적응기간을 거친 후 실험동물 관리 지침에 따라 사육하였다. 대조군은 손상된 반대쪽 정상 안면신경으로 실험하였다.
과 정
모든 실험동물들은 80% 산소에 혼합된 5% isoflurane (Forane solution; Choongwae Pharma, Seoul, Korea)을 이용하여 흡입마취를 유도하고 2% isoflurane (Choongwae Pharma, Seoul, Korea)으로 마취를 유지하였다. 흡입 마취된 S-D rat의 우측 머리 부분에 후이개 절개(post-auricular incision)를 가하여 유양돌기부(mastoid process)와 이하선(parotid gland)을 확인 후, 안면신경 체간(facial nerve trunk)과 5개의 분지(temporal, zygomatic, buccal, mandibular, cervical branch)를 노출시켰다. Zeiss microscope (Carl Zeiss, Jena, Germany)하 경유돌공(stylomastoid foramen)에서 안면신경 체간이 나오는 부위와 안면신경이 분지하는 부위의 중간 지점에 손상을 주었다. 압박군은 견인(traction) 등에 의한 손상 가능성을 줄이고 신경의 끊어짐을 방지하기 위해, 안면신경을 jeweler’s forcep으로 잡고 다른 forcep으로 안면신경을 잡고 있는 jeweler’s forcep을 누르는 간접적 방식으로 30초간 압박하였으며, 절단군은 scissors로 완전 절단한 후 상처부위를 봉합하여 마취에서 회복시켰다(Fig. 1). 안면신경의 기능은 콧수염의 운동(whisker movement of vibrissae muscle)을 검사하는 방법을 이용하여 평가하였다(Table 1). 콧수염의 움직임을 비디오로 촬영하여 실험에 가담하지 않은 2명의 사람에게 움직임의 정도를 평가하여 점수를 기록하게 한 후 평균을 측정하였다. 평가 기준은 수염의 움직임이 전혀 없으면 1, 수염의 하방에서 요동이 있어서 수염 모낭으로부터의 움직임으로 해석되는 경우는 2, 전체 길이에 걸쳐서 일부 수염이 움직이면 3, 모든 수염이 움직이면 4, 손상시키지 않은 반대쪽과 완전 동일하게 움직일 경우 5로 기록하였다[11,12]. 왈러변성(Wallerian degeneration)이 진행되는 손상 후 4일째와 신경 재생이 진행되는 14일째에 각각 콧수염의 운동을 검사하였고, 흡입마취 상태에서 좌측의 정상 안면신경과 우측의 손상된 안면신경을 채취하여 TLR 1-13에 대해 실시간 중합효소 연쇄반응(real-time polymerase chain reaction [PCR])을 시행하였다[13]. 본 연구에서 시행된 모든 실험은 본원 임상 시험 심사 위원회의 승인을 받아 시행하였다(KHMC-IACUC 21-005).
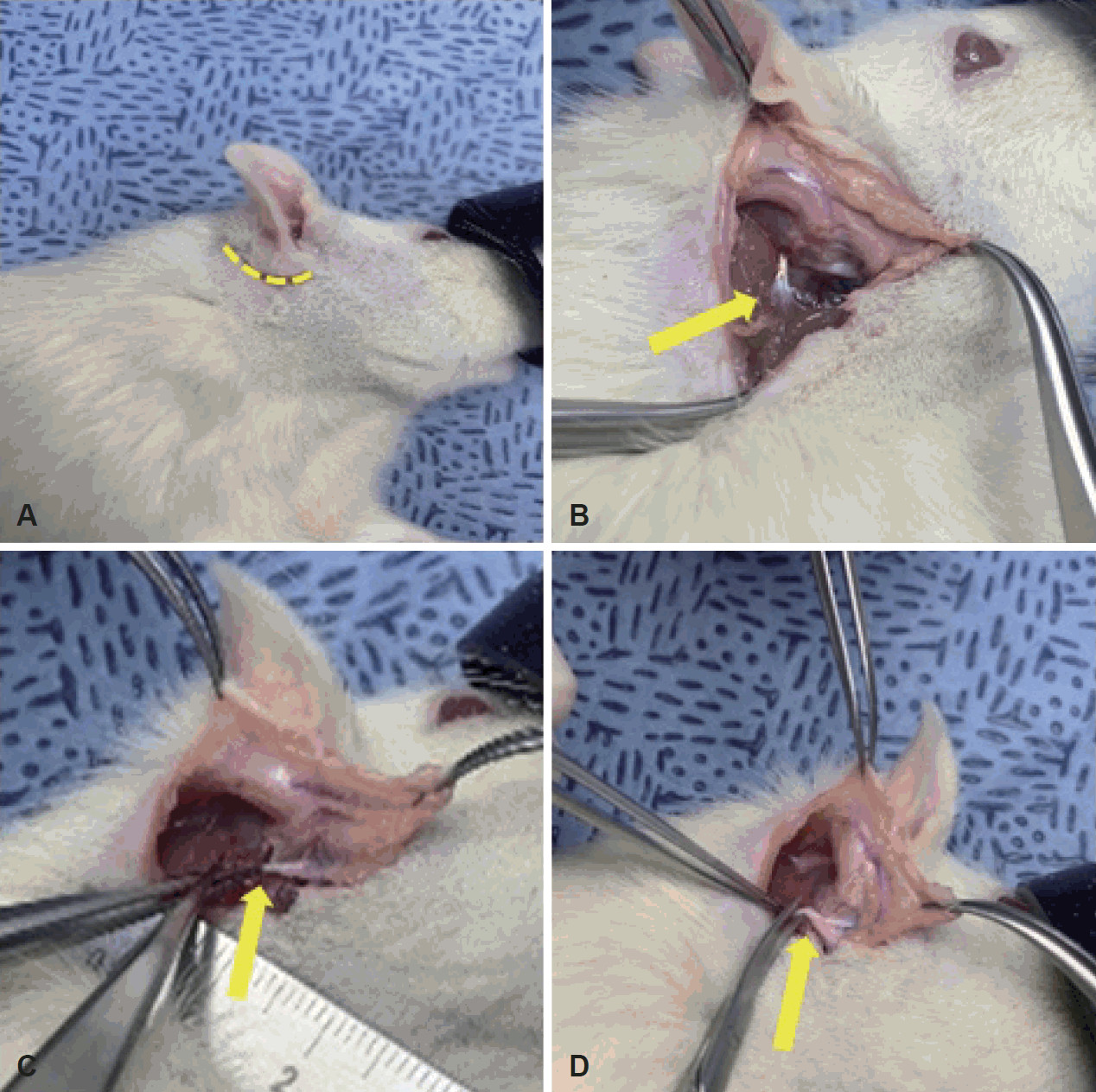
Induction of facial nerve injury. A: Retroauricular incision in the skin and subcutaneous tissue (dotted line). B: Tendon border of the clavotrapezius muscle (arrow). C: Crush injury (arrow). D: Cutting injury (arrow).
RNA 추출과 실시간 중합효소 연쇄반응(real-time PCR)
채취된 안면신경으로부터 모든 RNA를 추출하기 위해, 제조사의 프로토콜에 따라 TRIzol solution (Invitrogen, Carlsbad, CA, USA)을 사용하였다. 추출한 RNA의 1 μg을 random hexamers (Promega, Madison, WI, USA)와 역전사 시스템을 이용하여 cDNA로 전사시켰다. 사용한 primer의 염기서열은 Table 2에 표기하였다. Real-time PCR은 StepOnePlus Real-Time PCR System과 Power SYBR Green PCR Master Mix (Applied Biosystems, Foster City, CA, USA)로 시행하였다. 2 μL의 cDNA, 10 μL의 Power SYBR Green PCR Master Mix, 2 μL의 primers, 그리고 7 μL의 PCR-grade water로 구성된 20 μL의 반응 혼합물로 PCR을 시행하였다. 이 혼합물을 95°C에서 10분간 변성시켰으며, 95°C에서 15초 후 60°C에서 1분을 1 cycle로 하여 40 cycle을 시행하여 증폭하였다. 각 TLRs의 검출량은 β-actin과 표적 유전자의 교차점을 2-(target gene-β-actin)라는 공식을 사용하여 계산하였다.
통계 분석
모든 실험결과는 평균과 표준오차를 산출하고 그룹 간 평균 비교는 one-way analysis of variance로 분석한 후 scheffe 검정법으로 사후 검증하였으며, p<0.05를 기준으로 통계적 유의성을 평가하였다. 결과치는 평균±표준오차(standard error)로 표기하였다.
결 과
콧수염의 운동(whisker movement of vibrissae muscle) 검사
안면신경 손상 후 4일째에는 대조군의 점수가 5인 반면 압박군에서는 2.60±0.89, 절단군에서는 1.80±0.45로 절단군에서 가장 나쁜 결과를 보였다. 안면신경 손상 후 14일째에도 대조군의 평균 점수는 5인 반면 압박군에서는 1.60±0.55, 절단군에서는 1.25±0.50로 절단군에서 가장 나쁜 결과를 보였고, 압박군과 절단군은 각 군의 4일째 점수에 비해 14일 째에 더 나쁜 점수를 보였다(p<0.05)(Fig. 2).
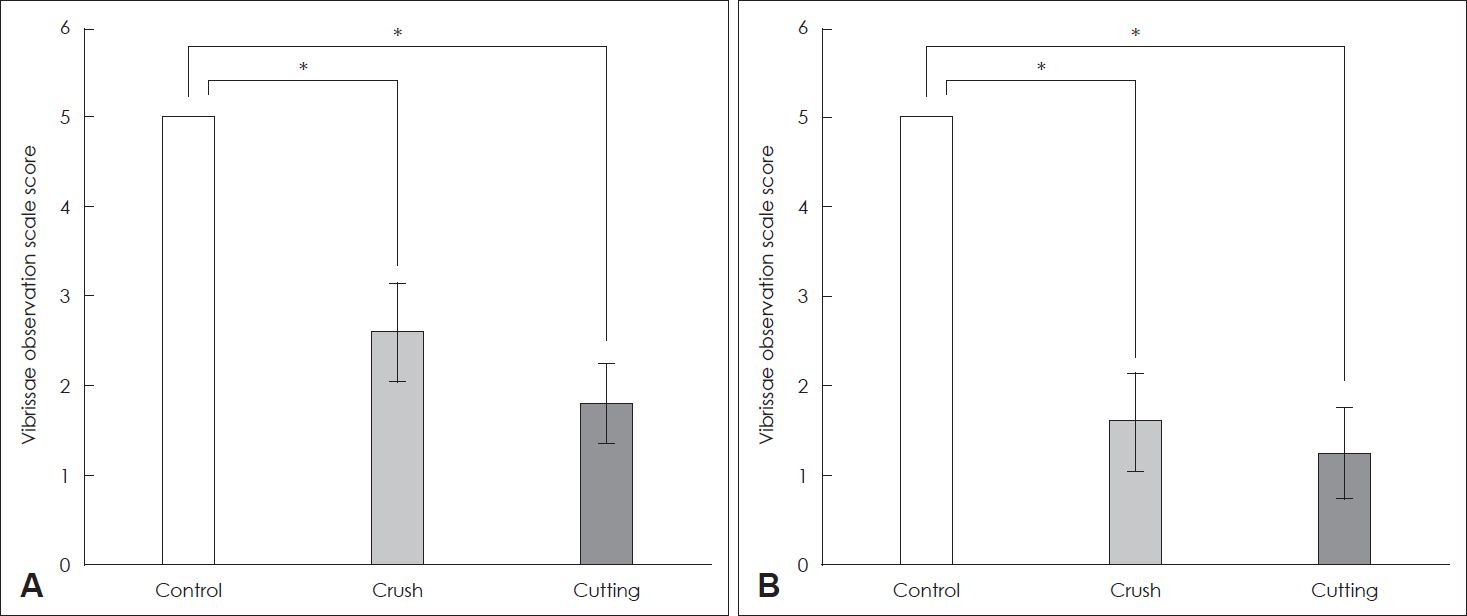
Comparison of behavioral test scores in rats. A: Whisker movement of vibrissae muscle in the control, crush, and cutting group on the 4th day after facial nerve injury. B: Whisker movement of vibrissae muscle in the control, crush, and cutting group on the 14th day after facial nerve injury. *p<0.05.
TLR 1~13 mRNA의 발현 양상
손상 4일째, 압박군과 절단군에서 TLR 2, 6, 7 mRNA의 발현이 대조군에 비해 더 많았다. 손상 14일째, 대조군에 비해 압박군에서는 TLR 2, 6, 7 mRNA의 발현이 많았으나 통계적으로 유의한 차이를 보이지는 않았고, 절단군에서는 TLR 1-7, 9, 10 mRNA의 발현이 많았으나 TLR 2 mRNA를 제외하고는 통계적으로 유의한 차이는 없었다(Fig. 3).
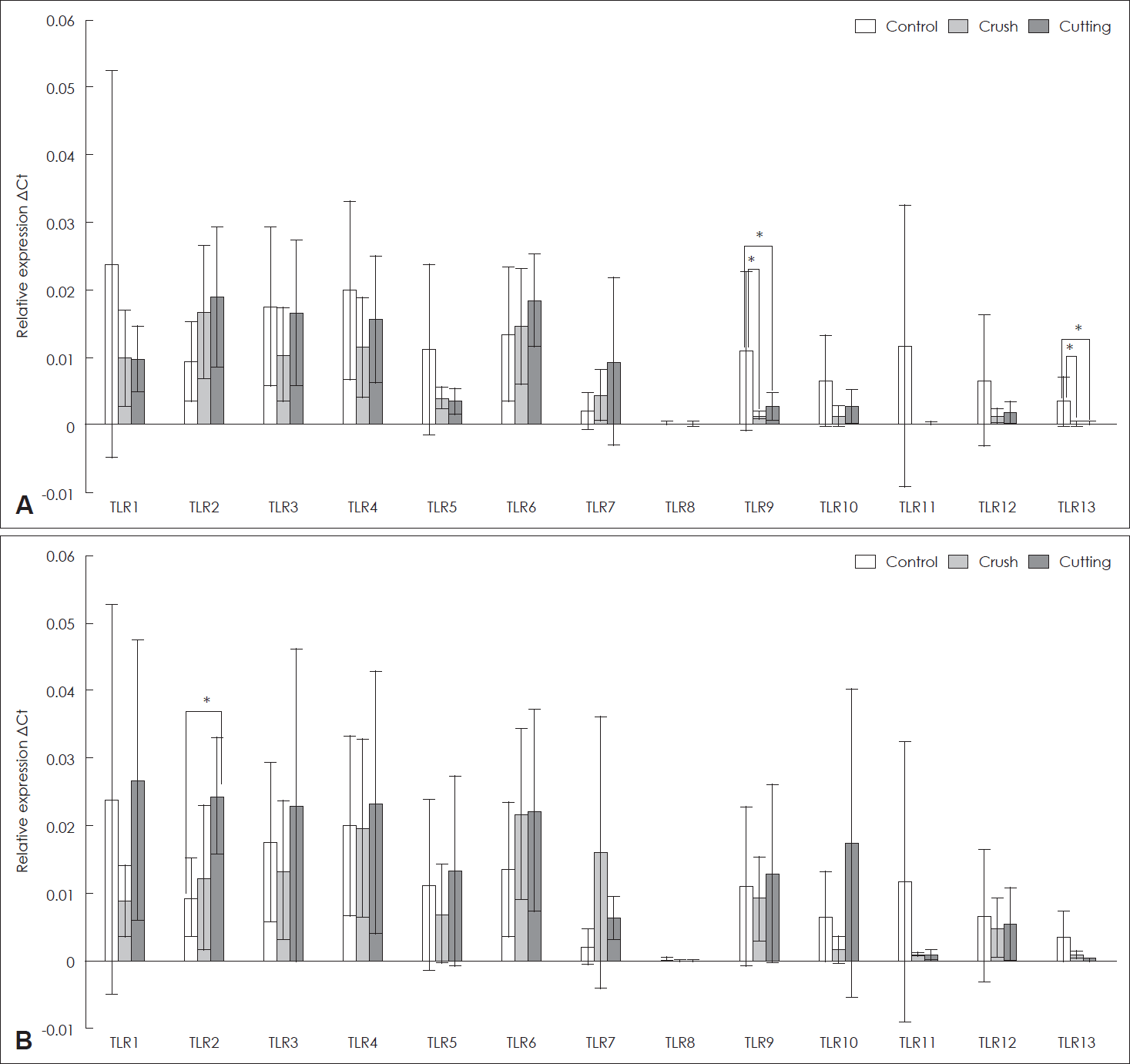
Levels of expression of Toll-like receptors in rat facial nerves. A: Expression of TLR 1–13 mRNA in the control, crush, and cutting group on the 4th day after facial nerve injury. B: Expression of TLR 1–13 mRNA in the control, crush, and cutting group on the 14th day after facial nerve injury. *p<0.05. TLR, Toll-like receptor; mRNA, messenger ribonucleic acid.
손상 4일째, 대조군에 비해 압박군과 절단군에서 TLR 9, 13 mRNA의 발현이 유의하게 적었다(p<0.05). 손상 14일째는 대조군에 비해 절단군에서 TLR 2 mRNA의 발현만 통계적으로 유의하게 높았다(p<0.05) (Fig. 3).
고 찰
신경이 절단되면 손상된 신경의 원위부에서 왈러변성이라는 변화가 시작된다. 왈러변성에는 대식세포(macrophage)와 슈반세포(schwann cell)가 중요한 역할을 하며, 손상된 신경의 원위부에서 수초(myelin)를 분해하고 탐식작용(phagocytosis)으로 제거한다. 또한 슈반세포가 c-Jun, Notch, Sox-2 등의 음성 전사 조절자(negative transcriptional regulator)에 의해 탈분화(dedifferentiation)되면서 결과적으로 신경 재생 과정이 일어난다[14-16]. 신경이 손상된 후 축삭(axon) 퇴화로 인한 부산물인 내인성 손상 연관 분자유형(DAMPs)이 생성되면 슈반세포에서 TLR 2-4, myeloid differentiation primary response 88 등이 활성화되며 이들은 Tumor necrosis factor-α, interleukin-1 (IL-1), monocyte chemoattractant protein-1 (MCP-1)을 활성화시킨다. MCP-1은 다시 phospholipase A2 (PLA2)를 자극하고, PLA2에 의해 lysophosphatidylcholine (LPC)가 자극되어 슈반세포가 미엘린(myelin)을 직접 분해한다. 또한 LPC는 macrophage inflammatory protein-1α (MIP-1α)을 발현시키는데, MIP-1α에 의해 IL-1β가 말초신경의 슈반세포에서 손상 3일 이내에 분비된다. 이후 신경손상 3-7일에 말초신경의 슈반세포에서 분비된 IL-1β, MCP-1, MIP-1α에 의해 대식세포가 활성화되어 미엘린을 탐식작용으로 제거한다[17-19].
기존에 알려진 신경 손상 시 발생하는 슈반세포의 신호전달경로에는 TLR 2-4가 관련이 된 것으로 알려져 있지만, 손상 후 슈반세포에서 TLRs 1-9 mRNA가 대부분 발현이 증가한다는 보고도 있다. 손상 전에는 TLR 3, 4, 7 mRNA가 높게 발현되고, 손상 후에는 TLR 1 mRNA가 특히 높게 발현되는데 이를 통해 TLR 3, 4, 7은 평상시에 면역 감시(immune surveillance)에 중요한 역할을 하고, TLR 1은 신경 손상과 같은 스트레스 상태에서 중요한 역할을 할 것으로 추정된다[20]. 본 연구에서는 TLR 1-13 mRNA를 모두 분석하였지만 안면신경을 채취 후 슈반세포나 운동뉴런 등 세포 단위로 나눠서 분석하지는 못하였다. 하지만 앞선 연구와 유사하게 신경손상 후 모든 TLR mRNA가 발현이 되었다. 특히 압박 손상의 경우 TLR 1, 3-5, 8-13 mRNA는 감소하였고, TLR 2, 6, 7 mRNA는 증가하였다. 절단 손상의 경우 TLR 8, 11-13 mRNA는 감소하였고, TLR 1, 3-5, 9, 10 mRNA가 4일째 감소하였다가 14일째 증가하였고, TLR 2, 6, 7 mRNA는 증가하였다. 압박 손상과 절단 손상은 공통적으로 TLR 8, 11-13 mRNA가 감소하였고, TLR 2, 6, 7 mRNA는 증가하였다. 즉, 안면신경 손상 후 TLRs mRNA는 모두 발현이 되었지만 안면신경의 손상 방법과 손상 후 시기에 따라 서로 다른 TLRs가 증가하거나 감소함을 알 수 있었다.
안면신경 손상 방법에 따라 발현되는 TLR의 종류가 다른 것은 손상 후 조직학적 변화의 차이가 원인으로 생각된다. Rat의 좌골신경(sciatic nerve)을 이용한 연구에서 보고된 바에 따르면 손상 방법과 손상 후 시기에 따라 원위부 신경의 조직학적 특성에 차이가 생기는데 압박 손상의 경우 손상 후 시간이 지나면서 재생되는 신경이 관찰되지만, 절단 손상의 경우는 손상 원위부에서 완전히 퇴화된 신경만이 관찰된다[21]. 우리 연구에서 TLR 2는 압박과 절단 손상 모두에서 4일, 14일째에 발현이 증가하지만 특히 절단 손상 14일째에 통계적으로 유의하게 증가하는 결과를 보였다. 이를 통해 TLR 2가 신경 퇴화 과정에 관여하는 것으로 생각해볼 수 있다. TLR 2, 4 mRNA는 mouse의 뇌 허혈손상(ischemia) 후 대뇌 피질의 뉴런에서 발현이 증가하는데, TLR 2, 4 knock-out mouse에서는 허혈손상 후 나타나는 신경학적 손상이 감소하여, 이를 통해 TLR 2와 4가 중추신경계의 뉴런에서 proapoptotic signialing pathway에 관여하고 있음이 간접적으로 증명되었던 바 있다. 말초신경인 sciatic nerve를 이용한 연구에서도 TLR 2 knock-out, TLR 4 mutant mice가 야생형(wild type)보다 신경 손상 후 더 높은 운동 기능의 회복을 보였고, 근위부 신경 말단에서 더 많은 싹(nerve terminal sprout)이 자라나는 결과를 보였다[22,23].
TLR 9, 13는 신경 손상 4일째에는 압박군과 절단군 모두에서 대조군에 비해 유의하게 감소해있지만, 14일째에는 4일째에 비해서는 증가하는 양상을 보인다. 인간의 다발성 경화증(multiple sclerosis)과 유사한 동물 모델인 자기면역성 뇌척수염(experimental autoimmune encephalomyelitis) 쥐 모델에서 식물성 화학물질인 제니스타인(genistein)을 투여하였을 때 탈수초화(demyelination)가 감소하는데, 이때 척수신경에서 TLR 3와 TLR 9가 증가한다. 제니스타인에 의해 활성화된 TLR 3, 9가 탈수초화를 억제하는 역할을 한 것으로 보인다. 우리 연구에서도 왈러변성이 활발하게 진행되어 탈수초화와 분해된 수초의 탐식 작용이 일어나는 손상 4일째에 TLR 9가 유의하게 감소했다. 또한 다른 연구에서 TLR 9 knock-out mouse는 운동, 감각, 자율 신경의 이상을 보이는데 이는 시냅스(synapse)의 기능과 형태의 변화에 기인한 것으로 이를 통해 TLR 9가 시냅스의 가소성에도 관여한다고 하였다[24,25].
안면신경의 신경 분포는 인간, 설치류 및 토끼목의 포유동물에서 유사하며, 쥐 및 토끼는 종종 인간의 안면신경 기능 및 재생을 연구하기 위한 모델로 사용되어왔다. 특히 콧수염의 운동(whisker movement of vibrissae muscle)은 안면신경의 협부, 하악분지에 의해 지배되는 것으로 알려져 있다. 이전에 시행된 연구들에 따르면 안면신경을 절단한 후에는 동측 콧수염의 운동이 완전히 소실된다. 하지만 우리의 연구에서 안면신경 절단 4일째에는 2.8±0.4, 14일째에는 2.25±0.5로 일부 수염의 움직임이 관찰되었다. 이는 실험실 내의 공기 흐름이나 쥐의 움직임에 의한 수동적인 콧수염의 움직임을 관찰자가 오인하였을 가능성이 있다. 또한 안면신경 손상 후 4, 14일이 경과한 후 측정하였으므로 신경 재생 과정이 진행되며 연합운동(synkinesis)이 발생하여 콧수염의 운동이 나타날 수 있고, 삼차신경의 안와하분지(infraorbinal branch of trigeminal nerve)가 재생 과정에서 비안면신경성 콧수염의 운동에 관여하였을 가능성도 있다[26,27].
본 연구에는 몇 가지 제한점들이 있다. 먼저 TLRs의 단백질 양이 아닌 mRNA의 양을 측정하여 간접적으로 비교하였는데, mRNA로 전사되어도 단백질로 합성되지 않을 가능성이 있기 때문에 실제 합성되어 작용하는 TLRs의 양과는 차이가 있을 수 있다. 두 번째로 정상군, 압박군과 절단군 간에 축삭, 수초, 슈반세포 등의 해부학적 차이점을 비교하지 않았다. 세 번째, 세포 단위에서의 분석이 아니기 때문에 TLR가 어떤 세포에서 발현되어 어떻게 작용하는 지는 알 수 없었다. 네 번째, 손상 후 14일간의 변화만을 보았고 3개월 이상 장기간의 변화를 관찰하지 못했다.
하지만 기존의 연구와는 달리 안면신경을 이용하여 실험하였고, 또한 13종의 모든 TLRs의 발현을 측정하여 비교하였다는 것에 의의가 있으며, 후속 연구에서 western blot으로 실제 합성된 TLRs의 양을 측정하고 3개월 이상의 장기간 추적 관찰을 진행 중에 있다.
결론적으로, 안면신경 손상 후 신경말초부위에서 TLRs mRNA 발현의 변화가 확인되었다. 특히 대조군에 비해 절단군에서 TLR 2 mRNA가 유의하게 발현이 증가하였고, 대조군에 비해 압박군과 절단군에서 TLR 9, 13 mRNA의 발현이 가장 적었다. 따라서 신경손상 후 TLRs mRNA의 발현의 변화가 안면신경의 손상과 재생 과정에 관여하고 있음을 알 수 있다.
Acknowledgements
This study received the excellent research topic of resident award from the Korean society of Otorhinolaryngology-Head and Neck Surgery.
This work was supported by the National Research Foundation of Korea (NRF) grant funded by the Korea government (NRF 2018R1A6A1A03025124). The study protocol was approved by the Kyung Hee University Clinical Research Ethics Committee (KHMC-IACUC 21-005).
Notes
Author Contribution
Conceptualization: Hye Kyu Min, Young Il Kim, Sang Hoon Kim, Seung Geun Yeo. Data curation: Hye Kyu Min, Jae Min Lee. Formal analysis: Jun Yang Jung, Seung Geun Yeo. Funding acquisition: Sang Hoon Kim, Seung Geun Yeo. Investigation: Hye Kyu Min. Methodology: Jun Yang Jung. Project administration: Seung Geun Yeo. Resources: Young Il Kim. Software: Hye Kyu Min. Supervision: Seung Geun Yeo. Validation: Sang Hoon Kim. Visualization: Jae Min Lee. Writing—original draft: Hye Kyu Min. Writing—review & editing: Hye Kyu Min.


