반전성 유두종에 동반된 편평세포암종의 임상적 특성과 치료 결과: 비부비동 편평세포암종과의 비교
Clinical Characteristics and Treatment Outcome of Squamous Cell Carcinoma Associated With Inverted Papilloma: Comparison With Sinonasal de Novo Squamous Cell Carcinoma
Article information
Trans Abstract
Background and Objectives
Squamous cell carcinoma associated with inverted papilloma (IP+SCC) is different histologically and biologically from sinonasal de novo squamous cell carcinoma (dnSCC). However, few studies have compared the characteristics of patients, behaviors of tumor, and treatment outcome of two different forms of SCC.
Subjects and Method
We retrospectively reviewed the medical records of 30 patients with IP+SCC and 39 patients with dnSCC who had been treated at Chungnam National University Hospital from 1989 to 2018. Demographics, clinicopathological characteristics, treatment modalities and outcome were analyzed.
Results
The mean age, sex ratio, and the proportion of smokers were similar in both groups. On the other hand, the presenting symptoms of each group were somewhat different: nasal symptoms were more frequent in the IP+SCC group, whereas facial symptoms were more frequent in the dnSCC group. Patients with dnSCC showed significantly more advanced T stage, poorer differentiation of cancer cells, and more bone destruction. The upfront method of treatment was surgery in both groups, whereas radiotherapy and chemotherapy were more frequently used as an adjuvant or main treatment in the dnSCC group. Patients with IP+SCC demonstrated better 5-year overall survival and disease-free survival than the dnSCC group. In both groups, patients with the lower T stage had better outcome than those with the higher T stage. The presence of nodal or distant metastasis was an independent, poor prognostic factor for survival regardless of the type of tumor.
Conclusion
Although sinonasal IP+SCC and dnSCC are often considered similar diseases, our findings suggest that IP+SCC may represent a less aggressive form of malignancy than dnSCC.
서 론
반전성 유두종은 비부비동에 발생하는 종양의 0.5%-4%를 차지하는 비교적 드문 양성 종양이지만, 높은 재발율, 국소 침습성으로 인한 골파괴나 재형성(remodelling), 그리고 악성 종양과의 연관성으로 인해 치료 시 주의를 요하며 장기간 추적조사가 필요한 질환이다[1,2]. 반전성 유두종에서 악성 종양이 함께 발견되는 빈도는 연구자에 따라 2%-53%로 다양하게 보고되어 왔지만 최근에는 대략 10% 내외로 생각되고 있다[3-5]. 암종의 발생에 대하여 Barnes [6]는 반전성 유두종에서 암종이 발생하였을 가능성과 서로 다른 종양인 양성 유두종과 암종이 단순히 혼재되어 나타날 가능성을 제시하였지만 대부분 반전성 유두종이 이형성(dysplasia), 상피내암(carcinoma in situ) 등의 악성 변형(malignant transformation) 과정을 거쳐 암종으로 변환된 것이라 생각되고 있다[7,8].
반전성 유두종과 연관되어 발견되는 악성 종양은 대부분 편평세포암종(squamous cell carcinoma, SCC)으로 비부비동에 발생하는 전체 SCC 중 약 15% 정도를 차지하는 것으로 알려져 있다[2]. 이 종양은 원래부터 편평세포암종으로 발생한 종양(de novo SCC, dnSCC)과는 발생 과정이 다르고, 암종이 양성 유두중, 이형성 부위 등과 혼재되어 있으며, 종양 내에서 암종이 차지하는 비율도 다양하게 나타나는 등 조직학적 특성이 다르기 때문에 임상 양상이나 종양의 생물학적 특성, 치료 방법 및 결과 등이 다를 수 있다[9]. 그러나 일단 진단이 되면 병기 분류나 치료 방침은 현재까지 dnSCC와 같은 패러다임을 따르고 있다[9,10]. 그동안 반전성 유두종에 동반된 편평세포암종 환자를 대상으로 임상 양상, 치료 및 결과, 예후에 연관이 있는 인자 등에 대하여 분석한 연구는 많이 있었다[7,11-17]. 그러나 비부비동의 dnSCC과 비교분석한 연구는 매우 드물다[8,9,18,19].
이에 저자들은 태생학적으로 서로 다른 두 종양 사이에 어떠한 차이점과 공통점이 있는지 알아보고자 충남대학교병원에서 과거 30여년간 경험하였던 환자를 대상으로 인구통계 자료, 임상 양상, 병태생리학적 특징, 치료 방법, 치료 결과 등에 대해 비교분석하고자 하였다.
대상 및 방법
1989년부터 2018년 9월까지 비부비동에 발생한 SCC로 충남대학교병원 이비인후과에서 진단하고 치료하였던 환자 중 자료를 후향적으로 분석하는 데 문제가 없었던 69명의 환자를 선정하였으며, 추적조사 기간을 고려하여 2019년 12월 말을 분석 시점으로 정하였다.
이 연구는 충남대학교병원의 Institutional Review Board의 승인을 받은 후 진행되었다(IRB No. 2019-08-056).
조직검사에서 반전성 유두종에 동반된 편평세포암종(SCC associated with inverted papilloma, IP+SCC)으로 진단된 환자를 IP+SCC군으로, 반전성 유두종과 연관이 없었던 편평세포암종 환자를 dnSCC군으로 나눈 다음 의무기록과 영상 검사 등을 토대로 각 군의 인구통계학적 자료, 임상적 특성, 이용된 치료 방법, 치료 결과 등을 분석하였다. 추적기간은 IP+SCC군에서는 평균 60.9개월(2-240개월)이었으며, dnSCC 군에서는 평균 45.9개월(4-344개월)이었다.
IP+SCC군에서 반전성 유두종과 암종이 동시에 발견된 경우를 동시성(synchronous), 유두종 치료 수개월 내지 수년 후 암종이 발생한 경우를 이시성(metachronous)으로 분류하였으며, 흡연에 관해서는 현재 흡연하고 있거나 흡연 기왕력이 있는 환자를 흡연군으로 분류하였다.
종양의 원발부위와 골파괴 유무, 경부림프절 전이, 원격전이 등은 CT, MRI, PET 등 수술 전 영상검사와 수술 시 소견을 토대로 평가하였다. 종양의 원발부위를 정확히 가려내기는 쉽지 않다. 특히 종양이 진행하면서 여러 부위를 침범하였을 때는 더욱 어렵다. 이 연구에서는 수술기록지와 영상검사를 바탕으로 종양의 중심부가 위치한 곳, 골파괴 등 변형이 일어난 부위 등을 참조하여 원발부위를 정하였다.
암세포의 조직학적 분화도는 World Health Organization 기준에 따라 고분화(well differentiated), 중등도 분화(moderately differentiated), 저분화(poorly differentiated)로 분류하였으며, 종양의 병기는 American Joint Committee on Cancer (AJCC) (TNM system; 2017 version)에 의해 분류하였다[20].
IP+SCC군과 dnSCC군의 범주형 변수 비교에는 Fisher’s exact test를 사용하였으며, 전체 생존율(overall survival rate)과 무병 생존율(disease-free survival rate) 분석에는 Kaplan-Meier analysis가 이용되었다. 모든 통계분석에는 SPSS ver. 22.0 (IBM Corp., Armonk, NY, USA)이 이용되었으며, p value가 0.05 미만인 경우 통계적으로 유의한 것으로 판단하였다.
결 과
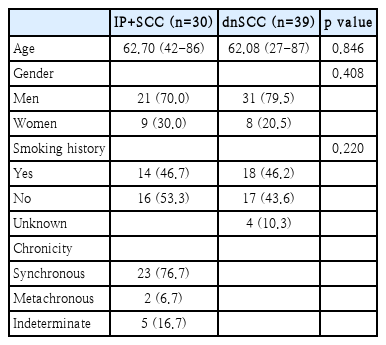
인구통계학적 분석(Table 1)
IP+SCC 환자는 30명, dnSCC 환자는 39명이었다. IP+SCC 환자군과 dnSCC 환자군의 평균 연령은 각각 62.70세, 62.08세로 두 군 사이에 유의한 차이는 없었다(p=0.846). 두 군 모두 남자가 훨씬 많았으며 두 군의 성별 분포도 통계학적으로 유의한 차이를 보이지 않았다(p=0.408). 또한 흡연력이 있는 환자의 비율도 유의한 차이를 보이지 않았다(p=0.220). IP+SCC 환자군에서 암종이 동시성으로 발생한 경우(23예, 76.7%)가 이시성으로 발생한 경우(2예, 6.7%)보다 훨씬 많았다. 타병원에서 수술을 받았던 기왕력이 있었던 환자로 이전 수술 시 조직검사를 하지 않았거나 조직검사 결과를 알 수 없었던 5명의 환자는 불확정(indeterminate)으로 분류하였다.
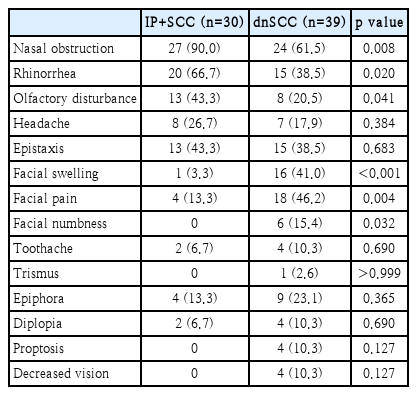
임상 증상(Table 2)
IP+SCC군과 dnSCC군 모두 가장 흔히 호소하였던 증상은 비폐색이었다. 그러나 두 군 사이에 나타나는 증상의 빈도는 약간 차이가 있었다. 비증상으로 생각되는 비폐색, 비루, 후각장애 증상은 dnSCC군보다 IP+SCC군에서 유의하게 많았다(각각 p=0.008, p=0.020, p=0.041). 반면 상악동과 안면부의 침범에 의한 증상이라고 생각되는 안면부 종창, 안면통, 안면 감각이상 등은 IP+SCC군보다 dnSCC군에서 유의하게 많았다(각각 p<0.001, p=0.004, p=0.032). 유루, 복시, 안구돌출 등의 안증상도 IP+SCC군에 비해 dnSCC군에서 빈도가 높았으나 그 차이가 통계학적으로 유의하지는 않았다.
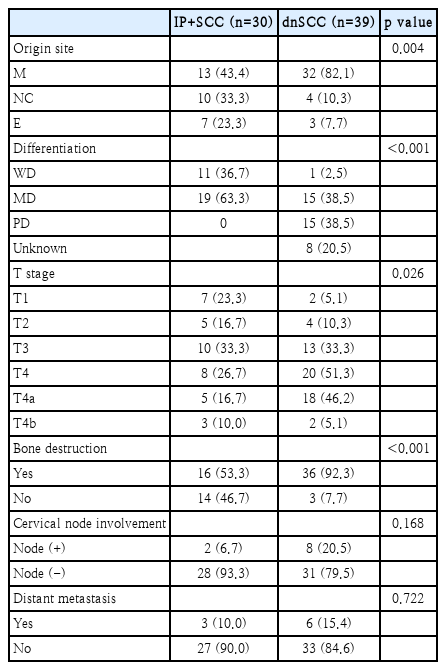
임상병리학적 특성(Table 3)
IP+SCC군에서는 상악동이 가장 흔한 원발 부위였지만(13명, 43.4%) 비강과 사골동 부위에서 원발한 경우도 17명(56.6%)이 있었다. 반면 dnSCC군에서는 상악동에서 원발한 경우가 대부분(32명, 82.1%)을 차지하였고 비강과 사골동에 발생한 경우는 상대적으로 적었다(7명, 18.0%). 통계학적적 분석에서 두 군의 원발부위는 유의한 차이를 보였다(p=0.004). 두 군 모두 전두동이나 접형동에서 원발한 예는 없었다.
암종의 조직학적 분화도 분석에서 IP+SCC군 환자는 고분화(11명, 36.7%)나 중등도 분화(19명, 63.3%)를 보였고 저분화암을 보인 예는 없었다. 반면 dnSCC군에서는 고분화암이 1예(2.5%)밖에 없었고 대부분이 중등도 분화암(38.5%)이나 저분화암(38.5%)으로 분류되어 dnSCC군에서 암종 분화도가 유의하게 낮은 것으로 분석되었다(p<0.001).
IP+SCC군의 종양 병기 분석에서 T1은 7명(23.3%), T2 5명(16.7%), T3 10명(33.3%), T4 8명(26.7%)이었으며, dnSCC군에서는 T1 2명(5.1%), T2 4명(10.3%), T3 13명(33.3%), T4 20명(51.3%)이었다. dnSCC군에서 진행된 병기(T3와 T4)를 보인 환자(33명, 84.6%)가 IP+SCC군에 비해 유의하게 많았다(p=0.026).
골파괴를 보인 환자는 IP+SCC군(16명, 53.3%)에 비해 dnSCC군(36명, 92.3%)에서 유의하게 많았다(p<0.001). 경부림프절 전이는 IP+SCC군에서 2명(6.7%), dnSCC군에서는 8명(20.5%)에서 발견되어 dnSCC군에서 많은 경향을 보였으나 통계적으로 유의한 차는 아니었다(p=0.168). 원격전이도 IP+SCC군과 dnSCC군의 각각 3명(10.0%), 6명(15.4%)에서 발견되었으나 그 차이는 통계적으로 유의수준에는 도달하지 못하였다(p=0.722). 원격전이 장기로는 폐가 가장 많았으며 그외에도 간, 뇌, 골 등으로의 전이를 보인 환자가 있었다.
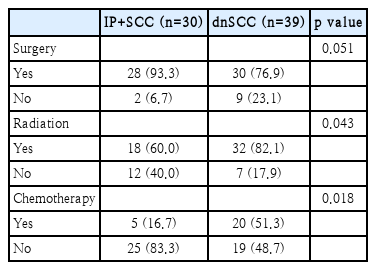
치료 방법(Table 4)
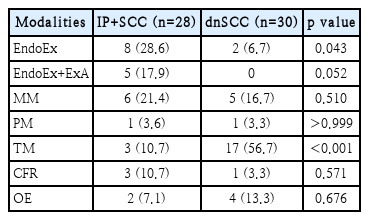
IP+SCC군에서는 28명(93.3%)에서 수술이 시행되었으며, 이용된 수술 방법은 Table 5와 같다. 내시경적 절제술(endoscopic excision)이 가장 흔하게 시행된 수술이었으며(28.6%) 내측 상악절제술(medial maxillectomy), 외부접근법을 병용한 내시경적 절제술, 상악전적출술(total maxillectomy) 등이 뒤를 이었다. 수술이 시행되지 않았던 2명의 환자는 원격전이가 있었거나 진행된 병기의 환자로 1명은 항암화학요법, 나머지 1명은 방사선치료와 함암화학요법의 병용치료를 시행하였다. 방사선치료는 18명(60.0%)에서 시행되었는데 이 중 17명은 술후 방사선치료였다. 항암화학요법은 5명(16.7%)에서 시행되었는데 이 중 3명은 수술 및 술후 방사선치료와 함께 시행되었다.
dnSCC군에서는 30명(76.9%)에서 수술이 시행되었으며, 이용된 수술 방법은 Table 5와 같다. 17명(56.7%)의 환자에서 상악전적출술을 시행하였고 내시경적 절제술은 2명에서만 시행되었다. 수술이 시행되지 않았던 9명의 환자는 대부분 경부 림프절 전이나 원격전이, 진행된 병기의 환자로 5명은 방사선 치료와 항암화학요법의 병용치료, 3명은 항암화학요법만으로 치료하였으며, 나머지 1명은 고령으로 연명치료만 받다가 진단받은지 4개월 후에 사망하였다. 방사선치료는 32명(82.1%)에서 시행되었으며 27명에서는 술후 방사선치료의 형태로, 5명에서는 항암화학요법과의 병용치료로 시행되었다. 항암화학요법은 20명(51.3%)에서 시행되었는데 17명에서는 수술, 방사선치료의 병용치료로 시행되었고 3명에서는 단독요법으로 시행되었다.
치료 결과
IP+SCC군과 dnSCC군의 5년 전체 생존율은 각각 89.2%, 56.5%로 IP+SCC군에서 유의하게 높았다(p=0.005) (Fig. 1). 또한 5년 무병 생존율도 IP+SCC군에서 68.3%, dnSCC군에서 22.7%로 IP+SCC군에서 유의하게 높았다(p=0.002) (Fig. 2).
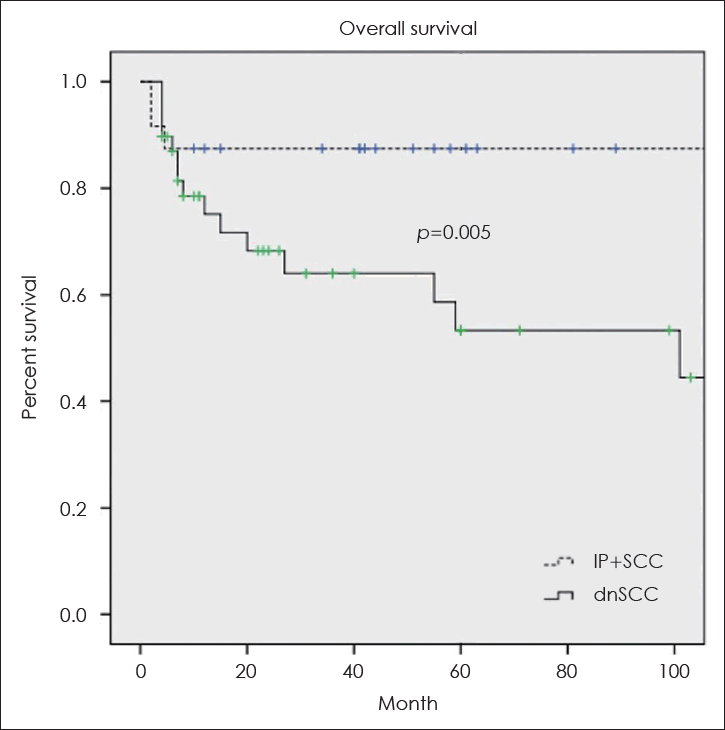
Kaplan-Meier curves of overall survival rate of the squamous cell carcinoma associated with or without inverted papilloma. IP+SCC, squamous cell carcinoma associated with inverted papilloma; dnSCC, de novo squamous cell carcinoma.
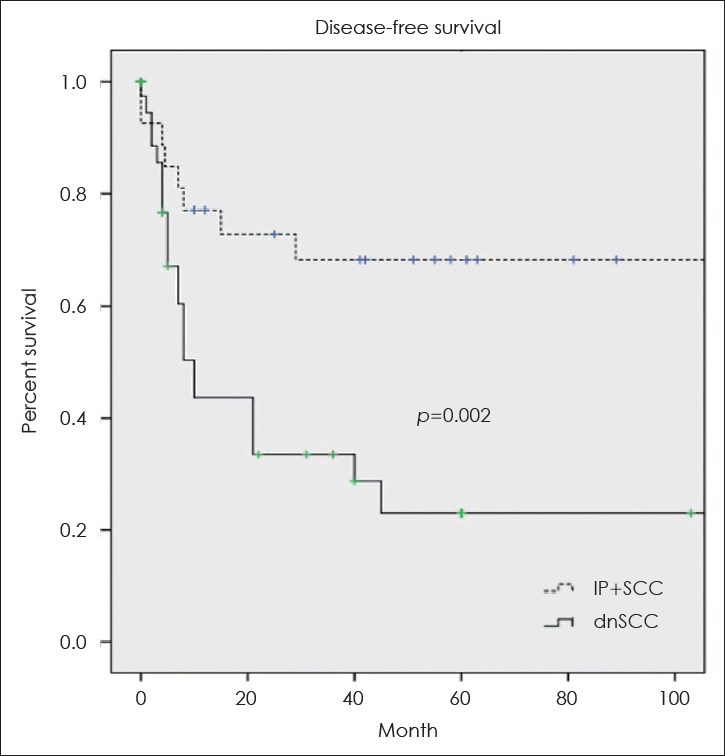
Kaplan-Meier curves of disease-free survival rate of the squamous cell carcinoma associated with or without inverted papilloma. IP+SCC, squamous cell carcinoma associated with inverted papilloma; dnSCC, de novo squamous cell carcinoma.
T병기에 따른 치료결과 분석에서 IP+SCC군의 T1 병기 환자는 모두 치료 후 무병(no evidence of disease) 상태였으며, T2 병기의 환자에서는 80.0%, T3 병기의 환자에서는 90.0%가 무병 상태임을 보였다. 반면 8명의 T4 병기 환자 중 4명(50.0%)만 무병 상태였고, 2명은 유병 생존(alive with disease), 2명은 질병으로 인해 사망(dead of disease)하였다(Table 6). dnSCC군의 T1 병기 환자는 모두 치료 후 무병 상태였으며 T2 병기의 환자는 75.0%가 무병 상태임을 보였다. 반면 T3 병기와 T4 병기 환자는 각각 46.2%, 10.0%만이 무병 상태였으며 T4 환자의 60.0%가 질병으로 인한 사망, 30.0%가 유병 생존 상태였다(Table 6).
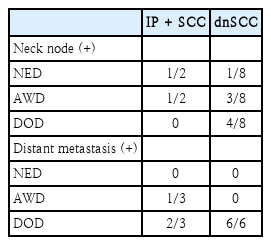
경부림프절 전이가 있었던 2명의 IP+SCC군 환자 중 1명은 무병 상태, 나머지 1명은 유병 생존 상태였다. 반면 dnSCC군에서는 8명 중 4명이 사망, 3명이 유병 생존 상태였다. 원격전이를 보였던 3명의 IP+SCC 환자 중 2명은 사망, 1명은 유병 생존 상태였으며, 6명의 dnSCC군 환자는 모두 사망하였다(Table 7).
고 찰
비부비동에 발생하는 악성 종양은 전체 두경부 악성 종양의 약 4%를 차지할 정도로 비교적 드문 종양이다. 이 부위에는 다양한 종류의 상피성 종양과 비상피성 종양이 발생하지만 그 중 가장 흔한 것은 편평세포암종이다[21]. 비부비동의 편평세포암종은 대부분 처음부터 암종으로 발생하지만 일부는 유두종, 특히 반전성 유두종에서 악성 변형 과정을 거쳐 발생한다[14]. 반전성 유두종에서 발견되는 암종은 발생시기에 따라 동시성 암종과 이시성 암종으로 나눈다. Mirza 등[4]은 메타분석 연구에서 동시성 암종으로 발견되는 빈도가 7.1%, 이시성 암종이 발생하는 빈도는 3.6%라고 하였으며, 대부분의 연구에서도 동시성으로 발생하는 경우가 훨씬 많음을 보여주고 있다[10-12,14,15]. 본 연구에서도 동시성 암종(23명)이 이시성 암종(2명)으로 발생한 경우보다 훨씬 많았다.
그동안 IP+SCC와 양성 유두종의 임상 양상을 비교한 연구[22]나 IP+SCC 환자만을 대상으로 임상병리학적 특성, 치료 결과, 예후에 영향을 미치는 인자 등을 분석한 연구는 많이 있었다[11-13,15-17]. 그러나 IP+SCC 환자군을 dnSCC 환자군과 비교분석한 논문은 아직 드물다[8,9,18,19]. 이 연구에서 저자들은 과거 30여년간 경험하였던 IP+SCC 환자 30명과 dnSCC 환자 39명의 의무기록을 후향적으로 비교분석하였다.
이전의 연구에서 환자의 연령, 성, 흡연력, 음주력 등 인구통계학적인 면은 두 군이 유사함을 보인다고 보고되어 있다[8,9,19]. 이 연구에서도 평균 연령은 두 군 모두 60대 초반이었고, 남성이 70% 이상을 차지하였으며, 흡연력도 유의한 차이를 보이지 않았다.
호소하는 증상에 대하여 Yu 등[8]은 IP+SCC군과 dnSCC군 사이에 차이가 없었다고 하였으나, 이 연구에서는 다른 결과를 보였다. 비폐색, 비루, 후각장애 등 비증상은 dnSCC군보다 IP+SCC군에서 유의하게 많았던 반면 안면부 종창, 안면통, 안면 감각이상 등은 dnSCC군에서 유의하게 많았다. 이러한 결과는 발생 부위와 연관이 있는 것으로 생각한다. Lobo 등[9]은 IP+SCC군과 dnSCC군은 원발부위에서 유의한 차이를 보이지 않았다고 하였으나, 이 연구에서는 IP+SCC군은 비강이나 사골동에서 원발한 경우가 56.6%였던 반면 dnSCC군에서는 상악동에서 원발한 경우가 대부분(82.1%)이었고 비강과 사골동에 발생한 경우는 상대적으로 적었다. 따라서 IP+SCC 군에서는 비증상이 유의하게 많았고, dnSCC군에서는 원발한 상악동에서 골파괴를 통해 안면부를 침범한 증례가 많았기 때문이라고 생각한다.
Yu 등[8]은 IP+SCC군과 dnSCC군 사이에 종양세포의 조직학적 분화도는 차이가 없었다고 하였으나 Lobo 등[9]은 IP+ SCC군에 비해 dnSCC군에서 저분화를 보인 예가 더 많았다고 하였다. 이 연구에서도 IP+SCC 환자군에서는 저분화암을 보인 예는 없었던 반면 dnSCC군에서는 대부분이 중등도 분화암이나 저분화암으로 분류되어 dnSCC군에서 암종 분화도가 유의하게 낮은 것으로 분석되었다.
T 병기 분석에서 Lobo 등[9]과 Yan 등[19]은 두 군 사이에 유의한 차이가 없었다고 보고한 반면, Yu 등[8]은 IP+SCC군에 비해 dnSCC군에서 T3와 T4 등 진행된 병기를 보인 예가 유의하게 많았다고 하였다. 이 연구에서도 진행된 병기(T3, T4)를 보인 환자가 IP+SCC군과 dnSCC군에서 각각 60.0%, 84.6%로 dnSCC군에서 유의하게 많았다. 또한 골파괴를 보인 환자도 각각 53.3%, 92.3%로 dnSCC군에서 유의하게 많았다. 이는 각 종양이 발생하는 부위와도 연관이 있을 것으로 생각한다. 이 연구 결과와 마찬가지로 이전의 다른 연구[10-12,16]에서도 IP+SCC는 상악동보다는 반전성 유두종이 많이 발생하는 비강이나 사골동 부위에서 더 많은 것으로 보고되어 있다. 따라서 상악동에서 원발하는 예가 많은 dnSCC보다 증상이 일찍 나타나고 그로 인해 이른 시기에 발견될 가능성이 높기 때문에 병기가 낮고 골파괴 빈도도 적은 것으로 생각한다.
이전의 연구에서 경부림프절 전이는 dnSCC군에서 더 흔한 것으로 보고되어 있다[8,9]. 이 연구에서도 경부림프절 전이는 IP+SCC군과 dnSCC군에서 각각 6.7%와 20.5%로 dnSCC군에서 많은 경향을 보였으나 통계적으로 유의수준에는 도달하지 못하였다. 원격전이는 IP+SCC군과 dnSCC군의 각각 10.0%, 15.4%에서 발견되어 두 군 사이에 원격전이 빈도의 유의한 차이를 보이지 않았다.
IP+SCC 환자의 치료 방침은 dnSCC과 같은 치료 원칙을 따르고 있다. 수술이 가장 주가 되는 치료이며 보조치료로 방사선치료와 항암화학요법이 이용된다. 수술을 할 수 없는 경우에는 방사선치료나 항암화학요법이 단독 혹은 병용요법으로 시행된다. Lobo 등[9]의 연구에서는 IP+SCC군과 dnSCC군에 이용된 치료방법에 있어서 차이가 없었다고 하였으나, Yu 등[8]은 dnSCC군에서 수술하지 않고 방사선치료나 항암화학요법 단독 혹은 병용요법으로 치료한 예가 유의하게 많았다고 보고하였다. 이 연구에서도 IP+SCC군에 비해 dnSCC군에서 방사선치료와 항암화학요법을 시행한 환자가 유의하게 많았다(각각 p=0.043, p=0.018). 이는 dnSCC군에 진행된 병기의 환자, 국소 혹은 원격전이를 보인 환자가 더 많았기 때문이다. 시행된 수술 방법을 분석한 결과 IP+SCC군에서는 dnSCC군에 비해 보존적 수술인 내시경적 절제술이 유의하게 많이 시행되었던 반면(p=0.043), dnSCC군에서는 근치적 수술인 상악전적출술이 가장 많이 시행된 수술이었다(p<0.001). 이 또한 dnSCC군에 진행된 병기의 환자가 많았기 때문이다.
IP+SCC 환자군과 dnSCC 환자군의 치료 결과가 다른지는 아직 확실치 않다. 두 군을 대상으로 비교분석한 연구에서 IP+SCC군이 dnSCC군에 비해 생존율이 좋았다는 보고도 있었지만 차이가 없었다는 보고도 있다[8,9,19]. 그러나 최근 Lee 등[18]은 메타분석 연구에서 IP+SCC군와 dnSCC군의 5년 생존율은 각각 65%와 56%로 IP+SCC군에서 생존율이 높았으며, dnSCC군에서 사망 위험률은 2배 정도 높다고 보고하였다. 이 연구에서는 IP+SCC군과 dnSCC군의 5년 전체 생존율은 각각 89.2%, 56.5%였으며, 5년 무병 생존율은 각각 68.3%, 22.7%로 IP+SCC군에서 유의하게 높음을 보여주었다. 또한 T 병기에 따른 치료결과 분석에서 IP+SCC군에서는 T4 병기의 환자에서, dnSCC군에서는 T3와 T4 병기의 환자에서 예후가 좋지 않았으며, 경부림프절 전이나 원격전이가 있었던 환자에서는 종양의 종류와 관계없이 나쁜 예후를 보였다.
이 연구는 환자군의 연령, 발생부위, T 병기, 전이 여부, 조직학적 분화도, 시대에 따른 수술 방법 및 치료 방침의 변화 등 여러 변수로 인해 두 군을 통계학적으로 비교분석하기에는 환자 수가 부족하였다는 점이 제한점으로 생각한다. 또한 한 기관에서 경험한 환자만을 대상으로 한 연구이기 때문에 다른 기관의 치료성적과 단순비교하기는 어려울 수 있을 것이다. 그렇지만 매우 드문 종양인 IP+SCC를 이해하는 데 이 연구 결과가 참고 자료가 될 수 있을 것으로 생각한다.
이 연구에서 태생학적으로 다른 IP+SCC와 dnSCC는 인구통계학적인 면에서는 유사함을 보였지만, IP+SCC가 dnSCC에 비해 예후가 좋은 이유로 몇 가지를 생각해 볼 수 있다. 첫째, 이 연구에서 나타났듯이 IP+SCC가 증상 발현이 늦은 상악동보다는 비강이나 사골동 부위에서 원발한 경우가 많아 조기에 발견되고 따라서 T 병기가 낮다는 점을 들 수 있다. 둘째로 IP+SCC에서는 암세포도 고분화 및 중등도 분화를 보이는 예가 많았다는 점을 들 수 있다. 셋째로 IP+SCC에는 암종뿐 아니라 양성 유두종, 이형성 부위가 공존하고 있기 때문에 종양이 모두 암세포로 구성되어 있는 dnSCC보다 예후가 좋을 수 있다는 점이다[18].
IP+SCC의 병기는 별도로 정해진 것이 없어 dnSCC와 같은 AJCC의 분류에 따라 평가한다. 그러나 종양 내에 부분적으로 존재하는 암종의 범위를 치료 전에 정확히 평가하기 어렵기 때문에 병기를 실제보다 높게 평가할 가능성이 있다[8,18]. IP+SCC를 치료할 때에도 현재까지 dnSCC의 치료 방침을 따르고 있다. 진행된 병기의 환자, 국소 림프절 및 원격장기로의 전이가 있는 환자에서는 당연히 dnSCC와 같은 패러다임에 따라 치료하는 것이 원칙이겠지만 그렇지 않은 경우에는 필요없는 이환(morbidity)을 유발하는 과잉치료를 피하는 것이 환자를 위하는 길일 수 있다. 따라서 IP+SCC에 맞는 병기 분류법(staging system)을 개발하고 그에 맞는 최적의 치료법을 정립하는 것이 필요하다.
Acknowledgements
This work was supported by research fund of Chungnam National University.
Notes
Author Contribution
Conceptualization: Ki-Sang Rha, Soo Kyoung Park. Data curation:, Ki-Sang Rha, Yong Min Kim, Soo Kyoung Park. Formal analysis: Jae-Yoon Kang. Resources: Soo Kyoung Park, Jae-Yoon Kang. Supervision: Ki-Sang Rha. Writing—original draft: Soo Kyoung Park. Writing—review & editing: Ki-Sang Rha, Yong Min Kim.