 |
 |
AbstractHearing loss is the third most common chronic health condition faced by older adults. Recently, a number of studies have demonstrated a significant association between hearing impairment and cognitive decline. However, the underlying explanatory mechanism of this relation has yet to be established. Given the relation between hearing loss and cognitive decline, researchers have been interested in the effect of restoring hearing ability on cognitive functions in older adults. One intervention option for management of the most severe to profound hearing loss in older adults is cochlear implantation (CI). We performed a review to assess the cur- rent status of the literature on the potential influence of CI on cognition in the older adults. Hearing rehabilitation through CI in elderly patients results in improvements in speech perception and cognitive function and lowers the progression to dementia. Further well-designed studies with long follow-up are needed to verify whether CI influences cognition in older adults.
ņä£ļĪĀļé£ņ▓ŁņØĆ Ļ░Ćņן ĒØöĒĢ£ ņØĖĻ░äņØś Ļ░ÉĻ░üņןņĢĀ ņżæ ĒĢśļéśņØ┤ļ®░, ļģĖņØĖņŚÉĻ▓ī 3ļ▓łņ¦ĖļĪ£ ĒØöĒĢ£ ļ¦īņä▒ņ¦łĒÖśņØ┤ļŗż[1]. ļģĖĒÖöņŚÉ ņØśĒĢ£ Ēć┤Ē¢ēņä▒ ļ│ĆĒÖöļĪ£, 65ņäĖ ņØ┤ņāüņØś Ļ│ĀļĀ╣ņØś ĒÖśņ×ÉļōżņØĆ ļé£ņ▓Ł ļ░£ņāØņØ┤ ĻĖēĻ▓®Ē׳ ņ”ØĻ░ĆĒĢ£ļŗż. ņĀ£8ĻĖ░ ĻĄŁļ»╝Ļ▒┤Ļ░Ģņśüņ¢æņĪ░ņé¼ Ļ▓░Ļ│╝ņŚÉ ļö░ļź┤ļ®┤, 65ņäĖ ņØ┤ņāüņØś ņä▒ņØĖņŚÉņä£ ņżæņ”ØļÅä ņØ┤ņāü ļé£ņ▓Ł ņ£Āļ│æļźĀņØĆ ļé©ņä▒ 44.7%, ņŚ¼ņä▒ 36.2%ņØ┤ļ®░, 70ņäĖ ņØ┤ņāüņŚÉņä£ļŖö ļé©ņä▒ 54.0%, ņŚ¼ņä▒ 44.5%ņŚÉ ļŗ¼ĒĢ£ļŗż[2].
ļģĖņØĖņŚÉņä£ ļé£ņ▓ŁĻ│╝ ņØĖņ¦ĆĻĖ░ļŖź ņĀĆĒĢśņÖĆņØś ņŚ░Ļ┤Ćņä▒ņØĆ, ņ▓ŁĻ░üņןņĢĀļź╝ Ļ░Ćņ¦ä ļģĖņØĖņØ┤ ņĀĢņāü ņ▓ŁļĀźņØä Ļ░Ćņ¦ä ļģĖņØĖļ│┤ļŗż ļ╣ĀļźĖ ņØĖņ¦ĆļĀź ņĀĆĒĢśļź╝ ļ│┤ņØĖļŗżļŖö Ļ▓░Ļ│╝ļź╝ ļ│┤ņŚ¼ņŻ╝ļŖö ņĀäĒ¢źņĀüņØ┤Ļ│Ā ņóģņĀüņØĖ(prospective, longitudinal) ļ¦ÄņØĆ ņŚ░ĻĄ¼ļōżņØä ĒåĄĒĢ┤ ĒÖĢļ”ĮļÉśņŚłļŗż[3-8]. ņØ┤ļĀćĻ▓ī ņ▓ŁĻ░üņןņĢĀņÖĆ ņØĖņ¦ĆļĀź ņĀĆĒĢśņØś ņŚ░Ļ┤Ćņä▒ņØä ļ│┤ņŚ¼ņŻ╝ļŖö ļŗżļģäĻ░äņØś ņŚ░ĻĄ¼ļōżņØä ņŚ░ĻĄ¼ ĻĖ░Ļ░ä, ļīĆņāü ĒÖśņ×É ņłś, ņ▓ŁĻ░üņןņĢĀ ĒÅēĻ░Ćņ¦ĆĒæ£, ņØĖņ¦ĆĻĖ░ļŖź ĒÅēĻ░Ć ņ¦ĆĒæ£ ļ░Å ņŚ░ĻĄ¼Ļ▓░Ļ│╝ņŚÉ ļīĆĒĢ┤ ņĀĢļ”¼ĒĢ┤ņä£ Table 1ņŚÉņä£ ļ│┤ņŚ¼ņŻ╝ņŚłļŗż. ĻĘĖļ¤¼ļéś ņĢäņ¦ü ļģĖĒÖöņä▒ ļé£ņ▓ŁĻ│╝ ņØĖņ¦ĆĻĖ░ļŖź ņĀĆĒĢśņØś Ļ┤ĆļĀ©ņä▒ņŚÉ ļīĆĒĢ£ ņøÉņØĖ ĻĖ░ņĀäņØĆ ļ¬ģĒÖĢĒ׳ ļ░ØĒśĆņ¦Ćņ¦Ć ņĢŖņĢśĻ│Ā, ļ│ĄĒĢ®ņĀüņØĖ ņÜöņØĖļōżņØ┤ Ļ┤ĆņŚ¼ĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż[9]. ļśÉĒĢ£, ļé£ņ▓ŁņØĆ ņ╣śļ¦żņŚÉ ļīĆĒĢ£ 12Ļ░Ćņ¦Ć ņ£äĒŚśņÜöņØĖ ņżæ, Ļ░Ćņן Ēü░ ņ×Āņ×¼ļĀźņØä ņ¦Ćļŗī ņłśņĀĢ Ļ░ĆļŖźĒĢ£ ņ£äĒŚś ņÜöņåīņØ┤ļ®░[10,11], ļé£ņ▓ŁņŚÉ ļīĆĒĢ£ ņ▓ŁĻ░üņĀü ņżæņ×¼ļź╝ ĒåĄĒĢ┤ ņ╣śļ¦żĻ░Ć ņśłļ░®ļÉĀ ņłś ņ׳ļŗżļŖö Ļ▓āņØä ņĀ£ņĢłĒĢ£ļŗż. ĻĘĖļ¤¼ļéś, ņØĖņ¦ĆĻĖ░ļŖźņŚÉ ļīĆĒĢ£ ļ│┤ņ▓ŁĻĖ░ņØś ĒÜ©Ļ│╝ļŖö ņĢäņ¦ü ļ¬ģĒÖĢĒĢśņ¦Ć ņĢŖņØĆļŹ░[12,13], ņØ┤ļŖö ļ│┤ņ▓ŁĻĖ░ļĪ£ ņØĖĒĢ£ ņ▓ŁļĀźņØś Ē¢źņāüņØ┤ ļģĖņØĖ ĒÖśņ×ÉņŚÉĻ▓ī ņĀ£ĒĢ£ņĀüņØ┤ĻĖ░ ļĢīļ¼ĖņØ┤ļŗż. Ļ│Āņŗ¼ļÅä Ļ░ÉĻ░üņŗĀĻ▓Įņä▒ ļé£ņ▓Ł(profound sensorineural hearing loss) ĒÖśņ×ÉļōżņŚÉĻ▓ī ņØĖĻ│ĄņÖĆņÜ░ ņØ┤ņŗØņłĀ(cochlear implantation)ņØĆ ņ£ĀņØ╝ĒĢśĻ▓ī Ļ░ĆļŖźĒĢ£ ņ╣śļŻīļ▓ĢņØ┤ļ®░, ņłśņłĀ ņØ┤Ēøä ņ▓ŁļĀź ņłśņżĆņØĆ Ēü¼Ļ▓ī Ē¢źņāüļÉ£ļŗż. ņØ┤ļŖö ņØĖĻ│ĄņÖĆņÜ░ ņØ┤ņŗØņłĀ ņØ┤Ēøä, ļģĖņØĖņØś ņ▓ŁĻ░ü ņłśņżĆņØ┤ ņØĖņ¦ĆļŖźļĀźņŚÉ ĻĖŹņĀĢņĀüņØĖ ņśüĒ¢źņØä ļ»Ėņ╣Ā ņłś ņ׳ņØīņØä ņŗ£ņé¼ĒĢĀ ņłś ņ׳ļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ļģĖņØĖ ĒÖśņ×ÉņŚÉņä£ ņ▓ŁĻ░üņןņĢĀņÖĆ ņØĖņ¦ĆĻĖ░ļŖź ņĀĆĒĢśņØś ņŚ░Ļ┤Ćņä▒ ļ░Å ņØĖĻ│Ą ņÖĆņÜ░ ņłśņłĀ Ēøä ņØĖņ¦ĆĻĖ░ļŖź Ē¢źņāüņŚÉ ļīĆĒĢ£ Ļ▓░Ļ│╝ļź╝ ņĄ£ĻĘ╝ ļģ╝ļ¼Ė ļ”¼ļĘ░ļź╝ ĒåĄĒĢ┤ ņĀĢļ”¼ĒĢśĻ│Ā, ņØĖĻ│ĄņÖĆņÜ░ ņłśņłĀĻ│╝ Ļ░ÖņØĆ ņ▓ŁĻ░üņĀü ņżæņ×¼Ļ░Ć ņØĖņ¦Ć ĻĖ░ļŖźņŚÉ ņ׳ņ¢┤ ņ¢┤ļ¢ż ņśüĒ¢źņØä ļ»Ėņ╣Āņ¦ĆņŚÉ ļīĆĒĢ┤ ņĢīņĢäļ│┤Ļ│Āņ×É ĒĢ£ļŗż.
ļ│ĖļĪĀļģĖņØĖņŚÉĻ▓ī ļé£ņ▓ŁĻ│╝ ņØĖņ¦ĆĻĖ░ļŖź ņĀĆĒĢśņØś ņŚ░Ļ┤Ćņä▒ņĄ£ĻĘ╝ņŚÉ ņ▓┤Ļ│äņĀü ļ”¼ļĘ░ ļ░Å ļ®öĒāĆ ļČäņäØņŚÉ ļīĆĒĢ£ ļ¦ÄņØĆ ņŚ░ĻĄ¼ļōżņØĆ ļģĖņØĖņŚÉņä£ ļé£ņ▓ŁĻ│╝ ņØĖņ¦ĆĻĖ░ļŖź ņĀĆĒĢś ļ░Å ņ╣śļ¦ż ņ£äĒŚśņØś ņ”ØĻ░Ć ļō▒ņŚÉ Ļ┤ĆĒĢ£ ņŚ░Ļ┤Ćņä▒ņØä ļ│┤ņŚ¼ņŻ╝Ļ│Ā ņ׳ļŗż[14-16]. 20264ļ¬ģņØä ļīĆņāüņ£╝ļĪ£ ĒĢ£ 36Ļ░£ņØś ņŚ░ĻĄ¼ļōżņØä ļ®öĒāĆ ļČäņäØĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£, ļģĖĒÖöņä▒ ļé£ņ▓ŁĻ│╝ ņØĖņ¦ĆĻĖ░ļŖź ņĀĆĒĢś(odds ratio [OR], 1.22; 95% confidence interval [CI], 1.09-1.36)ņÖĆ ņ╣śļ¦ż(OR, 1.28; 95% CI, 1.02-1.59)ņÖĆņØś ņ£ĀĒÜ©ĒĢ£ ņŚ░Ļ┤Ćņä▒ņØä ĒÖĢņØĖĒĢśņśĆļŗż[14].
Lin ļō▒[3,4]ņØĆ ļģĖņØĖņŚÉņä£ ļé£ņ▓ŁņØś ņŗ¼Ļ░üļÅäĻ░Ć Ļ░ĆņåŹĒÖöļÉ£ ņØĖņ¦ĆĻĖ░ļŖź ņĀĆĒĢśņÖĆ ļÅģļ”ĮņĀüņ£╝ļĪ£ ņŚ░Ļ┤ĆļÉ©ņØä ļ│┤ņŚ¼ņŻ╝ņŚłļŗż. Ļ▓░Ļ│╝ņĀüņ£╝ļĪ£, ņØĖņ¦ĆĻĖ░ļŖź ĒÅēĻ░ĆņŚÉņä£ ļé£ņ▓ŁņØś ņĀĢļÅäĻ░Ć ņŗ¼ĒĢĀņłśļĪØ ļŹö ļéśņü£ ņØĖņ¦ĆĻĖ░ļŖźĻ│╝ ņ£ĀņØśļ»ĖĒĢ£ ņāüĻ┤ĆĻ┤ĆĻ│äļź╝ Ļ░Ćņ¦ÉņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłļŗż. ļśÉĒĢ£, 25 dB HL ņØ┤ņāüņØś ļé£ņ▓ŁņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░ ņ▓ŁļĀźņŚŁņ╣śĻ░Ć 10 dBņö® ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ņ╣śļ¦ż ļ░£ņāØ ņ£äĒŚśņØ┤ 20% ņ”ØĻ░ĆĒĢ£ļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŗż[3]. 6ļģäĻ░äņØś ņČöņĀü Ļ┤Ćņ░░ ļÅÖņĢł, ļé£ņ▓ŁņØä Ļ░Ćņ¦ä ļģĖņØĖņØĆ ņĀĢņāü ņ▓ŁļĀźņØä Ļ░Ćņ¦ä ļģĖņØĖņŚÉ ļ╣äĒĢ┤, 30%-40%ņØś ļé«ņØĆ ņØĖņ¦ĆĻĖ░ļŖźņØä ļ│┤ņśĆĻ│Ā, ņØĖņ¦ĆņןņĢĀ ņ£äĒŚśņØ┤ 24% ņ”ØĻ░ĆĒ¢łļŗż[4].
ļö░ļØ╝ņä£, ļé£ņ▓ŁņØĆ ņØĖņ¦ĆĻĖ░ļŖź ņĀĆĒĢś ļ░Å ņ╣śļ¦ż ļ░£ņāØĻ│╝ ļÅģļ”ĮņĀüņØĖ ņŚ░Ļ┤Ćņä▒ņØä Ļ░¢ļŖöļŗżĻ│Ā ĒĢĀ ņłś ņ׳ļŗż. ņĄ£ĻĘ╝ņØś ņŚ░ĻĄ¼ļōżņŚÉņä£ ņ▓ŁļĀźņØ┤ ņĀĢņāüņØĖ ņä▒ņØĖņŚÉ ļ╣äĒĢ┤, Ļ▓ĮļÅä, ņżæļō▒ļÅä, ņŗ¼ļÅä ļé£ņ▓ŁņØ┤ ņ׳ļŖö ņä▒ņØĖņŚÉņä£ ņ╣śļ¦ż ļ░£ņāØ ņ£äĒŚśņØ┤ Ļ░üĻ░ü 2ļ░░, 3ļ░░, 5ļ░░ ņØ┤ņāü ņ”ØĻ░ĆĒĢ©ņØä ļ│┤Ļ│ĀĒĢśĻ│Ā ņ׳ļŗż[4,17]. ļśÉĒĢ£, ņĄ£ĻĘ╝ņØś ņĀäĒ¢źņĀü ņĮöĒśĖĒŖĖ ņŚ░ĻĄ¼ļōżņŚÉņä£ļŖö ļé£ņ▓ŁņØ┤ ņ╣śļ¦ż ļ░£ņāØņŚÉ ņ׳ņ¢┤ ļÅģļ”ĮņĀüņØĖ ņ£äĒŚśņÜöņØĖņ×äņØä ļ│┤ņŚ¼ņŻ╝Ļ│Ā ņ׳ļŗż[3,18-20]. ļé£ņ▓ŁņØ┤ ņ╣śļ¦ż ļ░£ņāØņØś ņ£äĒŚśņÜöņØĖņ×äņØä ņäżļ¬ģĒĢśĻĖ░ ņ£äĒĢ┤, Ļ░£ņ▓┤ĻĄ░ ĻĘĆņåīļČäĒÜŹ(population attributable fraction)ņØ┤ļØ╝ļŖö Ļ░£ļģÉņØä ņé¼ņÜ®ĒĢĀ ņłś ņ׳ļŖöļŹ░, ņØ┤ļŖö ņŻ╝ņ¢┤ņ¦ä ĻĖ░Ļ░ä ļÅÖņĢł ļé£ņ▓ŁĻ│╝ Ļ░ÖņØĆ ņ£äĒŚśņÜöņØĖņØ┤ ņĀ£Ļ▒░ļÉśņŚłņØä ļĢī, ņ╣śļ¦ż ļ░£ņāØņØ┤ Ļ░ÉņåīĒĢśļŖö ļ╣äņ£©ņØä ļéśĒāĆļéĖļŗż[11]. ņ╣śļ¦ż ļ░£ņāØņŚÉņä£ ļé£ņ▓ŁņØś ĻĘĆņåīļČäĒÜŹņØĆ 23.0%ļĪ£, ņØ┤ļŖö ņÜ░ņÜĖ (10.1%), ņé¼ĒÜīņĀü Ļ│Āļ”Į(5.9%), ĒØĪņŚ░(13.9%), Ļ│ĀĒśłņĢĢ(5.1%), ļŗ╣ļć© (3.2%) ļō▒ņØś ļŗżļźĖ ņ£äĒŚśņÜöņØĖļōżļ│┤ļŗż Ļ░Ćņן ļåÆņØĆ ņłśņ╣śņØ┤ļŗż[11]. ļé£ņ▓ŁĻ│╝ ņØĖņ¦ĆĻĖ░ļŖź ņĀĆĒĢś ļ░Å ņ╣śļ¦ż ļ░£ņāØ ņé¼ņØ┤ņŚÉ ņØĖĻ│╝Ļ┤ĆĻ│äĻ░Ć ņĀĢļ”ĮļÉ£ļŗżļ®┤, ļ│┤ņ▓ŁĻĖ░ļéś ņØĖĻ│ĄņÖĆņÜ░ņÖĆ Ļ░ÖņØĆ ņ▓ŁĻ░üņ×¼ĒÖ£ņØä ĒåĄĒĢ£ ņ▓ŁļĀźņØś Ē¢źņāüņØ┤ Ļ░ÉĻ░üņĀĆĒĢśņÖĆ ļģĖĒÖöņÖĆ Ļ┤ĆļĀ©ļÉ£ ņØĖņ¦ĆĻĖ░ļŖź ņĀĆĒĢśļź╝ ņÖäĒÖöņŗ£Ēé¼ ņłś ņ׳ņØä Ļ▓āņØ┤ļŗż[21].
ļģĖĒÖöņä▒ ļé£ņ▓ŁĻ│╝ ņØĖņ¦ĆĻĖ░ļŖź ņĀĆĒĢśņØś Ļ┤ĆļĀ©ņä▒ņØä ņäżļ¬ģ Ļ░ĆļŖźĒĢ£ ĻĖ░ņĀäņØ┤ ņĢäņ¦ü ļ¬ģĒÖĢĒĢśĻ▓ī ļ░ØĒśĆņ¦Ćņ¦Ć ņĢŖņĢśņ¦Ćļ¦ī, ļģĖĒÖöņä▒ ļé£ņ▓ŁņØ┤ ņ╣śļ¦żņŚÉ ĻĖ░ņŚ¼ĒĢĀ ņłś ņ׳ņØīņØä ņäżļ¬ģĒĢśļŖö ņ×Āņ×¼ņĀüņØĖ ņøÉņØĖ Ļ░ĆņäżļōżņØ┤ ņ׳ļŗż (Fig. 1). Ēü¼Ļ▓ī 2Ļ░Ćņ¦Ć Ļ░ĆņäżņØ┤ ņ׳ļŖöļŹ░, causal mechanismĻ│╝ common mechanismņØ┤ļŗż. ĻĘĖ ņżæ causal mechanismņØä ņäżļ¬ģĒĢśļŖö 2Ļ░Ćņ¦Ć Ļ░ĆņäżņØ┤ ņ׳ļŗż.
ņ▓½ņ¦Ė, ņØ┤ ļæśņØś Ļ┤ĆĻ│äĻ░Ć ņØĖĻ│╝Ļ┤ĆĻ│ä(causal mechanism)ļØ╝ļŖö Ļ░ĆņäżļĪ£, cognitive load hypothesisņÖĆ cascade hypothesis ļō▒ņØ┤ ņ׳ļŗż. Cognitive load hypothesisļ×Ć, ļé£ņ▓Łņ£╝ļĪ£ ņØĖĒĢśņŚ¼ ņ▓ŁĻ░ü ņØĖņ¦Ć Ļ│╝ņĀĢņØä ņ£äĒĢ┤ ļŹö ļ¦ÄņØĆ ņØĖņ¦Ć ņ×ÉņøÉņØä ĒĢäņÜöļĪ£ ĒĢśĻ│Ā, ļŗżļźĖ ņØĖņ¦Ć Ļ│╝ņĀĢņŚÉ ņé¼ņÜ®ļÉśļŖö ņ×ÉņøÉņØä ņ▓ŁņĘ©ļģĖļĀź ņ¬Įņ£╝ļĪ£ ņĀäĒÖśĒĢśĻ▓ī ļÉśņ¢┤, Ļ▓░ĻĄŁ ņØĖņ¦ĆņĀü ņśłļ╣äņ£©(cognitive reserve) Ļ░Éņåīļź╝ ņ£Āļ░£ĒĢ£ļŗżļŖö Ļ░ĆņäżņØ┤ļŗż[22-25]. ņ”ē, ņ▓ŁĻ░ü ņ¦ĆĻ░ü ņ▓śļ”¼ņŚÉ ņŤļŖö Ļ│╝ļÅäĒĢ£ ņØĖņ¦Ć ļČĆĒĢś(cognitive load)Ļ░Ć ļćīņØś ĻĄ¼ņĪ░ņĀü ļ│ĆĒÖöņÖĆ ļŗżļźĖ ņØĖņ¦Ć Ļ│╝ņĀĢņØś ņåÉņāüĻ│╝ Ļ┤ĆļĀ©ļÉ£ ņŗĀĻ▓ĮņØś Ēć┤Ē¢ēņØä ņ£Āļ░£ĒĢśļ®░, ņØĖņ¦ĆĻĖ░ļŖźņØś ņĀĆĒĢśļź╝ ņØ╝ņ£╝ĒéżĻ▓ī ļÉ£ļŗż[26]. Cascade hypothesisņŚÉņä£ļŖö, ļģĖĒÖöņä▒ ļé£ņ▓ŁņØ┤ ļćī ĻĄ¼ņĪ░ņŚÉ ļ│ĆĒÖöļź╝ ņØ╝ņ£╝ĒéżĻ│Ā ņ╣śļ¦ż ņ£äĒŚśņØä ņ”ØĻ░Ćņŗ£Ēé©ļŗżļŖö Ļ▓āņØ┤ļŗż. ļé£ņ▓ŁņØä Ļ░Ćņ¦ä ļģĖņØĖļōżņØś MRIņŚÉņä£ ņØ╝ņ░© ņ▓ŁĻ░ü Ēö╝ņ¦łņØś ļČĆĒö╝ Ļ░Éņåīļź╝ ļ│┤ņśĆĻ│Ā[27,28], ņØ┤ļ¤░ ļćīļČĆĒö╝ņØś Ļ░ÉņåīļŖö ņ×Āņ×¼ņĀüņ£╝ļĪ£ ņ╣śļ¦ż ņ£äĒŚś ņ”ØĻ░Ćļź╝ ņ£Āļ░£ĒĢĀ ņłś ņ׳ļŖö ņØĖņ¦Ć Ļ│╝ņĀĢņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣Ā ņłśņ׳ļŗżļŖö Ļ▓āņØ┤ļŗż. Cascade hypothesisļź╝ ņäżļ¬ģĒĢśļŖö ļśÉ ļŗżļźĖ Ļ░ĆņäżņØĆ ņé¼ĒÜīņĀü Ļ│Āļ”ĮņØ┤ļŗż. ļģĖĒÖöņä▒ ļé£ņ▓Ł ĒÖśņ×ÉņŚÉņä£ņØś ņØśņé¼ņåīĒåĄņØś ņŗżĒī©ļŖö ņé¼ĒÜīņĀü ĒåĄĒĢ®ņØä ņŗ¼Ļ░üĒĢśĻ▓ī ņĀ£ĒĢ£ĒĢśļ®░, ņØ┤ļ¤░ ņé¼ĒÜīĒÖöņØś Ļ░ÉņåīļŖö ņé¼ĒÜīņĀü Ļ│Āļ”Į, Ļ│ĀļÅģĻ░ÉĻ│╝ ņÜ░ņÜĖņ”ØņØä ņØ╝ņ£╝ĒéżĻ▓ī ļÉ£ļŗż[29-34]. ņÜ░ņÜĖņ”ØĻ│╝ ņé¼ĒÜīņĀü Ļ│Āļ”ĮņØĆ ņ▓ŁĻ░üņןņĢĀņÖĆ ņØĖņ¦ĆņןņĢĀ ņé¼ņØ┤ļź╝ ļ¦żĻ░£ĒĢśļŖö ņŚŁĒĢĀņØä ĒĢśļ®░ ņ▓ŁĻ░üņןņĢĀņÖĆ Ļ┤ĆļĀ©ļÉ£ ņØ┤ļ¤¼ĒĢ£ ļ¼ĖņĀ£ļŖö ņ¦üĻ░äņĀæņĀüņ£╝ļĪ£ ņØĖņ¦ĆņןņĢĀļź╝ ņ£Āļ░£ĒĢśĻ▓ī ļÉ£ļŗż.
ļæśņ¦Ė, common mechanism Ļ░ĆņäżņØĆ ļģĖĒÖöņä▒ ļé£ņ▓Ł ĻĘĖ ņ×Éņ▓┤Ļ░Ć ņ╣śļ¦żļź╝ ņØ╝ņ£╝ĒéżļŖö Ļ▓āņØ┤ ņĢäļŗłļØ╝, ņ╣śļ¦żņÖĆ ļģĖĒÖöņä▒ ļé£ņ▓ŁņŚÉ ĻĖ░ņŚ¼ĒĢśļŖö Ļ│ĄĒåĄ ĻĖ░ņĀäņØ┤ ņ׳ļŗżļŖö Ļ▓āņØ┤ļŗż. ņ”ē, ļģĖĒÖöņä▒ ļé£ņ▓ŁĻ│╝ ņØĖņ¦ĆĻĖ░ļŖź ņĀĆĒĢśĻ░Ć ņøÉņØĖ Ļ┤ĆĻ│äĻ░Ć ņĢäļŗłļØ╝ Ļ│ĄĒåĄņØś ņøÉņØĖņŚÉ ņØśĒĢ┤ ļ░£ņāØĒĢśĻ│Ā ņä£ļĪ£ ļÅģļ”ĮņĀüņ£╝ļĪ£ ļ░£ņāØĒĢśļ®░[26], ļćīņØś ļģĖĒÖöĻ│╝ņĀĢņŚÉņä£ Ļ│ĄĒåĄņĀüņØĖ ņŗĀĻ▓Į Ēć┤ĒÖö Ļ│╝ņĀĢņØś Ļ▓░Ļ│╝ļØ╝Ļ│Ā ĒĢĀ ņłś ņ׳ļŗżļŖö Ļ▓āņØ┤ļŗż[22]. ņØ┤ņÖĖņŚÉļÅä ļģĖĒÖöņä▒ ļé£ņ▓ŁĻ│╝ ņØĖņ¦ĆĻĖ░ļŖź ņĀĆĒĢś ņé¼ņØ┤ņØś ņŚ░Ļ┤Ćņä▒ņØä ņäżļ¬ģĒĢśĻĖ░ ņ£äĒĢ┤ ņĄ£ĻĘ╝ ļģĖņćĀ(frailty)ņÖĆ Ļ┤ĆļĀ©ļÉ£ Ļ░ĆņäżļÅä ņĀ£ĻĖ░ļÉśĻ│Ā ņ׳ņ¦Ćļ¦ī[35,36], ņØ┤ ļæś Ļ░äņØś ņĀĢĒÖĢĒĢ£ ņØĖĻ│╝Ļ┤ĆĻ│äņØś ĒÖĢļ”ĮņØä ņ£äĒĢ┤ ļ¦ÄņØĆ ĒøäņåŹ ņŚ░ĻĄ¼ļōżņØ┤ ĒĢäņÜöĒĢĀ Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż.
ļģĖņØĖ ĒÖśņ×ÉņŚÉņä£ ņØĖĻ│ĄņÖĆņÜ░ ņłśņłĀ Ēøä Ļ▓░Ļ│╝ņØĖĻ│ĄņÖĆņÜ░ ņłśņłĀņØ┤ Ļ│Āņŗ¼ļÅä ļé£ņ▓ŁņØś Ēæ£ņżĆņĀüņØĖ ņ╣śļŻīļ▓Ģņ£╝ļĪ£ ņØĖņĀĢļÉśļ®┤ņä£, ņłśņłĀ Ļ▒┤ņłśĻ░Ć ņ”ØĻ░ĆĒĢśĻ│Ā ņłśņłĀ ņĀüņØæņ”ØņØś ļ▓öņ£äļÅä ĒÖĢļīĆļÉśĻ│Ā ņ׳ļŗż[37]. ļśÉĒĢ£ ņØĖĻ│ĄņÖĆņÜ░ ņØ┤ņŗØņłĀ ņØ┤Ēøä ĒÜŹĻĖ░ņĀüņ£╝ļĪ£ Ļ░£ņäĀļÉ£ ņ▓ŁļĀźņ×¼ĒÖ£ņØś Ļ▓░Ļ│╝ņŚÉ ļīĆĒĢ£ ļ│┤Ļ│ĀĻ░Ć ļ¦ÄņĢśņ£╝ļéś, ņØ┤ļŖö ņŻ╝ļĪ£ ņåīņĢäļéś ņä▒ņØĖ ĒÖśņ×ÉņŚÉ ĻĄŁĒĢ£ļÉśņŚłļŗż. ĻĘĖļ¤¼ļéś, ņĄ£ĻĘ╝ ļģĖļĀ╣ ņØĖĻĄ¼ņØś ņ”ØĻ░ĆņŚÉ ļö░ļØ╝, ļģĖņØĖ ĒÖśņ×ÉņŚÉņä£ņØś ņØĖĻ│ĄņÖĆņÜ░ ņłśņłĀņØ┤ ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ņØ┤ņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼ Ļ▓░Ļ│╝Ļ░Ć ļ¦ÄņØ┤ ļ│┤Ļ│ĀļÉśĻ│Ā ņ׳ļŗż. ļģĖņØĖ ĒÖśņ×ÉņŚÉņä£ ņØĖĻ│ĄņÖĆņÜ░ ņØ┤ņŗØņłĀ ņŗ£Ē¢ē Ēøä ņĀŖņØĆ ļéśņØ┤ņØś ļīĆņĪ░ĻĄ░Ļ│╝ ļ╣äĻĄÉĒĢśņŚ¼ ņłĀĒøä ņ¢Ėņ¢┤ņłśĒ¢ēļĀźņŚÉ ņ░©ņØ┤Ļ░Ć ņŚåņØīņØ┤ ļ│┤Ļ│ĀļÉśņŚłĻ│Ā[38,39], ņéČņØś ņ¦łņĀüņØĖ ņĖĪļ®┤ņŚÉņä£ļÅä ļģĖņØĖ ĒÖśņ×ÉņŚÉņä£ ņÖĆņÜ░ņØ┤ņŗØņłĀ Ēøä Ē¢źņāüļÉ£ Ļ▓░Ļ│╝Ļ░Ć ļ│┤Ļ│ĀļÉśņŚłļŗż[40]. ļģĖņØĖ ĒÖśņ×ÉņŚÉņä£ ņØĖĻ│ĄņÖĆņÜ░ ņłśņłĀ Ēøä ņ¢Ėņ¢┤ņłśĒ¢ēļĀź Ļ▓░Ļ│╝ļź╝ ļ│┤Ļ│ĀĒĢ£ ļ¦ÄņØĆ ņŚ░ĻĄ¼ļōżņØ┤ ņ׳ļŗż. Vermeire ļō▒[40]ņØĆ ņØĖĻ│ĄņÖĆņÜ░ ņØ┤ņŗØņłĀ ņØ┤Ēøä 2ļģäĻ░ä 89ļ¬ģņØś ņ¢Ėņ¢┤ņŖĄļōØ Ēøä ļé£ņ▓ŁņØä Ļ░Ćņ¦ä ņä▒ņØĖ ĒÖśņ×ÉļōżņØä ļČäņäØĒĢśņśĆĻ│Ā, ņØ┤ņŗØ ņŗ£ņØś ņŚ░ļĀ╣ņØĆ ĒÅēĻĘĀ 58ņäĖ(17-83ņäĖ)ņśĆņ£╝ļ®░, ļé£ņ▓ŁņØś ĻĖ░Ļ░äņØ┤ļéś ļ│┤ņ▓ŁĻĖ░ ņé¼ņÜ® ņ£Āļ¼┤ņŚÉ ļīĆĒĢ£ ņ¢ĖĻĖēņØĆ ņŚåņŚłļŗż. ņØ┤ ņżæ 25ļ¬ģņØĆ 70ņäĖ ņØ┤ņāüņØś ĒÖśņ×ÉļōżņØ┤ņŚłĻ│Ā, 70ņäĖ ņØ┤ĒĢś ĒÖśņ×ÉĻĄ░Ļ│╝ņØś ļ╣äĻĄÉ ņŚÉņä£ ņ¢Ėņ¢┤ņłśĒ¢ēļĀźņŚÉ ņ£ĀņØśļ»ĖĒĢ£ ņ░©ņØ┤Ļ░Ć ņŚåņŚłļŗż. Budenz ļō▒[41]ņØĆ ņ¢Ėņ¢┤ņŖĄļōØ Ēøä ļé£ņ▓ŁņØä Ļ░Ćņ¦ä ņä▒ņØĖ ĒÖśņ×ÉļōżņŚÉņä£ 70ņäĖ ņØ┤ņāüņØś ĒÖśņ×É 60ļ¬ģĻ│╝ 18-69ņäĖ ņé¼ņØ┤ņØś ĒÖśņ×É 48ļ¬ģņØś ņ¢Ėņ¢┤ņłśĒ¢ēļĀźņØä 2ļģäĻ░ä Ļ▓ĮĻ│╝ Ļ┤Ćņ░░ ĒĢśņśĆļŗż. ļģĖņØĖ ĒÖśņ×ÉĻĄ░ņŚÉņä£ ņØ┤ņŗØ ņŗ£ ĒÅēĻĘĀņŚ░ļĀ╣ņØĆ 76┬▒4.0ņäĖ(70-86ņäĖ)ņśĆĻ│Ā, ņĀŖņØĆ ĒÖśņ×ÉĻĄ░ņŚÉņä£ ĒÅēĻĘĀņŚ░ļĀ╣ņØĆ 47.9┬▒10.8ņäĖ(22-62ņäĖ)ņśĆņ£╝ļ®░, ļé£ņ▓Ł ĻĖ░Ļ░äņØĆ ĒÅēĻĘĀ 34.0┬▒21.4ļģäĻ│╝ 23.4┬▒17.9ļģäņ£╝ļĪ£ ļæÉ ĻĄ░ Ļ░äņØś ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļź╝ ļ│┤ņśĆļŗż(p=0.01). ņØĖĻ│ĄņÖĆņÜ░ ņØ┤ņŗØņłĀ Ēøä ņ¢Ėņ¢┤ņłśĒ¢ēļĀźņŚÉņä£ ļģĖņØĖ ĒÖśņ×ÉĻĄ░ņŚÉņä£ ņ£ĀņØśļ»ĖĒĢ£ Ē¢źņāüņØä ļ│┤ņśĆļŗż. ļæÉ ĻĄ░ ļ¬©ļæÉ ņ▓½ 3Ļ░£ņøöņŚÉ ņ¢Ėņ¢┤ļČäļ│äļĀź(speech discrimination)ņØś ļ╣ĀļźĖ Ē¢źņāüņØä ļ│┤ņśĆĻ│Ā, ņ¢Ėņ¢┤ņłśĒ¢ēļĀźņŚÉņä£ļÅä ļ╣äņŖĘĒĢ£ ņä▒ņן ņåŹļÅäļź╝ ļ│┤ņśĆļŗż. ļ╣äļĪØ ļģĖņØĖ ĒÖśņ×ÉĻĄ░ņØś ņ¢Ėņ¢┤ņłśĒ¢ēļĀźņØ┤ ĒÅēĻĘĀņĀüņ£╝ļĪ£ ņĀŖņØĆ ĒÖśņ×ÉĻĄ░ņŚÉ ļ╣äĒĢ┤ ļé«ņĢśņ¦Ćļ¦ī, ņØ┤ļŖö ņŚ░ļĀ╣ņØś ņ░©ņØ┤ņŚÉ ņØśĒĢ£ Ļ▓āņØ┤ ņĢäļŗłļØ╝ ļæÉ ĻĄ░ Ļ░äņØś ļé£ņ▓Ł ĻĖ░Ļ░äņØś ņ░©ņØ┤ņŚÉ ņØśĒĢ£ Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż. Lenarz ļō▒[42]ņØĆ 1005ļ¬ģņØś ņ¢Ėņ¢┤ņŖĄļōØĻĖ░ Ēøä ļé£ņ▓Ł ĒÖśņ×É ņżæņŚÉņä£ 70ņäĖ ņØ┤ņāüņØś ĒÖśņ×É 130ļ¬ģ(Group 4)Ļ│╝ 18-69ņäĖņé¼ņØ┤ņØś ĒÖśņ×É 875ļ¬ģņØä 2ļģäĻ░ä ļ╣äĻĄÉ ļČäņäØĒĢśņśĆĻ│Ā, ņĀŖņØĆ ĒÖśņ×ÉļōżņØĆ ļéśņØ┤ņŚÉ ļö░ļØ╝, Group 1 (18-39ņäĖ, n=220), Group 2 (40-59ņäĖ, n=420), Group 3 (60-69ņäĖ, n=235)ļĪ£ ļČäļźśĒĢśņśĆļŗż. ļģĖņØĖ ĒÖśņ×ÉĻĄ░ņØĆ ņØĖĻ│ĄņÖĆņÜ░ ņØ┤ņŗØņłĀ ņØ┤Ēøä ņĀŖņØĆ ĒÖśņ×ÉĻĄ░Ļ│╝ ņ£Āņé¼ĒĢ£ ĒĢÖņŖĄĻ│ĪņäĀ (learning curve)ņØä ļ│┤ņśĆĻ│Ā, ņĪ░ņÜ®ĒĢ£ ĒÖśĻ▓ĮņŚÉņä£ ņ¢Ėņ¢┤ ĒÅēĻ░ĆņŚÉņä£ļÅä ņĀŖņØĆ ĒÖśņ×ÉĻĄ░Ļ│╝ ļ╣äņŖĘĒĢ£ ņłśĒ¢ēļĀźņØä ļ│┤ņśĆļŗż. ņ¢Ėņ¢┤ ņłśĒ¢ēļĀźņØĆ 6Ļ░£ņøö ņ¦Ė ņĢłņĀĢņĀüņØĖ ņłśņżĆņŚÉ ļÅäļŗ¼ĒĢśņśĆņ£╝ļ®░, 2ļģäĻ░ä ņłśĒ¢ēļĀźņØś Ļ░ÉņåīļŖö Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśļŗż. ĒŖ╣Ē׳ ņØ┤ ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņŚ░ļĀ╣ ņØ┤ņÖĖņŚÉ ņØĖĻ│ĄņÖĆņÜ░ ņØ┤ņŗØņłĀ Ļ▓░Ļ│╝ņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣Ā ņłś ņ׳ļŖö ņ×Āņ×¼ņĀüņØĖ ĻĄÉļ×Ć ņÜöņåīļĪ£ ņāØĻ░üļÉśļŖö ļé£ņ▓Ł ĻĖ░Ļ░ä, ņłśņłĀ ņĀä ņ▓ŁļĀź ņłśņżĆ, ņ×äĒöīļ×ĆĒŖĖ ņŗ£ņŖżĒģ£ņØś ņ£ĀĒśĢ ļō▒ņØä Ļ░ÖņØ┤ ĒÅēĻ░ĆĒĢśņśĆĻ│Ā, ļģĖņØĖ ĒÖśņ×ÉĻĄ░Ļ│╝ ņĀŖņØĆ ĒÖśņ×ÉĻĄ░ ņé¼ņØ┤ņŚÉņØ┤ ņäĖ Ļ░Ćņ¦Ć ņÜöņØĖņŚÉ ļīĆĒĢ┤ ņ£ĀņØśļ»ĖĒĢ£ ņ░©ņØ┤Ļ░Ć ņŚåņŚłļŗż. ņ”ē ņ¢Ėņ¢┤ņŖĄļōØĻĖ░ Ēøä ļé£ņ▓ŁņØä Ļ░Ćņ¦ä ļģĖņØĖ ĒÖśņ×ÉņŚÉņä£ ņØĖĻ│ĄņÖĆņÜ░ ņØ┤ņŗØņłĀ ņØ┤Ēøä ņØīņä▒ ņØĖņŗØ(speech perception)ņØĆ ĒÖśņ×ÉņØś ņŚ░ļĀ╣Ļ│╝ ņāüĻ┤ĆņŚåņØ┤ Ēü¼Ļ▓ī Ē¢źņāüļÉśņŚłĻ│Ā[43], ņØ┤Ļ▓āņØĆ ņØ┤ņŗØ ņŗ£ ņŚ░ļĀ╣ļ¦īņØä ņłĀĒøä ņ▓ŁļĀź Ļ▓░Ļ│╝ņØś ņśłņĖĪ ņØĖņ×ÉļĪ£ Ļ│ĀļĀżĒĢĀ Ļ▓āņØ┤ ņĢäļŗłļØ╝, ļé£ņ▓Ł ĻĖ░Ļ░äĻ│╝ Ļ░ÖņØĆ ļ│┤ļŗż ļ¬ģĒÖĢĒĢ£ ņśłņĖĪņØĖņ×ÉĻ░Ć Ļ│ĀļĀżļÉśņ¢┤ņĢ╝ ĒĢ©ņØä ņØśļ»ĖĒĢ£ļŗż. ļśÉĒĢ£, ņĄ£ĻĘ╝ņØś ņŚ░ĻĄ¼ļōżņŚÉ ņä£ļÅä ņ¢Ėņ¢┤ņŖĄļōØĻĖ░ Ēøä ļé£ņ▓ŁņØä Ļ░Ćņ¦ä ļģĖņØĖ ĒÖśņ×ÉņŚÉņä£ ņØĖĻ│ĄņÖĆņÜ░ ņłśņłĀ Ēøä ņ▓ŁĻ░üĒĢÖņĀü Ļ▓░Ļ│╝ļŖö ņØ┤ņŗØ ņŚ░ļĀ╣Ļ│╝ ņ£ĀņØśļ»ĖĒĢ£ ņāüĻ┤ĆĻ┤ĆĻ│äĻ░Ć ņŚåņØīņØä ļ│┤Ļ│ĀĒĢśĻ│Ā ņ׳ļŗż[44-46]. ļö░ļØ╝ņä£, ņØĖĻ│ĄņÖĆņÜ░ ņłśņłĀņØĆ Ļ│Āņŗ¼ļÅäņØś ļé£ņ▓ŁņØä Ļ░Ćņ¦ä Ļ│ĀļĀ╣ņØś ĒÖśņ×ÉņŚÉĻ▓ī ņ▓ŁĻ░üĒĢÖņĀü ņłśĒ¢ēļĀź, Ļ▒┤Ļ░Ģ ņāüĒā£, ņé¼ĒÜīņĀü ņāüĒśĖņ×æņÜ®ņŚÉ ņ׳ņ¢┤ ĒśäņĀĆĒĢ£ Ļ░£ņäĀņØś Ļ▓░Ļ│╝ļź╝ ņżä ņłś ņ׳ļŖö ņĢłņĀäĒĢśĻ│Ā ĒÜ©Ļ│╝ņĀüņØĖ ņ╣śļŻīļ▓Ģņ×äņØä ņŗ£ņé¼ĒĢ£ļŗż[43].
ļģĖņØĖ ĒÖśņ×ÉņŚÉņä£ ņØĖĻ│ĄņÖĆņÜ░ ņłśņłĀņØ┤ ņØĖņ¦ĆĻĖ░ļŖźņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņ╣śļ¦żļź╝ ņ╣śļŻīĒĢśļŖö ļŹ░ ņ׳ņ¢┤ ĒÜ©Ļ│╝ņĀüņØĖ ņ╣śļŻīĻ░Ć ņĢäņ¦ü ņŚåĻĖ░ ļĢīļ¼ĖņŚÉ, ņØĖņ¦Ć ĻĖ░ļŖź ņĀĆĒĢśņŚÉ ļīĆĒĢ£ ņłśņĀĢ Ļ░ĆļŖźĒĢ£ ņ£äĒŚś ņÜöņåīļź╝ Ļ┤Ćļ”¼ĒĢśļŖö Ļ▓āņØ┤ Ļ░£ņØĖĻ│╝ ņé¼ĒÜīņŚÉ ņ¦ĆļīĆĒĢ£ ņśüĒ¢źņØä ļ»Ėņ╣Ā ņłś ņ׳ņØä Ļ▓āņØ┤ļŗż. ļö░ļØ╝ņä£ ļé£ņ▓ŁņØ┤ ņØĖņ¦ĆĻĖ░ļŖź ņĀĆĒĢśņØś ņØ╝ņ░©ņĀüņØĖ Ļ░£ņäĀ Ļ░ĆļŖźĒĢ£ ņ£äĒŚś ņÜöņåīĻ░Ć ļÉśĻĖ░ ļĢīļ¼ĖņŚÉ, ļ│┤ņ▓ŁĻĖ░ļéś ņØĖĻ│ĄņÖĆņÜ░ Ļ░ÖņØĆ ņ▓ŁĻ░üņĀü ņżæņ×¼Ļ░Ć ņØĖņ¦ĆĻĖ░ļŖź ņĀĆĒĢś ļ░Å ņ╣śļ¦żņÖĆ Ļ┤ĆļĀ©ļÉ£ Ļ▓░Ļ│╝ļź╝ ņāüļŗ╣Ē׳ Ļ░£ņäĀņŗ£Ēé¼ Ļ▓āņØ┤ļØ╝ ņśłņāüļÉ£ļŗż. ņØ┤ļŖö ņØĖĻ│ĄņÖĆņÜ░ ņłśņłĀņØ┤ ņØĖņ¦ĆĻĖ░ļŖź Ē¢źņāüņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņŚÉ ļīĆĒĢ┤ ņé┤ĒÄ┤ļ│Ė ļ¬ćļ¬ć ņŚ░ĻĄ¼ņŚÉņä£ ĒÖĢņØĖĒĢĀ ņłś ņ׳ļŗż.
Ēöäļ×æņŖżņŚÉņä£ 10Ļ░£ņØś 3ņ░© ņØśļŻīĻĖ░Ļ┤ĆņŚÉņä£ ņłśĒ¢ēĒĢ£ ņĀäĒ¢źņĀü ņŚ░ĻĄ¼ņŚÉņä£ 65-85ņäĖņØś ĒÖśņ×É 94ļ¬ģņŚÉņä£ ņØĖĻ│ĄņÖĆņÜ░ ņłśņłĀ ņĀä, ņłśņłĀ Ēøä 6Ļ░£ņøö, 12Ļ░£ņøö Ēøä ņØĖņ¦ĆĻĖ░ļŖźņØä ĒÅēĻ░ĆĒĢśņśĆļŗż[47]. ņłśņłĀ ņĀä ļé«ņØĆ ņØĖņ¦ĆĻĖ░ļŖź ņĀÉņłśļź╝ ļ░øņØĆ ĒÖśņ×ÉļōżņØś 80% ņØ┤ņāüņŚÉņä£ ņØĖĻ│ĄņÖĆņÜ░ ņłśņłĀ Ēøä 12Ļ░£ņøöņ¦Ė ņØĖņ¦ĆĻĖ░ļŖźņØś Ē¢źņāüņØä ļ│┤ņśĆĻ│Ā, ņØĖĻ│ĄņÖĆņÜ░ļź╝ ĒåĄĒĢ£ ņ▓ŁĻ░üņĀü ņ×¼ĒÖ£ņØ┤ ļģĖņØĖļōżņŚÉĻ▓ī ņåÉņāüļÉ£ ņØĖņ¦ĆĻĖ░ļŖźņØś Ļ░£ņäĀĻ│╝ Ļ┤ĆļĀ©ņØ┤ ņ׳ļŗżļŖö Ļ▓░ļĪĀņØä ļé┤ņŚłļŗż. ļģĖņØĖ ĒÖśņ×ÉņŚÉņä£ ņØĖĻ│ĄņÖĆņÜ░ ņłśņłĀ Ēøä ņØĖņ¦ĆĻĖ░ļŖźņØś Ļ▓░Ļ│╝ļź╝ ļ│┤ņŚ¼ņŻ╝ļŖö ņ▓┤Ļ│äņĀü ļ”¼ļĘ░ņŚÉ Ļ┤ĆĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ļŖö, 166ļ¬ģņØś ĒÖśņ×ÉĻ░Ć ĒżĒĢ©ļÉ£ ņäĀĒāØļÉ£ 6Ļ░£ņØś ņŚ░ĻĄ¼ ņżæ 5Ļ░£ņŚÉņä£ ņØĖĻ│Ą ņÖĆņÜ░ ņłśņłĀ Ēøä ņØĖņ¦ĆĻĖ░ļŖźņØś Ē¢źņāüņØä ļ│┤Ļ│ĀĒĢśņśĆĻ│Ā[47-51], ņśżņ¦ü ĒĢ£ Ļ░£ņØś ņŚ░ĻĄ¼ņŚÉņä£ļ¦ī ņłśņłĀ ņØ┤Ēøä ņØĖņ¦Ć ņłśĒ¢ēļĀźņŚÉ ņ£ĀņØśĒĢ£ ļ│ĆĒÖöĻ░Ć ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŗż[52]. Table 2ņŚÉņä£ ļģĖņØĖ ĒÖśņ×ÉņŚÉņä£ ņØĖĻ│ĄņÖĆņÜ░ ņØ┤ņŗØņłĀņØ┤ ņØĖņ¦ĆĻĖ░ļŖźņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņŚÉ ļīĆĒĢ£ 6Ļ░£ņØś ņŚ░ĻĄ¼ļōżņØä ņĀĢļ”¼ĒĢśņśĆļŗż.
Ohta ļō▒[53]ņØĆ 21ļ¬ģņØś 65ņäĖ ņØ┤ņāü ĒÖśņ×ÉņŚÉņä£ ņØĖĻ│ĄņÖĆņÜ░ ņØ┤ņŗØņłĀ ņłśņłĀ ņĀä, ņłśņłĀ Ēøä 1ļģä, 2ļģäĻ╣īņ¦Ć Mini-Mental State Examination (MMSE)ņ£╝ļĪ£ ņØĖņ¦ĆĻĖ░ļŖźņØä ĒÅēĻ░ĆĒĢśņśĆņØä ļĢī, ņØīņä▒ ņāØņä▒ (speech production)ņØĆ ņØĖĻ│ĄņÖĆņÜ░ ņØ┤ņŗØņłĀ ņØ┤Ēøä ņØĖņ¦ĆĻĖ░ļŖź Ē¢źņāüņØä ņ£äĒĢ┤ ņżæņÜöĒĢśļ®░, ņØĖņ¦ĆĻĖ░ļŖźņØś Ē¢źņāüņØĆ ņØĖĻ│ĄņÖĆņÜ░ ņØ┤ņŗØņłĀ ņØ┤Ēøä 1ļģäņ¦Ė ņĄ£Ļ│ĀņĀÉņŚÉ ņØ┤ļź┤Ļ▓ī ļÉ©ņØä ļ│┤Ļ│ĀĒĢśņśĆļŗż. ļ╣äļĪØ ļģĖņØĖ ĒÖśņ×ÉņŚÉņä£ Ļ│Āņŗ¼ļÅäņØś ļé£ņ▓ŁņØ┤ ņØĖņ¦ĆĻĖ░ļŖź ņĀĆĒĢśļź╝ ņĢģĒÖöņŗ£Ēéżņ¦Ćļ¦ī, ņØĖĻ│ĄņÖĆņÜ░ ņØ┤ņŗØņłĀņØĆ MMSE ņĀÉņłśĻ░Ć ņĄ£Ļ│ĀņĀÉņØĖ 1ļģä Ēøä(ņ”ē, ņØĖĻ│ĄņÖĆņÜ░ ņØ┤ņŗØņłĀ ņØ┤Ēøä 2ļģäņ¦Ė) Ļ░ÉņåīĒĢśļŹöļØ╝ļÅä ņØĖņ¦Ć ĻĖ░ļŖźņŚÉ ĻĖŹņĀĢņĀüņØĖ ņśüĒ¢źņØä ļ»Ėņ╣£ļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŗż[53]. ļśÉĒĢ£, ņ▓ŁĻ░üņŚÉ ĻĖ░ļ░śĒĢśņŚ¼ ļŗżļźĖ ņé¼ļ×īļōżĻ│╝ ļīĆĒÖöĒĢśļŖö Ļ▓āņØĆ ņØĖņ¦ĆĻĖ░ļŖźņØä Ē¢źņāüņŗ£ĒéżĻĖ░ ņ£äĒĢ┤ ļ¦żņÜ░ ņżæņÜöĒĢśļ®░, ļŗ©ņł£Ē׳ ņ▓ŁĻ░ü ņłśņżĆĻ│╝ ņØīņä▒ ņØĖņŗØ(speech recognition)ņØ┤ Ē¢źņāüļÉśļŖö Ļ▓āļ¦īņ£╝ļĪ£ļŖö ļČĆņĪ▒ĒĢ©ņØä ņŗ£ņé¼ĒĢśņśĆļŗż. ļö░ļØ╝ņä£, Ļ│ĀļĀ╣ņØś ņØĖĻ│ĄņÖĆņÜ░ ņØ┤ņŗØņłĀ ĒÖśņ×ÉņŚÉņä£ ņ▓ŁĻ░üļ│┤ņāüņØä ĻĖ░ļ░śņ£╝ļĪ£ ĒĢ£ ļīĆĒÖöļŖźļĀź Ē¢źņāüņØä ļ¬®Ēæ£ļĪ£ ĒĢ£ ņ×¼ĒÖ£ņØ┤ ņ╣śļ¦ż ņśłļ░®ņØś ĒĢĄņŗ¼ ņĀäļץņØ┤ ļÉĀ Ļ▓āņØ┤ļŗż[53].
65ņäĖ ņØ┤ņāüņØś Ļ│ĀļĀ╣ ņØĖĻ│ĄņÖĆņÜ░ ņØ┤ņŗØņłĀ ĒÖśņ×É 70ļ¬ģņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£, Ļ▓ĮļÅäņØĖņ¦ĆņןņĢĀ(mild cognitive impairment) ĒÖĢļźĀņØĆ 45%ļĪ£[44], Ļ░ÖņØĆ ļéśņØ┤ņØś ņØ╝ļ░śņØĖņØ┤ 3%-19%ņØĖ Ļ▓āņŚÉ ļ╣äĒĢ┤ ļåÆņĢśĻ│Ā[54], ņØĖĻ│ĄņÖĆņÜ░ ņØ┤ņŗØņłĀ Ēøä ņ▓ŁĻ░üņ×¼ĒÖ£ņØ┤ ņØśņé¼ņåīĒåĄ, ņéČņØś ņ¦ł, ņØĖņ¦ĆĻĖ░ļŖź Ē¢źņāüņŚÉ ĻĖŹņĀĢņĀü ĒÜ©Ļ│╝ļź╝ ļ│┤ņŚ¼ ņ╣śļ¦żļĪ£ņØś ņØ┤Ē¢ēņØ┤ ņżäņ¢┤ļō”ņØä ļ│┤ņŚ¼ņŻ╝ņŚłļŗż. ņØ┤ļŖö ļé£ņ▓ŁņŚÉ ņØśĒĢ£ Ļ▓ĮļÅäņØĖņ¦ĆņןņĢĀļŖö ņØĖņ¦ĆĻĖ░ļŖźņŚÉ ņ׳ņ¢┤ ņ▓ŁĻ░üņ×¼ĒÖ£ņŚÉ ņØśĒĢ┤ ĻĖŹņĀüņĀü ĒÜ©Ļ│╝ļź╝ Ļ░¢ļŖö ņĢäĒśĢ(subtype)ņØ╝ Ļ▓āņØ┤ļØ╝ļŖö Ļ░ĆņĀĢņØä ĒĢĀ ņłś ņ׳ļŗż[44]. ļö░ļØ╝ņä£, ĒŖ╣Ē׳ Ļ▓ĮļÅäņØĖņ¦ĆņןņĢĀļź╝ Ļ░Ćņ¦ĆļŖö Ļ│Āņŗ¼ļÅäņØś ļé£ņ▓Ł ĒÖśņ×ÉņŚÉņä£ ņ¦Ćņ▓┤ ņŚåņØ┤ ņØĖĻ│ĄņÖĆņÜ░ ņłśņłĀņØä ņĀ£ņĢłĒĢśļŖö ņżæņÜöņä▒ņØä Ļ░ĢņĪ░ĒĢśĻ│Ā ņ׳ļŗż[44]. ļö░ļØ╝ņä£, ņŗ¼ļÅäņØś ļé£ņ▓ŁņØä Ļ░Ćņ¦ä ļģĖņØĖ ĒÖśņ×ÉņŚÉņä£ Ļ▓ĮļÅäņØĖņ¦ĆņןņĢĀņÖĆ Ļ░ÖņØĆ cognitive syndromeņØä ĒŖ╣ņĀĢ ņ¦ĆņØä ņłś ņ׳ļŖö ļ░öņØ┤ņśżļ¦łņ╗żļéś ņŗĀĻ▓ĮĒĢÖņĀü ņśüņāüĻ▓Ćņé¼(neuroimaging) Ļ░ÖņØĆ ņČöĻ░ĆņĀü Ļ▓Ćņé¼Ļ░Ć ĒĢäņÜöĒĢĀ Ļ▓āņØ┤Ļ│Ā ĒŖ╣Ē׳, Ļ▓ĮļÅäņØĖņ¦Ć ņןņĢĀņÖĆ Ļ░ÖņØĆ ņØĖņ¦ĆĻĖ░ļŖź ņĀĆĒĢśĻ░Ć ņ׳ļŖö ĒÖśņ×ÉņØś Ļ▓ĮņÜ░ ņØĖĻ│ĄņÖĆņÜ░ ņØ┤ņŗØņłĀņØä ĒåĄĒĢ┤ ņØĖņ¦ĆĻĖ░ļŖź ņĀĆĒĢśļź╝ ņŚŁņĀäņŗ£ņ╝£ ņ╣śļ¦żļĪ£ņØś ņØ┤ĒÖśņØä ņśłļ░®ĒĢĀ ņłś ņ׳ņØä Ļ▓āņØ┤ļŗż[44].
ņ£äņÖĆ Ļ░ÖņØĆ ļ¦ÄņØĆ ņŚ░ĻĄ¼ļōżņŚÉņä£ ņØĖĻ│ĄņÖĆņÜ░ ņØ┤ņŗØņłĀ ņØ┤Ēøä ņØĖņ¦ĆĻĖ░ļŖźņØ┤ Ē¢źņāüļÉ©ņŚÉ ļīĆĒĢ£ ļ¬ģļ░▒ĒĢ£ Ļ▓░Ļ│╝ļź╝ ņ¢╗ņŚłļŗż. ĻĘĖļ¤¼ļéś ņŚ¼ņĀäĒ׳ ļé©ļŖö ņØśļ¼ĖņØĆ ņØĖĻ│ĄņÖĆņÜ░ ņØ┤ņŗØņłĀ ņØ┤ĒøäņØś ņØĖņ¦ĆņĀü Ļ░£ņäĀņØ┤ ņ▓ŁĻ░üĻ│╝ Ļ┤ĆļĀ©ļÉ£ ņØĖņ¦ĆņĀü ņĀĆĒĢśļź╝ ņÖäņĀäĒ׳ ņŚŁņĀäņŗ£Ēé¼ ņłś ņ׳ņØä ļ¦īĒü╝ ņČ®ļČäĒ׳ Ēü░ ņ¦Ć ņŚ¼ļČĆņŚÉ ļīĆĒĢ£ ĒĢĄņŗ¼ ņØśļ¼Ėņ£╝ļĪ£ ļé©ņĢä ņ׳ļŗż. ņØ┤ļ¤░ ņØśļ¼ĖņØĆ ņØĖĻ│ĄņÖĆņÜ░ ņØ┤ņŗØņłĀ ņØ┤Ēøä ļé£ņ▓Ł ĒÖśņ×ÉļōżņØä ņŚ░ļĀ╣ņØ┤ ļ¦żņ╣śļÉ£ ņĀĢņāü ņ▓ŁļĀźņØś ļīĆņĪ░ĻĄ░Ļ│╝ņØś ļ╣äĻĄÉļź╝ ĒåĄĒĢ┤ ĒĢ┤Ļ▓░ĒĢĀ ņłś ņ׳ļŗż[55]. ļśÉĒĢ£, ņØĖņ¦ĆĻĖ░ļŖź Ļ▓Ćņé¼ ņżæ ņØ╝ļČĆ ĒĢŁļ¬®ļōżņØĆ ņ¦Ćņŗ£ļ¼ĖņØ┤ļéś ņłśĒ¢ēĻ│╝ņĀĢņØ┤ ņ▓ŁĻ░üņĀü Ēæ£Ēśäņ£╝ļĪ£ ļÉśņ¢┤ņ׳Ļ▒░ļéś, Ļ▓Ćņé¼ ņłśĒ¢ēĻ│╝ņĀĢņŚÉņä£ ĻĄ¼ņ¢┤ļź╝ ļ░śļ│ĄĒĢśļŖö ļō▒ ņ▓ŁĻ░üņŚÉ ņØśņĪ┤ĒĢ┤ņĢ╝ ĒĢśļŖö ņ¢Ėņ¢┤ Ļ│╝ņĀ£ņØ┤ĻĖ░ ļĢīļ¼ĖņŚÉ, ļé£ņ▓Łņ£╝ļĪ£ ņØĖĒĢ┤ Ļ▓Ćņé¼ ņłśĒ¢ēņØ┤ ņ¢┤ļĀżņøī ļé£ņ▓ŁņØĖņŚÉņä£ ņØĖņ¦ĆĻĖ░ļŖźņØ┤ ņĀĆĒÅēĻ░ĆļÉśļŖö Ļ▓ĮņÜ░ļōżņØ┤ ņ׳ļŗż. ņØ┤ļĀćĻ▓ī ņ▓ŁĻ░üņĀü Ēæ£ĒśäņŚÉ ņØśņĪ┤ĒĢśļŖö ņØĖņ¦ĆĻĖ░ļŖź Ļ▓Ćņé¼ņŚÉņä£ ņØĖĻ│ĄņÖĆņÜ░ ņØ┤ņŗØņłĀ ņØ┤Ēøä Ļ┤Ćņ░░ļÉ£ ļ│ĆĒÖöļŖö ļŗ©ņł£Ē׳ ņØĖņ¦ĆņØś Ē¢źņāüņŚÉ ņØśĒĢ£ļŗżĻĖ░ ļ│┤ļŗżļŖö ņ▓ŁļĀźĻ░£ņäĀņØś Ļ▓░Ļ│╝ņØ╝ ņłś ņ׳ļŗż[55]. ņ▓ŁļĀźĻ░£ņäĀņŚÉ ņØśĒĢ£ ņØĖņ¦ĆĻĖ░ļŖź Ē¢źņāü ĒÜ©Ļ│╝ļź╝ ļ░░ņĀ£ĒĢśĻĖ░ ņ£äĒĢ┤ņä£ļŖö ņ▓ŁļĀźņŚÉ ņØśņĪ┤ĒĢśņ¦Ć ņĢŖļŖö ņØĖņ¦ĆĻĖ░ļŖź Ļ▓Ćņé¼ļéś, ĻĖ░ņĪ┤ Ļ▓Ćņé¼ņØś ļ│ĆĒśĢņØ┤ ĒĢäņÜöĒĢĀ Ļ▓āņØ┤ļŗż.
2021ļģä Huber ļō▒[55]ņØĆ ļéśņØ┤, ņä▒ļ│ä, ĻĄÉņ£Ī ņĀĢļÅäļź╝ ļ¦żņ╣ŁĒĢ£ ņĀĢņāü ņ▓ŁļĀźĻĄ░Ļ│╝ņØś ļ╣äĻĄÉļź╝ ĒåĄĒĢ┤, ņØĖĻ│ĄņÖĆņÜ░ ņØ┤ņŗØņłĀ ņĀäĻ│╝ ņłśņłĀ Ēøä 12Ļ░£ņøöņ¦Ė ņØĖņ¦ĆĻĖ░ļŖź ņłśĒ¢ēņØä ĒÅēĻ░ĆĒĢśņśĆļŗż. ņØ┤ ņŚ░ĻĄ¼ņŚÉņä£, ņĀĢņāü ņ▓ŁļĀźĻĄ░Ļ│╝ ļ╣äĻĄÉĒĢśņŚ¼ ĒÖĢņŚ░ĒĢ£ ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ļŖö ņØ╝ļČĆņØś ĒŖ╣ņĀĢ ņØĖņ¦Ć ĻĖ░ņłĀļ¦īņØ┤ ņØĖĻ│ĄņÖĆņÜ░ ņØ┤ņŗØņłĀ Ēøä ļ│┤ņāüļÉĀ ņłś ņ׳ņŚłļŗż. ņĀĢņāü ņ▓ŁļĀźĻĄ░Ļ│╝ ļÅÖļō▒ĒĢ£ Ļ▓░Ļ│╝ļŖö Ļ│äĒÜŹ(planning), ņĪ░ņĀĢ(coordination), ņŻ╝ņØśļĀź ņĪ░ņĀł(attentional control)ņØä ĒĢäņÜöļĪ£ ĒĢśļŖö ņØĖņ¦Ć Ļ│╝ņŚģņØ┤ņŚłļŗż. ņ¦ĆņŚ░ ĒÜīņāü(delayed recall), ņ¢Ėņ¢┤ņä▒ ĻĖ░ņ¢ĄĒÜīņāü(verbal retrieval), ņ¢ĄņĀ£(inhibition), ņØĖņ¦ĆņĀü ņ£ĀņŚ░ņä▒(cognitive flexibility)ņØä Ļ░ĢņĪ░ĒĢśļŖö ņØĖņ¦ĆņĀü Ļ│╝ņŚģņØś ņłśĒ¢ēņØĆ ņØĖĻ│ĄņÖĆņÜ░ ņØ┤ņŗØņłĀ ĒÖśņ×ÉņŚÉņä£ ļŹö ņŚ┤ļō▒ĒĢśņśĆļŗż[55]. ļśÉĒĢ£, ņØĖņ¦Ć ĻĖ░ļŖźņØś Ē¢źņāüņØĆ ņłśņłĀ Ēøä 12Ļ░£ņøöņØ┤ ņĢäļŗī 3Ļ░£ņøöņ¦Ė ņØīņä▒ ņØĖņŗØ(speech recognition) Ļ▓░Ļ│╝ņÖĆ Ļ┤ĆļĀ©ņØ┤ ņ׳ņŚłļŗż[55].
Ļ▓░ļĪĀļģĖņØĖņŚÉņä£ ļé£ņ▓ŁĻ│╝ ņØĖņ¦ĆĻĖ░ļŖź ņĀĆĒĢśļŖö ļåÆņØĆ Ļ┤ĆļĀ©ņä▒ņØä Ļ░Ćņ¦äļŗż. ļśÉĒĢ£, ļģĖĒÖöņä▒ ļé£ņ▓ŁņØĆ ņØĖņ¦ĆĻĖ░ļŖź ņĀĆĒĢś ļ░Å ņ╣śļ¦żņØś ņżæņÜöĒĢ£ ņ£äĒŚśņÜöņØĖņ£╝ļĪ£ ņ×æņÜ®ĒĢśĻĖ░ ļĢīļ¼ĖņŚÉ, ļ│┤ņ▓ŁĻĖ░ļéś ņØĖĻ│ĄņÖĆņÜ░ ļō▒ņØä ĒåĄĒĢ£ ņ▓ŁĻ░üņĀü ņ×¼ĒÖ£ņØ┤ ņ╣śļ¦żļź╝ ņśłļ░®ĒĢĀ ņłś ņ׳ļŖö ļīĆņĢłņØ┤ ļÉĀ ņłś ņ׳ļŗż. ĒŖ╣Ē׳ Ļ│Āņŗ¼ļÅä ņØ┤ņāüņØś ļé£ņ▓ŁņØä Ļ░Ćņ¦ä ļģĖņØĖ ĒÖśņ×ÉņŚÉņä£ ņØĖĻ│ĄņÖĆņÜ░ ņłśņłĀņØĆ ņ▓ŁĻ░üņĀü ņłśĒ¢ēļĀźņØä ļåÆņØ╝ ņłś ņ׳ļŖö ĒÜ©Ļ│╝ņĀüņØĖ ņ▓ŁĻ░üņ×¼ĒÖ£ ļ░®ļ▓ĢņØ┤ļŗż. ļģĖņØĖĒÖśņ×ÉņŚÉņä£ ņØĖĻ│ĄņÖĆņÜ░ ņłśņłĀ Ēøä ņ▓ŁĻ░üņ×¼ĒÖ£ņØ┤ ņØĖņ¦ĆĻĖ░ļŖź Ē¢źņāüņŚÉ ĻĖŹņĀĢņĀü ĒÜ©Ļ│╝ļź╝ ļ│┤ņŚ¼ ņ╣śļ¦żļĪ£ņØś ņØ┤Ē¢ēņØ┤ ņżäņ¢┤ļōż Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż. ĒŖ╣Ē׳, ņŗ¼Ļ│ĀļÅäņØś ļé£ņ▓ŁņØä Ļ░Ćņ¦ä ļģĖņØĖ ĒÖśņ×ÉņŚÉņä£ ļ░öņØ┤ņśżļ¦łņ╗żļéś ņŗĀĻ▓ĮĒĢÖņĀü ņśüņāüĻ▓Ćņé¼ ļō▒ņØä ĒåĄĒĢ£ Ļ▓ĮļÅäņØś ņØĖņ¦ĆĻĖ░ļŖź ņןņĢĀņÖĆ Ļ░ÖņØĆ ņØĖņ¦ĆĻĖ░ļŖź ņĀĆĒĢśļź╝ ņĪ░ĻĖ░ņŚÉ ļ░£Ļ▓¼ĒĢśņŚ¼, ņØĖĻ│ĄņÖĆņÜ░ Ļ░ÖņØĆ ņóĆ ļŹö ņĀüĻĘ╣ņĀüņØĖ ņłśņłĀņĀü ņ╣śļŻīļź╝ ĒåĄĒĢ┤ ņØĖņ¦ĆĻĖ░ļŖź ņĀĆĒĢśļź╝ ņŚŁņĀäņŗ£ņ╝£ ņ╣śļ¦żļĪ£ņØś ņØ┤Ē¢ēņØä Ļ░Éņåīņŗ£Ēé¼ ņłś ņ׳ņØä Ļ▓āņØ┤ļŗż. ņĢ×ņ£╝ļĪ£ ņóĆ ļŹö ņ▓ŁĻ░üņĀü ņśüĒ¢źļĀźņØä ļ░░ņĀ£ĒĢ£ ņØĖņ¦ĆĻĖ░ļŖź Ļ▓Ćņé¼ņÖĆ ņśżļ×£ Ļ▓ĮĻ│╝ Ļ┤Ćņ░░ ĻĖ░Ļ░äņØä Ļ░Ćņ¦ĆļŖö ņל ļööņ×ÉņØĖļÉ£ ņŚ░ĻĄ¼ļź╝ ĒåĄĒĢ┤ ņØĖĻ│ĄņÖĆņÜ░ ņłśņłĀņØ┤ ņØĖņ¦ĆĻĖ░ļŖźņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņØä ņóĆ ļŹö ņ▓┤Ļ│äņĀüņ£╝ļĪ£ ļČäņäØĒĢĀ ņłś ņ׳ņØä Ļ▓āņØ┤ļŗż.
ACKNOWLEDGMENTSThis work was supported by the National Research Foundation of Korea (NRF) grant funded by the Korea government (MSIT) (No.NRF-2020R1A2C2102660).
Fig.┬Ā1.Conceptual model of the association of age-related hearing loss with cognitive decline. Adapted from Chung. Korean J Otorhinolaryngol-Head Neck Surg 2020;63(4):145-53[9]. 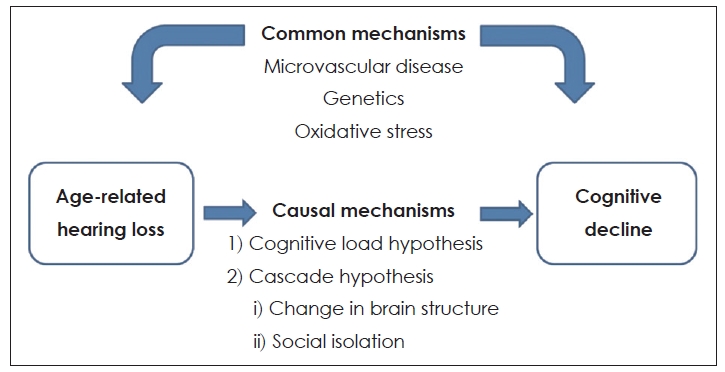
Table┬Ā1.Summary of the studies showing the association between hearing loss and cognitive decline
CI, confidence interval; HR, hazard ratio; 3MS, Modified Mini-Mental State Examination; OR, odds ratio; DSM-IV, Diagnostic and Statistical Manual of Mental Disorders-IV; PTA, puretone average threshold; MMSE, Mini-Mental State Examination; ABC, Aging, and Body Composition; CVS, Health ABC Cognitive Vitality Substudy; HI, heairng impiarment Table┬Ā2.Summary of studies that demonstrated the impact of CI on cognition in elderly
CI, cochlear implantation; CODEX, Cognitive Disorders Examination; MoCA, Montreal Cognitive Assessment; GDS, Geriatric Depression Scale; NH, normal hearing; WASI, Wechsler Abbreviated Scale of Intelligence; TMT, Trail Making Test; RBANS, Repeatable Battery for the Assessment of Neuropsychological Status; CANTAB, Cambridge Neuropsychological Test Automated Battery; MMSE, Mini-Mental State Examination; CDT, clock-drawing test; FWT, 5-word test REFERENCES1. Cruickshanks KJ, Wiley TL, Tweed TS, Klein BE, Klein R, Mares-Perlman JA, et al. Prevalence of hearing loss in older adults in Beaver Dam, Wisconsin. The epidemiology of hearing loss study. Am J Epidemiol 1998;148(9):879-86.
2. Korea Centers for Disease Control and Prevention. The Eighth Korea National Health and Nutrition Examination Survey (KNHANES VIII). 2021 Dec [cited 2021 Dec 1]. https://knhanes.kdca.go.kr/knhanes/sub04/sub04_04_03.do.
3. Lin FR, Metter EJ, OŌĆÖBrien RJ, Resnick SM, Zonderman AB, Ferrucci L. Hearing loss and incident dementia. Arch Neurol 2011;68(2):214-20.
4. Lin FR, Yaffe K, Xia J, Xue QL, Harris TB, Purchase-Helzner E, et al. Hearing loss and cognitive decline in older adults. JAMA Intern Med 2013;173(4):293-9.
5. Gallacher J, Ilubaera V, Ben-Shlomo Y, Bayer A, Fish M, Babisch W, et al. Auditory threshold, phonologic demand, and incident dementia. Neurology 2012;79(15):1583-90.
6. Amieva H, Ouvrard C, Giulioli C, Meillon C, Rullier L, Dartigues JF. Self-reported hearing loss, hearing aids, and cognitive decline in elderly adults: A 25-year study. J Am Geriatr Soc 2015;63(10):2099-104.
7. Deal JA, Betz J, Yaffe K, Harris T, Purchase-Helzner E, Satterfield S, et al. Hearing impairment and incident dementia and cognitive decline in older adults: The health ABC study. J Gerontol A Biol Sci Med Sci 2017;72(5):703-9.
8. Davis A, McMahon CM, Pichora-Fuller KM, Russ S, Lin F, Olusanya BO, et al. Aging and hearing health: The life-course approach. Gerontologist 2016;56(Suppl 2):S256-67.
9. Chung J. Association of age-related hearing loss with cognitive decline. Korean J Otorhinolaryngol-Head Neck Surg 2020;63(4):145-53.
10. Livingston G, Huntley J, Sommerlad A, Ames D, Ballard C, Banerjee S, et al. Dementia prevention, intervention, and care: 2020 report of the Lancet Commission. Lancet 2020;396(10248):413-46.
11. Livingston G, Sommerlad A, Orgeta V, Costafreda SG, Huntley J, Ames D, et al. Dementia prevention, intervention, and care. Lancet 2017;390(10113):2673-734.
12. van Hooren SA, Anteunis LJ, Valentijn SA, Bosma H, Ponds RW, Jolles J, et al. Does cognitive function in older adults with hearing impairment improve by hearing aid use? Int J Audiol 2005;44(5):265-71.
13. Valentijn SA, van Boxtel MP, van Hooren SA, Bosma H, Beckers HJ, Ponds RW, et al. Change in sensory functioning predicts change in cognitive functioning: Results from a 6-year follow-up in the maastricht aging study. J Am Geriatr Soc 2005;53(3):374-80.
14. Loughrey DG, Kelly ME, Kelley GA, Brennan S, Lawlor BA. Association of age-related hearing loss with cognitive function, cognitive impairment, and dementia: A systematic review and meta-analysis. JAMA Otolaryngol Head Neck Surg 2018;144(2):115-26.
15. Wei J, Hu Y, Zhang L, Hao Q, Yang R, Lu H, et al. Hearing impairment, mild cognitive impairment, and dementia: A meta-analysis of cohort studies. Dement Geriatr Cogn Dis Extra 2017;7(3):440-52.
16. Ford AH, Hankey GJ, Yeap BB, Golledge J, Flicker L, Almeida OP. Hearing loss and the risk of dementia in later life. Maturitas 2018;112:1-11.
17. Foster SM, Davis HP, Kisley MA. Brain responses to emotional images related to cognitive ability in older adults. Psychol Aging 2013;28(1):179-90.
18. Gurgel RK, Ward PD, Schwartz S, Norton MC, Foster NL, Tschanz JT. Relationship of hearing loss and dementia: A prospective, population-based study. Otol Neurotol 2014;35(5):775-81.
19. Quaranta N, Coppola F, Casulli M, Barulli O, Lanza F, Tortelli R, et al. The prevalence of peripheral and central hearing impairment and its relation to cognition in older adults. Audiol Neurootol 2014;19(suppl 1):10-4.
20. Golub JS, Luchsinger JA, Manly JJ, Stern Y, Mayeux R, Schupf N. Observed hearing loss and incident dementia in a multiethnic cohort. J Am Geriatr Soc 2017;65(8):1691-7.
21. Miller G, Miller C, Marrone N, Howe C, Fain M, Jacob A. The impact of cochlear implantation on cognition in older adults: A systematic review of clinical evidence. BMC Geriatr 2015;15:16.
22. Wayne RV, Johnsrude IS. A review of causal mechanisms underlying the link between age-related hearing loss and cognitive decline. Ageing Res Rev 2015;23(Pt B):154-66.
23. Tun PA, McCoy S, Wingfield A. Aging, hearing acuity, and the attentional costs of effortful listening. Psychol Aging 2009;24(3):761-6.
24. Martini A, Castiglione A, Bovo R, Vallesi A, Gabelli C. Aging, cognitive load, dementia and hearing loss. Audiol Neurootol 2014;19(suppl 1):2-5.
25. Chern A, Golub JS. Age-related hearing loss and dementia. Alzheimer Dis Assoc Disord 2019;33(3):285-90.
26. Uchida Y, Sugiura S, Nishita Y, Saji N, Sone M, Ueda H. Age-related hearing loss and cognitive decline - The potential mechanisms linking the two. Auris Nasus Larynx 2019;46(1):1-9.
27. Peelle JE, Troiani V, Grossman M, Wingfield A. Hearing loss in older adults affects neural systems supporting speech comprehension. J Neurosci 2011;31(35):12638-43.
28. Eckert MA, Cute SL, Vaden KI Jr, Kuchinsky SE, Dubno JR. Auditory cortex signs of age-related hearing loss. J Assoc Res Otolaryngol 2012;13(5):703-13.
29. Mick P, Kawachi I, Lin FR. The association between hearing loss and social isolation in older adults. Otolaryngol Head Neck Surg 2014;150(3):378-84.
30. Dawes P, Emsley R, Cruickshanks KJ, Moore DR, Fortnum H, Edmondson-Jones M, et al. Hearing loss and cognition: The role of hearing AIDS, social isolation and depression. PLoS One 2015;10(3):e0119616.
31. Sugawara N, Sasaki A, Yasui-Furukori N, Kakehata S, Umeda T, Namba A, et al. Hearing impairment and cognitive function among a community-dwelling population in Japan. Ann Gen Psychiatry 2011;10(1):27.
32. Amieva H, Ouvrard C, Meillon C, Rullier L, Dartigues JF. Death, depression, disability, and dementia associated with self-reported hearing problems: A 25-year study. J Gerontol A Biol Sci Med Sci 2018;73(10):1383-9.
33. Rutherford BR, Brewster K, Golub JS, Kim AH, Roose SP. Sensation and psychiatry: Linking age-related hearing loss to latelife depression and cognitive decline. Am J Psychiatry 2018;175(3):215-24.
34. Kiely KM, Anstey KJ, Luszcz MA. Dual sensory loss and depressive symptoms: The importance of hearing, daily functioning, and activity engagement. Front Hum Neurosci 2013;7:837.
35. Panza F, Lozupone M, Sardone R, Battista P, Piccininni M, Dibello V, et al. Sensorial frailty: Age-related hearing loss and the risk of cognitive impairment and dementia in later life. Ther Adv Chronic Dis 2018;10:2040622318811000.
36. Jayakody DMP, Friedland PL, Martins RN, Sohrabi HR. Impact of aging on the auditory system and related cognitive functions: A narrative review. Front Neurosci 2018;12:125.
37. Haensel J, Ilgner J, Chen YS, Thuermer C, Westhofen M. Speech perception in elderly patients following cochlear implantation. Acta Otolaryngol 2005;125(12):1272-6.
38. Kelsall DC, Shallop JK, Burnelli T. Cochlear implantation in the elderly. Am J Otol 1995;16(5):609-15.
39. Chatelin V, Kim EJ, Driscoll C, Larky J, Polite C, Price L, et al. Cochlear implant outcomes in the elderly. Otol Neurotol 2004;25(3):298-301.
40. Vermeire K, Brokx JP, Wuyts FL, Cochet E, Hof kens A, Van de Heyning PH. Quality-of-life benefit from cochlear implantation in the elderly. Otol Neurotol 2005;26(2):188-95.
41. Budenz CL, Cosetti MK, Coelho DH, Birenbaum B, Babb J, Waltzman SB, et al. The effects of cochlear implantation on speech perception in older adults. J Am Geriatr Soc 2011;59(3):446-53.
42. Lenarz M, S├Čnmez H, Joseph G, B├╝chner A, Lenarz T. Cochlear implant performance in geriatric patients. Laryngoscope 2013;122(6):1361-5.
43. Amin N, Wong G, Nunn T, Jiang D, Pai I. The outcomes of cochlear implantation in elderly patients: A single United Kingdom center experience. Ear Nose Throat J 2021;100(5_suppl):842S-7S.
44. Mosnier I, Vanier A, Bonnard D, Lina-Granade G, Truy E, Bordure P, et al. Long-term cognitive prognosis of profoundly deaf older adults after hearing rehabilitation using cochlear implants. J Am Geriatr Soc 2018;66(8):1553-61.
45. Wong DJ, Moran M, OŌĆÖLear y SJ. Outcomes af ter cochlear implantation in the very elderly. Otol Neurotol 2016;37(1):46-51.
46. Garcia-Iza L, Martinez Z, Ugarte A, Fernandez M, Altuna X. Cochlear implantation in the elderly: Outcomes, long-term evolution, and predictive factors. Eur Arch Otorhinolaryngol 2018;275(4):913-22.
47. Mosnier I, Bebear JP, Marx M, Fraysse B, Truy E, Lina-Granade G, et al. Improvement of cognitive function after cochlear implantation in elderly patients. JAMA Otolaryngol Head Neck Surg 2015;141(5):442-50.
48. Ambert-Dahan E, Routier S, Marot L, Bouccara D, Sterkers O, Ferrary E, et al. Cognitive evaluation of cochlear implanted adults using CODEX and MoCA screening tests. Otol Neurotol 2017;38(8):e282-4.
49. Castiglione A, Benatti A, Velardita C, Favaro D, Padoan E, Severi D, et al. Aging, cognitive decline and hearing loss: Effects of auditory rehabilitation and training with hearing aids and cochlear implants on cognitive function and depression among older adults. Audiol Neurootol 2016;21(1):21-8.
50. Cosetti MK, Pinkston JB, Flores JM, Friedmann DR, Jones CB, Roland JT Jr, et al. Neurocognitive testing and cochlear implantation: Insights into performance in older adults. Clin Interv Aging 2016;11:603-13.
51. Jayakody DMP, Friedland PL, Nel E, Martins RN, Atlas MD, Sohrabi HR, et al. Impact of cochlear implantation on cognitive functions of older adults: Pilot test results. Otol Neurotol 2017;38(8):e289-95.
52. Sonnet MH, Montaut-Verient B, Niemier JY, Hoen M, Ribeyre L, Parietti-Winkler C, et al. Cognitive abilities and quality of life after cochlear implantation in the elderly. Otol Neurotol 2017;38(8):e296-301.
53. Ohta Y, Imai T, Maekawa Y, Morihana T, Osaki Y, Sato T, et al. The effect of cochlear implants on cognitive function in older adults: A prospective, longitudinal 2-year follow-up study. Auris Nasus Larynx; In press 2021.
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 |
 |