 |
 |
AbstractBackground and Objectives Chronic suppurative otitis media (CSOM) is one of the common diseases in otolaryngology, and it is important to know the species of pathogens and antibiotic susceptibility for its appropriate treatment. Methicillin-resistant Staphylococcus aureus (MRSA) infections have increased, and pathogenic bacteria and antibiotic resistance are changing along with the inappropriate use and overuse of antibiotics. The aim of this study is to investigate the current bacterial profile and antimicrobial susceptibility patterns of CSOM.
Subjects and Method We retrospectively investigated the bacteriological results of chronic otitis media with otorrhea in 272 outpatients who visited the department of otolaryngology from January 2017 to July 2022.
Results A total of 272 cases were included in the study, of which 245 (90.1%) were diagnosed with CSOM without cholesteatoma and 27 (9.9%) were diagnosed with CSOM with cholesteatoma. Out of the total, 131 (48.2%) were male patients and 141 (51.8%) were female patients with a mean age of 60.0┬▒14.93 years. Microbial growth was observed in 220 (80.9%) samples, but 17 (6.3%) samples showed no growth. Among the samples that showed growth, 184 (67.6%) were monomicrobial and 71 (26.1%) were polymicrobial. A total of 277 isolates were identified. The most common pathogenic organism was MRSA (23.1%), followed by Pseudomonas aeruginosa (19.5%), methicillin-sensitive Staphylococcus aureus (19.1%), and coagulasenegative staphylococci (8.3%). MRSA was highly susceptible to vancomycin, linezolid, teicoplanin (100%), sulfamethoxazole/trimethoprim, rifampin (over 96%). P. aeruginosa showed highest susceptibility to ceftazidime (100%), then cefepime (96.3%) and imipenem & amikacin (92.6%), and was most resistant to ticarcillin/clavulanic acid (57.4%) and ciprofloxacin (64.8%).
ņä£ ļĪĀļ¦īņä▒ ņżæņØ┤ņŚ╝ņØĆ ņżæņØ┤Ļ░Ģ ļé┤(ņØ┤Ļ┤Ć, ņżæņØ┤ ļ░Å ņ£Āņ¢æļÅīĻĖ░)ņŚÉ ļ╣äĻ░ĆņŚŁņĀü ļ│ĆĒÖöļź╝ ļÅÖļ░śĒĢśļŖö ņŚ╝ņ”Øņä▒ ņ¦łĒÖśņ£╝ļĪ£ ņĀĢņØśļÉśļ®░, ņØ┤ļŻ©ļź╝ ņŻ╝ņåīļĪ£ ņØ┤ļ╣äņØĖĒøäĻ│╝ ņÖĖļלņŚÉ ļé┤ņøÉĒĢśļŖö ĒÖśņ×ÉļōżņØś ļīĆĒæ£ņĀüņØĖ ņ¦łĒÖśņØ┤ļŗż.
2010ļģäļČĆĒä░ 2012ļģäĻ╣īņ¦ĆņØś ĻĄŁļ»╝Ļ▒┤Ļ░Ģņśüņ¢æņĪ░ņé¼ Ļ▓░Ļ│╝ņŚÉņä£ ļ¦īņä▒ ņżæņØ┤ņŚ╝ņØś ņ£Āļ│æļźĀņØĆ 20ņäĖ ņØ┤ņāüņŚÉņä£ 3.8%ļĪ£ ĒÖĢņØĖļÉśņŚłļŗż[1]. ĻĘ╝ 5ļģäĻ░ä(2017-2021ļģä)ņØś ĻĄŁļ»╝Ļ▒┤Ļ░Ģļ│┤ĒŚśĻ│Ąļŗ© ņ×ÉļŻīļź╝ ņé┤ĒÄ┤ļ│┤ļ®┤ ŌĆśĻĘĆ ļ░Å ņ£Āņ¢æļÅīĻĖ░ņØś ņ¦łĒÖśŌĆÖņ£╝ļĪ£ ņ¦äļŻīļź╝ ļ░øņØĆ ņØĖņøÉ ņżæņŚÉņä£ 5ļ¬ģ ņżæ 1ļ¬ģņØ┤ ņżæņØ┤ņŚ╝ņ£╝ļĪ£ ņ¦äļŻīļź╝ ļ░øņĢśļŗż. ņżæņØ┤ņŚ╝ņØś ņ¦äļŻīņØĖņøÉņØĆ 2017ļģä 244ļ¦ī ļ¬ģņŚÉņä£ 2021ļģä 110ļ¦ī ļ¬ģņ£╝ļĪ£ ņżäņŚłņ£╝ļéś, ņ┤Ø ņ¦äļŻīļ╣äļŖö 2021ļģä 1094ņ¢Ą ņøÉņ£╝ļĪ£ ņżæņØ┤ņŚ╝ņ£╝ļĪ£ ņØĖĒĢ┤ ņŚ░Ļ░ä ņ£Āļ░£ļÉśļŖö ņé¼ĒÜīĻ▓ĮņĀ£ņĀü ļ╣äņÜ®ņØ┤ ņŚ¼ņĀäĒ׳ Ēü░ Ļ▓āņ£╝ļĪ£ ĒÖĢņØĖļÉ£ļŗż[2].
ļ¦īņä▒ ņżæņØ┤ņŚ╝ņØś ņøÉņØĖņØĆ ņäĖĻĘĀ Ēś╣ņØĆ ļ░öņØ┤ļ¤¼ņŖżņŚÉ ņØśĒĢ£ Ļ░ÉņŚ╝, ņØ┤Ļ┤ĆņØś ĒĢ┤ļČĆĒĢÖņĀü ļ░Å ĻĖ░ļŖźņĀü ĒŖ╣ņä▒, ņ£ĀņĀäņĀü ņÜöņØĖ, ĻĘĖļ”¼Ļ│Ā ĒÖśĻ▓ĮņĀü ņÜöņØĖņØ┤ ļ│ĄĒĢ®ņĀüņ£╝ļĪ£ ņŚ░Ļ┤ĆļÉśņ¢┤ ņ׳ļŗżĻ│Ā ņĢīļĀżņĀĖ ņ׳ļŗż. ņØ┤ņżæ ņØ┤Ļ┤Ć ĻĖ░ļŖźņןņĢĀņÖĆ ļ»ĖņāØļ¼╝ Ļ░ÉņŚ╝ņØ┤ Ļ░Ćņן ņżæņÜöĒĢ£ ņÜöņåīļĪ£, ņäĖĻĘĀņØĆ ļ╣äņØĖļæÉņŚÉņä£ ņØ┤Ļ┤ĆņØä ĒåĄĒĢ┤ ļśÉļŖö ņ▓£Ļ│ĄņØ┤ ņ׳ļŖö Ļ│Āļ¦ēņØä ĒåĄĒĢ┤ ņÖĖņØ┤ļÅäņŚÉņä£ ņżæņØ┤ļĪ£ ļÅäļŗ¼ĒĢĀ ņłś ņ׳ļŗż[3]. ļ¦īņä▒ ņżæņØ┤ņŚ╝ņØĆ ņŚ╝ņ”Ø ņĀ£Ļ▒░, ņ×¼ļ░£ ļ░®ņ¦Ć, ĒĢ®ļ│æņ”ØņØś ņśłļ░®ņØä ņ£äĒĢ┤ ņĀüĻĘ╣ņĀüņØĖ ņ╣śļŻīĻ░Ć ĒĢäņÜöĒĢśļ®░, ņÖĖņØ┤ļÅä, ņżæņØ┤Ļ░ĢņØś ņ▓ŁĻ▓░Ļ│╝ ņĀÉņØ┤ņĢĪĻ│╝ Ļ░ÖņØĆ ĻĄŁņåīņ╣śļŻīļź╝ ņŗ£ļÅäĒĢ┤ļ│╝ ņłś ņ׳ļŗż. ĻĄŁņåīņ╣śļŻīĻ░Ć ĒÜ©Ļ│╝ņĀüņØ┤ņ¦Ć ņĢŖņØä Ļ▓ĮņÜ░ ĒĢŁņāØņĀ£ņØś ņĀäņŗĀĒł¼ņŚ¼ ņÜöļ▓ĢņØ┤ ĒĢäņÜöĒĢśļ®░, ĒÜ©Ļ│╝ņĀüņØĖ ĒĢŁņāØņĀ£ ņé¼ņÜ®ņØĆ ļ¦īņä▒ ņżæņØ┤ņŚ╝ņØś ĒĢ®ļ│æņ”ØĻ│╝ ņ×¼ļ░£ņØä ņżäņØ┤Ļ│Ā ņĀüņĀłĒĢ£ ņ╣śļŻīļź╝ ņ£äĒĢ┤ ĒĢäņłśņĀüņØ┤ļŗż[4].
ĻĄŁļé┤ņÖĖ ļŗżņłśņØś ļģ╝ļ¼ĖļōżņŚÉņä£ Staphylococcus aureusņÖĆ Pseudomonas aeruginosaĻ░Ć ņŻ╝ņÜö ņøÉņØĖĻĘĀņ£╝ļĪ£ ļ░ØĒśĆņĪīņ£╝ļéś, ĻĄŁĻ░Ć ļ░Å ņ¦ĆņŚŁņŚÉ ļö░ļØ╝ ļÅÖņĀĢļÉśļŖö ĻĘĀņŻ╝ ļČäĒżņŚÉļŖö ņ░©ņØ┤Ļ░Ć ņ׳ļŗż[4-6]. ņØ┤ļŖö ņ¦ĆņŚŁļ│äļĪ£ ĒÖśĻ▓ĮņØ┤ļéś ņØĖĻĄ¼ ĻĄ¼ņä▒, ņØśļŻī ņĀ£ļÅä, ĒĢŁņāØņĀ£ ņé¼ņÜ® ņĀĢņ▒ģ ļō▒ņŚÉ ņ░©ņØ┤Ļ░Ć ņ׳ĻĖ░ ļĢīļ¼Ėņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż. ļö░ļØ╝ņä£ ļ¦īņä▒ ņżæņØ┤ņŚ╝ņØś ļ│æņøÉĻĘĀņŻ╝ ĻĄ¼ņä▒Ļ│╝ ĒĢŁņāØņĀ£ Ļ░Éņłśņä▒ņØä ĒÖĢņØĖĒĢśļŖö Ļ▓āņØĆ ĒĢ┤ļŗ╣ ņ¦ĆņŚŁņŚÉņä£ ņżæņØ┤ņŚ╝ ņ╣śļŻīņŚÉ ņĀüņĀłĒĢ£ ĒĢŁņāØņĀ£ ņäĀĒāØņØä ņ£äĒĢ┤ ņżæņÜöĒĢ£ ņĀĢļ│┤Ļ░Ć ļÉ£ļŗż. ĒŖ╣Ē׳ ĒĢŁņāØņĀ£ ļé┤ņä▒ĻĘĀņØĆ ļåÆņØĆ ņØ┤ĒÖśņ£© ļ░Å ņןĻĖ░ ņ╣śļŻīļĪ£ ņØĖĒĢ┤ ņØśļŻīļ╣ä ļ░Å ņé¼ĒÜīņĀü ļ╣äņÜ®ņØä ņ”ØĻ░Ćņŗ£ņ╝£ ļČĆļŗ┤ņØä ņĢ╝ĻĖ░ĒĢĀ ņłś ņ׳ņ¢┤ ļ¦īņä▒ ņżæņØ┤ņŚ╝ņØś ĻĘĀņŻ╝ņŚÉ ļīĆĒĢ£ ņĀĢĻĖ░ņĀüņØĖ ņŚģļŹ░ņØ┤ĒŖĖļŖö ĻŠĖņżĆĒ׳ ņ¦äĒ¢ēļÉśņ¢┤ņĢ╝ ĒĢĀ ĒĢäņÜöĻ░Ć ņ׳ļŗż.
ņØ┤ņŚÉ ļ│Ė ņŚ░ĻĄ¼ļŖö ļ¦īņä▒ ĒÖöļåŹņä▒ ņżæņØ┤ņŚ╝ņ£╝ļĪ£ ņ¦äļŗ©ļÉ£ ĒÖśņ×ÉņØś ņØ┤ļŻ©ņŚÉņä£ ņ▒äņĘ©ĒĢ£ ļ░░ņ¢æĻ▓░Ļ│╝ļź╝ ļ░öĒāĢņ£╝ļĪ£ ļ│æņøÉĻĘĀņŻ╝ņØś ĻĄ¼ņä▒(ļŗżņ¢æņä▒)ņØä ĒÖĢņØĖĒĢśĻ│Ā ĒĢŁņāØņĀ£ Ļ░Éņłśņä▒ņØä ĒÖĢņØĖĒĢśĻ│Āņ×É ĒĢśņśĆļŗż.
ļīĆņāü ļ░Å ļ░®ļ▓ĢņŚ░ĻĄ¼ ļīĆņāü2017ļģä 1ņøöļČĆĒä░ 2022ļģä 7ņøöĻ╣īņ¦Ć ņØ┤ļŻ©ļź╝ ņŻ╝ņåīļĪ£ 3ņ░© ņØśļŻīĻĖ░Ļ┤ĆņØś ņØ┤ļ╣äņØĖĒøäĻ│╝ ņÖĖļלļź╝ ļ░®ļ¼ĖĒĢśņŚ¼ ļ¦īņä▒ ņżæņØ┤ņŚ╝ņ£╝ļĪ£ ņ¦äļŗ© ļ░øņØĆ ĒÖśņ×É 272ļ¬ģņØä ļīĆņāüņ£╝ļĪ£ ĒøäĒ¢źņĀü ņØśļ¼┤ĻĖ░ļĪØ ņĪ░ņé¼ļź╝ ņŗ£Ē¢ēĒĢśņśĆļŗż. ņØ┤ļŻ©ņŚÉ ļīĆĒĢ£ ņäĖĻĘĀļ░░ņ¢æ Ļ▓Ćņé¼ ļ░Å ĒĢŁņāØņĀ£ Ļ░Éņłśņä▒ Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢ£ ĒÖśņ×ÉļōżņØś ņŚ░ļĀ╣, ņä▒ļ│ä, ĻĖ░ņĀĆņ¦łĒÖś, ņ¦äņŻ╝ņóģņØś ļÅÖļ░śņŚ¼ļČĆ, ņØ┤ĒÖśļÉ£ ĻĘĆņØś ļ░®Ē¢ź, ņØ┤Ļ│╝ņĀü ņłśņłĀņØś Ļ│╝Ļ▒░ļĀź, ņØ┤ņĀä ĒĢŁņāØņĀ£ ņé¼ņÜ®ļĀź, Ļ│Āņŗż ļé┤ņŗ£Ļ▓Į ņé¼ņ¦ä, ņĖĪļæÉĻ│© ņĀäņé░ĒÖöļŗ©ņĖĄņ┤¼ņśü, ņäĖĻĘĀļ░░ņ¢æ Ļ▓Ćņé¼ Ļ▓░Ļ│╝, ĒĢŁņāØņĀ£ Ļ░Éņłśņä▒ Ļ▓░Ļ│╝, Ļ▓Ćņ▓┤ ņ▒äņĘ©ņØ╝ņØä ņĪ░ņé¼ĒĢśņśĆļŗż. ļ¦īņä▒ ĒÖöļåŹņä▒ ņżæņØ┤ņŚ╝ņØĆ ņÖĖļלņŚÉņä£ ņĄ£ņóģ ņ¦äļŗ©ĒĢ£ ņ¦äļŗ©ļ¬ģņØä ĻĖ░ņżĆņ£╝ļĪ£ ņ¦äņŻ╝ņóģņØ┤ ļÅÖļ░śļÉ£ Ļ▓ĮņÜ░ņÖĆ ņ¦äņŻ╝ņóģņØ┤ ļÅÖļ░śļÉśņ¦Ć ņĢŖņØĆ Ļ▓ĮņÜ░ļĪ£ ļČäļźśĒĢśņśĆļŗż. ņ¦äļŻīņØśļó░ņä£ņÖĆ ņ┤łņ¦ä ĻĖ░ļĪØņāüņØś ĒÖśņ×É ļ│æļĀźņŚÉ ĻĘ╝Ļ▒░ĒĢśņŚ¼ ĒāĆņøÉņŚÉņä£ Ļ▓ĮĻĄ¼ ĒĢŁņāØņĀ£ ļ│ĄņÜ®ļĀźņØ┤ ņ׳Ļ▒░ļéś ĒĢŁņāØņĀ£Ļ░Ć ĒżĒĢ©ļÉ£ ņĀÉņØ┤ņĢĪ ņé¼ņÜ®ļĀźņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░ļź╝ ĒĢŁņāØņĀ£ ņé¼ņÜ®ļĀźņØ┤ ņ׳ļŗżĻ│Ā ņĀĢņØśĒĢśņśĆļŗż. ĻĖēņä▒ ņżæņØ┤ņŚ╝, ņé╝ņČ£ņä▒ ņżæņØ┤ņŚ╝, ņÖĖņØ┤ļÅäņŚ╝ņ£╝ļĪ£ ņĄ£ņóģ ņ¦äļŗ©ļÉśņŚłĻ▒░ļéś, Ļ│Āņŗż ļé┤ņŗ£Ļ▓Į ņé¼ņ¦äņØ┤ļéś ņ¦äļŗ©ņŚÉ ĒĢäņÜöĒĢ£ ņØśļ¼┤ĻĖ░ļĪØņØ┤ ņåīņŗżļÉ£ Ļ▓ĮņÜ░ļŖö ļīĆņāüņŚÉņä£ ņĀ£ņÖĖĒĢśņśĆļŗż.
ņØ┤ ņŚ░ĻĄ¼ļŖö ļ│ĖņøÉņØś ĻĖ░Ļ┤Ćņ£żļ”¼ņŗ¼ņØśņ£äņøÉĒÜīņØś ņŖ╣ņØĖņØä ļ░øņĢśļŗż(IRB No: 2023-04-014).
ņäĖĻĘĀļ░░ņ¢æ Ļ▓Ćņé¼ņØ┤ļŻ©ņØś ņ▒äņĘ©ļŖö ņÖĖņØ┤ļÅäļź╝ Ļ╣©ļüŚņØ┤ ņ▓ŁņåīĒĢ£ Ēøä ļ®ĖĻĘĀļÉ£ ļ®┤ļ┤ēņ£╝ļĪ£ ņÖĖņØ┤ļÅäņÖĆ ņĀæņ┤ēņØä Ēö╝ĒĢśļ®┤ņä£ ļČäļ╣äļ¼╝ņØä ņ▒äņĘ©ĒĢśņśĆĻ│Ā, Amies ņØ┤ļÅÖņÜ® ļ░░ņ¦ĆņŚÉ ļŗ┤ņĢä ļ»ĖņāØļ¼╝ Ļ▓Ćņé¼ņŗżļĪ£ ņØ┤ļÅÖĒĢśņśĆļŗż. Ļ▓Ćņé¼ņŗżņŚÉņä£ ĒśłņĢĪ ĒĢ£ņ▓£ ļ░░ņ¦Ć, MacConkey agar ļ░░ņ¦Ć, Sabouraud ļ░░ņ¦ĆņŚÉ ņĀæņóģĒĢśņŚ¼, ņäŁņö© 35ļÅäņŚÉņä£ 24ņŗ£Ļ░ä ļ░░ņ¢æĒĢśņśĆĻ│Ā, ĻĘĖļ×ī ņŚ╝ņāēĻ│╝ ņāØĒÖöĒĢÖ Ļ▓Ćņé¼ļĪ£ ĻĘĀņØä ļÅÖņĀĢĒĢśņśĆļŗż. ĻĄ░ļØĮņØś ĒśĢĒā£ņÖĆ ņÜ®ĒśłĒśäņāü, ņä▒ņ¦ł ļō▒ņØä Ļ┤Ćņ░░ĒĢśņŚ¼ ĒżļÅäņāüĻĄ¼ĻĘĀņØä ļČäļźśĒĢśĻ│Ā, coagulase testļź╝ ņŗ£Ē¢ēĒĢ┤ ļÅÖņĀĢļÉ£ ĒżļÅäņāüĻĄ¼ĻĘĀ ņżæ ņØæņ¦æļ░śņØæņŚÉ ņ¢æņä▒ņØä ļ│┤ņØĖ Ļ▓āņØä ĒÖ®ņāē ĒżļÅäņāüĻĄ¼ĻĘĀņ£╝ļĪ£ ņĀĢņØśĒĢśņśĆļŗż. ņØ┤Ēøä Kirby-Bauer ļööņŖżĒü¼ ĒÖĢņé░ļ▓ĢņØä ņØ┤ņÜ®ĒĢ£ ĒĢŁņāØņĀ£Ļ░Éņłśņä▒Ļ▓Ćņé¼ļź╝ ĒåĄĒĢśņŚ¼ oxacillin disc (1.0 ╬╝g) ņŻ╝ņ£äņŚÉ ĻĄ░ļØĮņØ┤ 10.0 mm ņØ┤ĒĢśļĪ£ ņāØĻ▓╝ņØä Ļ▓ĮņÜ░ methicillinresistant Staphylococcus aureus (MRSA)ļĪ£ ĒīÉņĀĢĒĢśņśĆļŗż.
ĒĢŁņāØņĀ£ Ļ░Éņłśņä▒ Ļ▓Ćņé¼ĒĢŁņāØņĀ£ Ļ░Éņłśņä▒ Ļ▓Ćņé¼ļŖö Clinical and Laboratory Standards Institute (CLSI)ņØś Ēæ£ņżĆņ¦Ćņ╣©ņŚÉ ĻĖ░ņ┤łĒĢ£ ļööņŖżĒü¼ ĒÖĢņé░ļ▓Ģņ£╝ļĪ£ ņŗ£Ē¢ēĒĢśņŚ¼ CLSIņØś ĻĖ░ņżĆņŚÉ ļö░ļØ╝ Ļ░Éņłśņä▒(sensitive), ņżæĻ░äļé┤ņä▒(intermediate), ļé┤ņä▒(resistant)ņØś ņäĖ Ļ░Ćņ¦ĆļĪ£ ļ│┤Ļ│ĀĒĢśņśĆļŗż. Ļ░Éņłśņä▒ Ļ▓Ćņé¼ņŚÉ ņé¼ņÜ®ĒĢ£ ĒĢŁņāØņĀ£ļŖö ņĄ£ņ┤łņØś ĻĘĖļ×ī ņŚ╝ņāēņØś Ļ▓░Ļ│╝ņÖĆ ļÅÖņĀĢĻ▓░Ļ│╝ņŚÉ ļö░ļØ╝ņä£ ņŻ╝ļĪ£ ņé¼ņÜ®ļÉśļŖö ĒĢŁņāØņĀ£ĻĄ░ņØä ņØ┤ņÜ®ĒĢśņŚ¼ Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢśņśĆļŗż. ĻĘĖļ×ī ņ¢æņä▒ĻĘĀņŚÉ ļīĆĒĢ┤ņä£ļŖö penicillin (PC), oxacillin (OX), clindamycin (CL), gentamicin (GM), ciprofloxacin (CIP), erythromycin (EM), tigecycline (TG), linezolid (LN), vancomycin (VAN), teicoplanin (TCP), sulfamethoxazole/trimethoprim (SPT; co-trimoxazole), rifampin (RF)ņØä ņé¼ņÜ®ĒĢśņśĆĻ│Ā, ĻĘĖļ×ī ņØīņä▒ĻĘĀņŚÉ ļīĆĒĢ┤ņä£ļŖö ampicillin-sulbactam, amoxicillin-clavulanic acid (AMC), piperacillin/tazobactam (PITA), cefazolin (CZ), cefoxitin (CX), cefotaxime (CTX), ceftazidime (CAZ), cefepime (CFT), aztreonam (AZM), imipenem (IMP), amikacin (AK), GM, CIP, SPT, TGļź╝ ņé¼ņÜ®ĒĢśņśĆļŗż. ļśÉĒĢ£, Pseudomonas spp.ņŚÉ ļīĆĒĢ┤ņä£ļŖö piperacillin, PITA, ticarcillin/clavulanic acid (TICA), CAZ, CFT, AZM, IMP, AK, GM, CIP, colistin (COL)ņØä ņé¼ņÜ®ĒĢśņśĆļŗż.
ĒåĄĻ│ä ļČäņäØĒåĄĻ│ä ļČäņäØņØĆ SPSS version 25.0 (IBM Corp., Armonk, NY, USA)ņØä ņØ┤ņÜ®ĒĢśņśĆņ£╝ļ®░, ļ▓öņŻ╝ĒśĢ ļ│ĆņłśņØś ļæÉ ĻĘĖļŻ╣ņØä ļ╣äĻĄÉĒĢśļŖö Ļ▓ĮņÜ░ PearsonņØś ņ╣┤ņØ┤ ņĀ£Ļ│▒ Ļ▓ĆņĀĢ(PearsonŌĆÖs chi-square test)ņØä ņØ┤ņÜ®ĒĢśņśĆļŗż. ļ¬©ļōĀ ĒåĄĻ│ä Ļ▓ĆņĀĢņØĆ p’╝£0.05ņØĖ Ļ▓ĮņÜ░ ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśļ»ĖĒĢ£ ņ░©ņØ┤Ļ░Ć ņ׳ļŗżĻ│Ā ĒīÉņĀĢĒĢśņśĆļŗż.
Ļ▓░ Ļ│╝ĒĢ┤ļŗ╣ ĻĖ░Ļ░äļÅÖņĢł ļīĆņāü ĒÖśņ×ÉļōżņØś ņŚ░ļĀ╣ ļČäĒżļŖö 14-88ņäĖļĪ£ ĒÅēĻĘĀ 60.0┬▒14.93ņäĖņśĆņ£╝ļ®░ ļé©ņ×É 131ļ¬ģ, ņŚ¼ņ×É 141ļ¬ģņØ┤ņŚłļŗż. ņØ┤ĒÖśļÉ£ ĻĘĆļŖö ņÜ░ņĖĪ 137ņśł, ņóīņĖĪ 135ņśłļĪ£ ņ¢æņĖĪņØ┤ ļ╣äņŖĘĒĢ£ ņ¢æņāüņ£╝ļĪ£ ļ│┤ņśĆņ£╝ļ®░, ņ¦äņŻ╝ņóģņØ┤ ļÅÖļ░śļÉ£ ļ¦īņä▒ņżæņØ┤ņŚ╝ņØ┤ 27ņśł, ņØ┤ņĀä ĒĢŁņāØņĀ£ ņé¼ņÜ®ļĀźņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░Ļ░Ć 154ņśłņśĆļŗż(Table 1).
ļ░░ņ¢æļÉ£ ņäĖĻĘĀņØś ņóģļźś ļ░Å ļ╣łļÅäĻĘĀ Ļ▓ĆņČ£ļźĀņØä ņé┤ĒÄ┤ļ│┤ļ®┤ 272ļ¬ģņØś ņØ┤ļŻ©ļź╝ ļīĆņāüņ£╝ļĪ£ ĒĢ£ Ļ▓░Ļ│╝, 220ļ¬ģ(80.9%)ņŚÉņä£ ņäĖĻĘĀņØ┤ Ļ▓ĆņČ£ļÉśņŚłĻ│Ā, 43ļ¬ģ(15.8%)ņŚÉņä£ ņ¦äĻĘĀņØ┤ Ļ▓ĆņČ£ļÉśņŚłņ£╝ļ®░, 17ļ¬ģ(6.3%)ņŚÉņä£ļŖö ĻĘĀņØ┤ Ļ▓ĆņČ£ļÉśņ¦Ć ņĢŖņĢśļŗż. ļŗ©ņØ╝Ļ░ÉņŚ╝ņØ┤ 184ņśłņśĆņ£╝ļ®░, 2ņóģ ņØ┤ņāüņØś ĻĘĀņóģņØ┤ ĒĢ©Ļ╗ś ļ░░ņ¢æļÉśļŖö Ēś╝ĒĢ®Ļ░ÉņŚ╝ņØĆ 71ņśłņśĆļŗż(Table 2).
ļŗ©ņØ╝Ļ░ÉņŚ╝ņØĆ ļ╣äņ¦äņŻ╝ņóģņä▒ ņżæņØ┤ņŚ╝ņØ┤ 169ņśłļĪ£, ņØ┤ ņżæ ļŗ©ņØ╝ ņ¦äĻĘĀ Ļ░ÉņŚ╝ņØ┤ 28ņśłņśĆņ£╝ļ®░, ņ¦äņŻ╝ņóģņä▒ ņżæņØ┤ņŚ╝ņŚÉņä£ļŖö ņ¦äĻĘĀņŚÉ ņØśĒĢ£ ļŗ©ņØ╝Ļ░ÉņŚ╝ ņŚåņØ┤ ņäĖĻĘĀņŚÉ ņØśĒĢ£ ļŗ©ņØ╝Ļ░ÉņŚ╝ņØ┤ 15ņśł ĒÖĢņØĖļÉśņŚłļŗż.
Ēś╝ĒĢ®Ļ░ÉņŚ╝ņØĆ ļ╣äņ¦äņŻ╝ņóģņä▒ ņżæņØ┤ņŚ╝ņØ┤ 61ņśł, ņ¦äņŻ╝ņóģņä▒ ņżæņØ┤ņŚ╝ņØ┤ 10ņśłļĪ£, 2ņóģ ņØ┤ņāüņØś ņäĖĻĘĀņØ┤ ĒĢ©Ļ╗ś ļ░░ņ¢æļÉśļŖö Ļ▓ĮņÜ░Ļ░Ć 56ņśł, 2ņóģ ņØ┤ņāüņØś ņ¦äĻĘĀņØ┤ ĒĢ©Ļ╗ś ļ░░ņ¢æļÉśļŖö Ļ▓ĮņÜ░Ļ░Ć 7ņśł, ņäĖĻĘĀĻ│╝ ņ¦äĻĘĀņØ┤ ĒĢ©Ļ╗ś ļ░░ņ¢æļÉśļŖö Ļ▓ĮņÜ░Ļ░Ć 8ņśłņśĆļŗż.
272ļ¬ģņØś ĒÖśņ×ÉņŚÉņä£ 277ņŻ╝ņØś ņäĖĻĘĀņØ┤ Ļ▓ĆņČ£ļÉśņŚłņ£╝ļ®░, ļ╣äņ¦äņŻ╝ņóģņä▒ ņżæņØ┤ņŚ╝ņØś Ļ▓ĮņÜ░ 248ņŻ╝, ņ¦äņŻ╝ņóģņä▒ ņżæņØ┤ņŚ╝ņØś Ļ▓ĮņÜ░ 29ņŻ╝ņØś ņäĖĻĘĀņØ┤ ļ░░ņ¢æļÉśņŚłļŗż.
ļ░░ņ¢æļÉ£ ņäĖĻĘĀņØś 17.3%ļŖö ĒśłņĢĪ ĒĢ£ņ▓£ ļ░░ņ¦ĆņŚÉņä£ ĒÖĢņØĖļÉ£ gram positive bacilliļĪ£ Corynebacterium spp., Microbacterium spp., Bacillus spp., ļō▒ņØś Ļ░ÉņŚ╝ĻĘĀņ£╝ļĪ£ņä£ ņØśņØśĻ░Ć ņŚåļŖö ĻĘĀņŻ╝ļĪ£ Ļ░äņŻ╝ĒĢśņśĆļŗż.
ņĀäņ▓┤ņĀüņ£╝ļĪ£ MRSA (23.1%)Ļ░Ć Ļ░Ćņן ļ¦ÄņĢśņ£╝ļ®░, Pseudomonas aeruginosa (19.5%), methicillin sensitive Staphylococcus aureus (MSSA) (19.1%), coagulase-negative staphylococci (CNS) (8.3%)ņØś ņł£ņ£╝ļĪ£ ļ░░ņ¢æļÉśņŚłļŗż. ļ╣äņ¦äņŻ╝ņóģņä▒ ņżæņØ┤ņŚ╝ņØś Ļ▓ĮņÜ░ MRSA (23.0%), MSSA (19.8%), P. aeruginosa (19.4%), CNS (8.5%)ņØś ļ╣łļÅäļĪ£ ļ░░ņ¢æļÉśņŚłĻ│Ā, ņ¦äņŻ╝ņóģņä▒ ņżæņØ┤ņŚ╝ņØś Ļ▓ĮņÜ░ MRSA (24.1%), P. aeruginosa (20.7%), MSSA (13.8%), CNS (6.9%)ņØś ļ╣łļÅäļĪ£ ļ░░ņ¢æļÉśņ¢┤ ņĄ£ļŗż Ļ▓ĆņČ£ ĻĘĀņŻ╝ņŚÉ ņ░©ņØ┤ļŖö ņŚåņŚłņ£╝ļ®░, ĒåĄĻ│äņĀü Ļ▓ĆņĀĢ ņŗ£ ļ╣äņ¦äņŻ╝ņóģņä▒ ņżæņØ┤ņŚ╝Ļ│╝ ņ¦äņŻ╝ņóģņä▒ ņżæņØ┤ņŚ╝ ļæÉ ĻĄ░ņŚÉņä£ MRSAņÖĆ P. aeruginosaņØś Ļ▓ĆņČ£ļźĀņØś ņ░©ņØ┤ļŖö ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż(MRSA; p=0.757, P. aeruginosa p=0.745) (Table 3).
ĒĢŁņāØņĀ£ Ļ░Éņłśņä▒ Ļ▓Ćņé¼StaphylococcusņØś ĒĢŁņāØņĀ£ Ļ░Éņłśņä▒MRSAļŖö ļ╣äņ¦äņŻ╝ņóģņä▒ ņżæņØ┤ņŚ╝Ļ│╝ ņ¦äņŻ╝ņóģņä▒ ņżæņØ┤ņŚ╝ ļ¬©ļæÉņŚÉņä£ LN, VAN, TCPņŚÉļŖö 100%ņØś Ļ░Éņłśņä▒ņØä ļ│┤ņśĆņ£╝ļ®░, TG, SPTņÖĆ RFņŚÉ ļīĆĒĢ┤ņä£ ņĀäņ▓┤ņĀüņ£╝ļĪ£ 98.4%, 96.9%, 98.4%ņØś ļåÆņØĆ Ļ░Éņłśņä▒ņØä ļ│┤ņśĆļŗż. ĻĘĖļ¤¼ļéś OX, PC ļō▒ņŚÉļŖö 100%ņØś ņĀĆĒĢŁņä▒ņØä ļ│┤ņśĆņ£╝ļ®░, CL, EM, GM, CIPņŚÉ ļīĆĒĢśņŚ¼ ļé«ņØĆ Ļ░Éņłśņä▒ņØä ļ│┤ņśĆļŗż.
MSSAļŖö OXņÖĆ LN, TG, TCP, SPT, VAN, RFņŚÉ ļīĆĒĢ┤ņä£ 100%ņØś Ļ░Éņłśņä▒ņØä ļ│┤ņśĆĻ│Ā PCļź╝ ņĀ£ņÖĖĒĢ£ ļŗżļźĖ ĒĢŁņāØņĀ£ļōżņŚÉļÅä 84%ņŚÉņä£ 92%ļĪ£ ļåÆņØĆ Ļ░Éņłśņä▒ņØä ļ│┤ņśĆļŗż.
CNSļĪ£ ĒÖĢņØĖļÉ£ ņäĖĻĘĀ ņżæ 6ņŻ╝ņØś ņäĖĻĘĀņŚÉņä£ ĒĢŁņāØņĀ£ Ļ░Éņłśņä▒ Ļ▓░Ļ│╝ļź╝ ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłņ£╝ļ®░, CNSļŖö MSSAņŚÉ ļ╣äĒĢ┤ ļ╣äĻĄÉņĀü ļé«ņØĆ ĒĢŁņāØņĀ£ Ļ░Éņłśņä▒ņØä ļ│┤ņśĆņ£╝ļéś LN, TG, TCP, VAN, RFņŚÉļŖö 100% Ļ░Éņłśņä▒ņØä ļ│┤ņśĆļŗż(Table 4).
PseudomonasņØś ĒĢŁņāØņĀ£ Ļ░Éņłśņä▒TICAļź╝ ņĀ£ņÖĖĒĢ£ Ļ░Éņłśņä▒ Ļ▓Ćņé¼ņŚÉ ņé¼ņÜ®ļÉ£ ļ¬©ļōĀ ĒĢŁņāØņĀ£ņŚÉ ļīĆĒĢ┤ 60% ņØ┤ņāüņØś Ļ░Éņłśņä▒ņØä ļ│┤ņśĆļŗż. ļ╣äņ¦äņŻ╝ņóģņä▒ ņżæņØ┤ņŚ╝Ļ│╝ ņ¦äņŻ╝ņóģņä▒ ņżæņØ┤ņŚ╝ņŚÉņä£ ļ¬©ļæÉ CAZņŚÉ 100% Ļ░Éņłśņä▒ņØä ļ│┤ņśĆņ£╝ļ®░, Ļ░ÖņØĆ cephalosporin ņĀ£ņĀ£ņØĖ CFTņÖĆ carbapenem Ļ│äņŚ┤ņØĖ IMPņŚÉ ļåÆņØĆ Ļ░Éņłśņä▒ņØä ļ│┤ņśĆļŗż. AminoglycosideņØĖ AK, GMņŚÉ ļīĆĒĢ┤ Ļ░Éņłśņä▒ņØä Ļ░Ćņ¦ĆļŖö ĻĘĀņŻ╝ļŖö 92.6% (50ņśł), 68.5% (37ņśł)ņśĆņ£╝ļ®░, monobactamņØĖ AZMņŚÉ 77.8% (42ņśł)ņØś Ļ░Éņłśņä▒ņØä ļ│┤ņśĆļŗż. Quinolone Ļ│äņŚ┤ ĒĢŁņāØņĀ£ņØĖ CIPņŚÉ ļīĆĒĢ┤ Ļ░Éņłśņä▒ņØä Ļ░Ćņ¦ĆļŖö ĻĘĀņŻ╝ļŖö 64.8% (35ņśł)ļĪ£ Ļ░Éņłśņä▒ņØ┤ Ļ░Ćņן ļé«ņĢśņ£╝ļ®░, ļ╣äņ¦äņŻ╝ņóģņä▒ ņżæņØ┤ņŚ╝ņŚÉņä£ ņ¦äņŻ╝ņóģņä▒ ņżæņØ┤ņŚ╝ļ│┤ļŗż ņāüļīĆņĀüņ£╝ļĪ£ ļé«ņØĆ Ļ░Éņłśņä▒ņØä ļéśĒāĆļāłļŗż. ļŗżņĀ£ļé┤ņä▒ ĻĘĖļ×īņØīņä▒ĻĘĀ Ļ░ÉņŚ╝ņŚÉ ņé¼ņÜ®ĒĢśļŖö COLņŚÉļŖö ļ¬©ļæÉ 100% Ļ░Éņłśņä▒ņØä ļ│┤ņśĆļŗż(Table 5).
ĻĘĖļ×ī ņØīņä▒ĻĘĀņØś ĒĢŁņāØņĀ£ Ļ░Éņłśņä▒
Klebsiella pneumoniaeļŖö AMC, PITA, CX, IMP, AK, GM, SPT, TGņŚÉ ļīĆĒĢ┤ņä£ 100%ņØś Ļ░Éņłśņä▒ņØä ļ│┤ņśĆĻ│Ā, CZ, CTX, CAZ, CFT, AZMņŚÉ ļīĆĒĢ┤ ļåÆņØĆ Ļ░Éņłśņä▒(83.3%), CIPņŚÉ ļŗżņåī ļé«ņØĆ Ļ░Éņłśņä▒ņØä ļ│┤ņśĆļŗż(66.7%).
Enterobacter spp.ņØś Ļ▓ĮņÜ░ PITA, CTX, CAZ, CFT, AZM, AKņŚÉ ļīĆĒĢ┤ņä£ 100%ņØś Ļ░Éņłśņä▒ņØä ļ│┤ņśĆĻ│Ā IMP, GM, CIP, SPT, TGņŚÉ ļåÆņØĆ Ļ░Éņłśņä▒ņØä ļ│┤ņśĆļŗż(80%).
Proteus spp.ņØś Ļ▓ĮņÜ░ AMC, PITA, CX, CFT, AK ļ░Å SPT ļō▒ņŚÉ ļīĆĒĢ┤ 100%ņØś Ļ░Éņłśņä▒ņØä ļ│┤ņśĆĻ│Ā, CTX, CAZ, AZM, GM, CIPņŚÉ ļīĆĒĢ┤ ļåÆņØĆ Ļ░Éņłśņä▒(75%)ņØä ļ│┤ņśĆļŗż.
Serratia spp.ņØś Ļ▓ĮņÜ░ņŚÉļŖö PITA, AK, IMP ļ░Å SPT ļō▒ņŚÉ ļīĆĒĢ┤ 100%ņØś Ļ░Éņłśņä▒ņØä ļ│┤ņśĆĻ│Ā CIPņŚÉ ļīĆĒĢ┤ņä£ļŖö 80%ņØś Ļ░Éņłśņä▒ņØä ļ│┤ņśĆļŗż(Table 6).
MRSAņÖĆ Pseudomonas aeruginosaņØś Ļ▓ĆņČ£ļźĀņØś ļ│ĆĒÖöņĀäņ▓┤ Ļ▓ĆņČ£ ĻĘĀņŻ╝ ņżæ MRSAļŖö ņ┤Ø 64ņśł, ņĀäņ▓┤ ĻĘĀņŻ╝ņØś 23.1%ļĪ£ Ļ░Ćņן ļ¦ÄņØĆ Ļ▓ĆņČ£ļźĀņØä ļ│┤ņśĆļŗż. ņĀäņ▓┤ Staphylococcus spp. ņżæņŚÉņä£ MRSAĻ░Ć ņ░©ņ¦ĆĒĢśļŖö ļ╣äņ£©ņØĆ ņŚ░ļÅäļ│äļĪ£ 2017ļģä 68.6% (24ņśł), 2018ļģä 52.9% (9ņśł), 2019ļģä 55.6% (10ņśł), 2020ļģä 41.7% (10ņśł), 2021ļģä 64.3% (9ņśł)ļĪ£ ļ╣äņŖĘĒĢ£ ņČöņØ┤ļź╝ ļ│┤ņØ┤ļ®░, ņĀäņ▓┤ ĻĘĀņŻ╝ņŚÉņä£ MRSAĻ░Ć ņ░©ņ¦ĆĒĢśļŖö ļ╣äņ£©ņØĆ 2017ļģä 35.8%, 2018ļģä 23.1%, 2019ļģä 22.2%, 2020ļģä 16.4%, 2021ļģä 20.5%ļĪ£ Staphylococcus spp. ņżæņŚÉņä£ MRSAņØś ļ╣äņ£©Ļ│╝ ļ╣äņŖĘĒĢ£ ņČöņäĖļź╝ ļ│┤ņśĆļŗż(Fig. 1).
ņĀäņ▓┤ Ļ▓ĆņČ£ ĻĘĀņŻ╝ ņżæ P. aeruginosaļŖö ņ┤Ø 55ņśł, ņĀäņ▓┤ ĻĘĀņŻ╝ņØś 19.9%ļĪ£ Ļ▓ĆņČ£ļÉśņŚłļŗż. ņĀäņ▓┤ ĻĘĀņŻ╝ņŚÉņä£ P. aeruginosaĻ░Ć ņ░©ņ¦ĆĒĢśļŖö ļ╣äņ£©ņØĆ ņŚ░ļÅäļ│äļĪ£ 2017ļģä 9.0% (6ņśł), 2018ļģä 28.2% (11ņśł), 2019ļģä 35.6% (16ņśł), 2020ļģä 14.8% (9ņśł), 2021ļģä 18.2% (9ņśł)ņśĆļŗż(Fig. 2). ņØ┤ ņżæ ņĀäņ▓┤ Ļ▓ĆņČ£ ĻĘĀņŻ╝ņŚÉņä£ ciprofloxacin-resistant Pseudomonas aeruginosa (CRPA)Ļ░Ć ņ░©ņ¦ĆĒĢśļŖö ļ╣äņ£©ņØĆ 2017ļģä 1.49%ņŚÉņä£ 2021ļģä 6.82%ļĪ£ ņ”ØĻ░ĆĒĢśļŖö Ļ▓ĮĒ¢źņØä ļ│┤ņśĆļŗż.
ņ¦äĻĘĀ ļÅÖņŗ£Ļ░ÉņŚ╝ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö Candida spp. 28ņśł, Aspergillus spp. 20ņśł, ĻĘĖļ”¼Ļ│Ā ĻĖ░ĒāĆ ņ¦äĻĘĀ 2ņśłĻ░Ć ļÅÖņĀĢļÉśņŚłļŗż. ņØ┤ ņżæ ņäĖĻĘĀĻ│╝ ĒĢ©Ļ╗ś ļÅÖņĀĢļÉ£ Ļ▓ĮņÜ░ļŖö Candida spp.ņŚÉņä£ 6Ļ▒┤, Aspergillus spp.ņŚÉņä£ 1Ļ▒┤ņØ┤ ĒÖĢņØĖļÉśņŚłļŗż. Candida spp.ņÖĆ Aspergillus spp.Ļ░Ć ļÅÖņĀĢļÉ£ 48ņśłņŚÉņä£ ļ░░ņ¢æļÉ£ ņ¦äĻĘĀņŚÉ ļö░ļØ╝ ļæÉ ĻĄ░Ļ░äņØś ļ░ĢĒģīļ”¼ņĢä-ņ¦äĻĘĀ ļÅÖņŗ£Ļ░ÉņŚ╝ņØś ņŚ░Ļ┤Ćņä▒ ņŚ¼ļČĆļź╝ ĒÖĢņØĖĒĢśĻĖ░ ņ£äĒĢ┤ ĻĄÉņ░©ļČäņäØņØä ņŗ£Ē¢ēĒĢśņśĆņ£╝ļ®░ ņ£ĀņØśļ»ĖĒĢ£ ņŚ░Ļ┤Ćņä▒ņØä ĒÖĢņØĖĒĢśņ¦Ć ļ¬╗Ē¢łļŗż(p=0.214).
ĒĢŁņāØņĀ£ ņé¼ņÜ®ļĀźņŚÉ ļö░ļźĖ ļ╣äĻĄÉĒĢŁņāØņĀ£ ņé¼ņÜ®ļĀźņØ┤ ņ׳ļŖö ĻĄ░ 154ļ¬ģ(56%)Ļ│╝ ĒĢŁņāØņĀ£ ņé¼ņÜ®ļĀźņØ┤ ņŚåļŖö 118ļ¬ģ(44%)ņŚÉņä£ Ļ▓ĆņČ£ļÉśļŖö ĻĘĀņŻ╝ņØś ļ»ĖņāØļ¼╝ĒĢÖņĀü ĒŖ╣ņ¦ĢņŚÉ ņ░©ņØ┤Ļ░Ć ņ׳ļŖöņ¦Ć ņČöĻ░ĆļĪ£ ĒÖĢņØĖĒĢśņśĆļŗż. ļæÉ ĻĄ░Ļ░ä ĻĄÉņ░©ļČäņäØņØä ĒĢśņśĆņØä ļĢī, ĒĢŁņāØņĀ£ļź╝ ņ▓śļ░® ļ░øņØĆ ĻĄ░ņŚÉņä£ MRSAļéś CRPAņØś ļ╣łļÅäĻ░Ć ņ£ĀņØśĒĢśĻ▓ī ļŹö ļåÆņĢśļŗż(MRSA, p=0.005; CRPA, p=0.008). ņ¦äĻĘĀņØś Ļ▓ĮņÜ░ ņØ┤ņĀä ĒĢŁņāØņĀ£ ņé¼ņÜ®ļĀźņØ┤ ņ׳ļŖö ĻĄ░ņŚÉņä£ ņ¦äĻĘĀņØ┤ Ļ▓ĆņČ£ļÉ£ Ļ▓ĮņÜ░Ļ░Ć 38ņśłņśĆņ£╝ļ®░, ĒĢŁņāØņĀ£ ņé¼ņÜ®ļĀźņØ┤ ņŚåļŖö ĻĄ░ņŚÉņä£ 10ņśłĻ░Ć Ļ▓ĆņČ£ļÉśņŚłĻ│Ā, ņ¦äĻĘĀĻ▓ĆņČ£ļ╣łļÅäļŖö ĒĢŁņāØņĀ£ ņé¼ņÜ®ļĀźņØ┤ ņ׳ļŖö ĻĄ░ņØ┤ ĒĢŁņāØņĀ£ ņé¼ņÜ®ļĀźņØ┤ ņŚåļŖö ĻĄ░ņŚÉ ļ╣äĒĢ┤ ņ£ĀņØśĒĢśĻ▓ī ļåÆņĢśļŗż(p=0.001).
ņ╣śļŻīļ░śņØæ ļ░Å ņØ┤ļŻ© ņĪ░ņĀłĻ▓░Ļ│╝ņĀäņ▓┤ 272ļ¬ģņØś ĒÖśņ×É ņżæ 236ļ¬ģ(86.8%)ņØ┤ ņ╣śļŻī Ēøä ņØ┤ļŻ©Ļ░Ć ņĪ░ņĀłļÉ£ Ļ▓āņ£╝ļĪ£ ĒÖĢņØĖļÉśņŚłļŗż. 26ļ¬ģ(9.5%)ņØĆ ņäĖĻĘĀ ļ░░ņ¢æ Ļ▓░Ļ│╝ ļ░Å ĒĢŁņāØņĀ£ Ļ░Éņłśņä▒ Ļ▓░Ļ│╝ļź╝ ĒÖĢņØĖĒĢ£ Ēøä ņĀüņĀłĒĢ£ Ļ▓ĮĻĄ¼ ĒĢŁņāØņĀ£ ļ│ĄņÜ®ņØä ņŗ£ņ×æĒĢśņśĆņ£╝ļéś ņ╣śļŻī ņŗ£ņ×æ Ēøä ņČöņĀüņØ┤ ļČłĻ░ĆļŖźĒĢśņŚ¼ ņĪ░ņĀł ņŚ¼ļČĆļź╝ ĒÖĢņØĖĒĢśņ¦Ć ļ¬╗ĒĢśņśĆļŗż. ļśÉĒĢ£, ņ¦ĆņåŹņĀüņØĖ ĒĢŁņāØņĀ£ ņ╣śļŻīņŚÉļÅä ļČłĻĄ¼ĒĢśĻ│Ā 10ļ¬ģ(3.7%)ņØś ĒÖśņ×ÉņŚÉņä£ļŖö ņØ┤ļŻ©Ļ░Ć ņ¦ĆņåŹļÉśņŚłļŗż(Table 7). ņ╣śļŻīņŚÉ ņŗżĒī©ĒĢ£ 10ļ¬ģņØś ĒÖśņ×É ņżæ 7ļ¬ģņŚÉņä£ ĒĢŁņāØņĀ£ ļé┤ņä▒ĻĘĀņØ┤ ĒÖĢņØĖļÉśņŚłņ£╝ļ®░ ņØ┤ļŻ©Ļ░Ć ņĪ░ņĀłļÉ£ ĒÖśņ×ÉļōżņŚÉ ļ╣äĒĢ┤ ĒĢŁņāØņĀ£ ļé┤ņä▒ĻĘĀ Ļ▓ĆņČ£ļźĀņØ┤ ņ£ĀņØśĒĢśĻ▓ī ļåÆņĢśļŗż(p=0.015). ļśÉĒĢ£, ņØ┤ļŻ©Ļ░Ć ņĪ░ņĀłļÉśņ¦Ć ņĢŖņØĆ ĒÖśņ×ÉņØś ĒÅēĻĘĀņŚ░ļĀ╣ņØĆ 73.2┬▒9.83ņ£╝ļĪ£ ņ╣śļŻīĻ░Ć ņä▒Ļ│ĄĒĢ£ ĒÖśņ×ÉļōżņØś ĒÅēĻĘĀņŚ░ļĀ╣ņØĖ 58.89┬▒14.44ņŚÉ ļ╣äĒĢ┤ ņ£ĀņØśĒĢśĻ▓ī ļåÆņĢśļŗż(p=0.002).
Ļ│Ā ņ░░ļ¦īņä▒ ņżæņØ┤ņŚ╝ņØś ņ╣śļŻīļź╝ ņ£äĒĢ┤ ņĀüņĀłĒĢ£ ĒĢŁņāØņĀ£ ņäĀĒāØņØ┤ ĒĢäņłśņĀüņØ┤ņ¦Ćļ¦ī ĻĘĀ ļ░░ņ¢æ ļ░Å ĒĢŁņāØņĀ£ Ļ░Éņłśņä▒ Ļ▓Ćņé¼ļŖö Ļ▓░Ļ│╝ļź╝ ĒÖĢņØĖĒĢśĻĖ░Ļ╣īņ¦Ć ņŗ£Ļ░äņØ┤ ņåīņÜöļÉśļ®░, ņØ╝ņ░©ņØśļŻīĻĖ░Ļ┤ĆņØś Ļ▓ĮņÜ░ ņØ┤ļ¤¼ĒĢ£ Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢśĻĖ░ ņ¢┤ļĀĄļŗżļŖö ļŗ©ņĀÉņØ┤ ņ׳ļŗż. ļČĆņĀüņĀłĒĢ£ ĒĢŁņāØņĀ£ņØś ņé¼ņÜ®ņ£╝ļĪ£ MRSAņÖĆ Ļ░ÖņØĆ ļé┤ņä▒ĻĘĀņØ┤ ņ¦ĆņåŹņĀüņ£╝ļĪ£ ņČ£ĒśäĒĢśĻ│Ā Ļ░ü ĻĘĀņŻ╝ņŚÉņä£ ĒĢŁņāØņĀ£ Ļ░Éņłśņä▒ļÅä ļ│ĆĒÖöĒĢśĻĖ░ ļĢīļ¼ĖņŚÉ ņ¦ĆņåŹņĀüņØĖ ņäĖĻĘĀĒĢÖņĀü Ļ│Āņ░░ņØ┤ ĒĢäņÜöĒĢśļŗż.
ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņ┤Ø 272ļ¬ģņØś ĒÖśņ×É ņżæ 220ļ¬ģ(80.9%)ņŚÉņä£ ņäĖĻĘĀņØ┤ Ļ▓ĆņČ£ļÉśņŚłĻ│Ā, 43ļ¬ģ(15.8%)ņŚÉņä£ ņ¦äĻĘĀņØ┤ Ļ▓ĆņČ£ļÉśņŚłņ£╝ļ®░, 17ļ¬ģ(6.3%)ņŚÉņä£ļŖö ĻĘĀņØ┤ Ļ▓ĆņČ£ļÉśņ¦Ć ņĢŖņĢśļŗż. ņØ┤ļŻ©ņŚÉņä£ ņäĖĻĘĀņØ┤ Ļ▓ĆņČ£ļÉśņ¦Ć ņĢŖņØĆ Ļ▓ĮņÜ░ļŖö ņĀĆņ×Éļōżļ¦łļŗż 4.3%ņŚÉņä£ 13.4%Ļ╣īņ¦Ć ļŗżņ¢æĒĢśĻ▓ī ļ│┤Ļ│ĀļÉ£ļŗż[7,8]. ņØ┤ļŖö ņäĖĻĘĀļ░░ņ¢æĻ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢśĻĖ░ ņĀä ĒĢŁņāØņĀ£ ņé¼ņÜ®ņ£╝ļĪ£ ņØĖĒĢ┤ ļ│æņøÉĻĘĀņØś ņ”ØņŗØ ļ░Å ņä▒ņןņØ┤ ļŖÉļĀżņ¦ĆļŖö Ļ▓āņŚÉņä£ ĻĖ░ņØĖĒĢĀ ņłś ņ׳ņ£╝ļ®░, ļ╣äĻĄÉņĀü ņ▓£ņ▓£Ē׳ ņ”ØņŗØĒĢśļŖö ļ│æņøÉĻĘĀņØ┤ ņøÉņØĖņØĖ Ļ▓ĮņÜ░ ņäĖĻĘĀ ļ░░ņ¢æĻ▓Ćņé¼ņŚÉņä£ Ļ▓ĆņČ£ļÉśņ¦Ć ņĢŖņØä Ļ░ĆļŖźņä▒ņØ┤ ņ׳ļŗż. Ēś╝ĒĢ®Ļ░ÉņŚ╝ņØś ļ╣łļÅäļŖö ņĀĆņ×ÉļōżņØś Ļ▓ĮņÜ░ 26.1%ļĪ£, ĻĖ░ņĪ┤ ņŚ░ĻĄ¼ļōżņŚÉņä£ļŖö 5.9%ņŚÉņä£ 29.9%Ļ╣īņ¦Ć ļ│┤Ļ│ĀļÉśņŚłļŗż[7,9,10]. ņÖĖņØ┤ļÅä ņĀĢņāüņäĖĻĘĀņ┤ØņŚÉ Ļ┤ĆļĀ©ĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ ņÖĖņØ┤ļÅäņØś ņĀĢņāü ņäĖĻĘĀņ┤ØņØĆ ļīĆļČĆļČäņØ┤ CNS ņśĆņ£╝ļ®░ ĻĘĖ ņÖĖņØś ĻĘĀņóģņ£╝ļĪ£ļŖö CorynebacteriumņØ┤ Ļ░Ćņן ļ¦ÄņØ┤ ļÅÖņĀĢļÉśņŚłļŗż[11]. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ Ēś╝ĒĢ®Ļ░ÉņŚ╝ņØś ļīĆļČĆļČäņØĆ ņäĖĻĘĀ ņåŹ(genus)ņØ┤ ĒŖ╣ņĀĢļÉśņ¦Ć ņĢŖļŖö ĻĘĖļ×ī ņ¢æņä▒ Ļ░äĻĘĀĻ│╝ ļÅÖļ░śļÉśņŚłļŖöļŹ░, ņÖĖņØ┤ļÅäņØś ņĀĢņāü ņāüņ×¼ĻĘĀņØä Ļ│ĀļĀżĒĢĀ ļĢī ņØ┤ļŖö Ļ▓Ćņ▓┤ ņ▒äņĘ© ņŗ£ ņśżņŚ╝ļÉ£ ĻĘĀ ļśÉļŖö ņÖĖņØ┤ļÅäņØś ņĀĢņāü ĻĘĀņŻ╝Ļ░Ć ĒżĒĢ©ļÉ£ Ļ▓░Ļ│╝ļĪ£ ņāØĻ░üļÉ£ļŗż.
ļ░░ņ¢æļÉ£ ņäĖĻĘĀņØś ļ╣łļÅäļŖö ļ╣äņ¦äņŻ╝ņóģņä▒ ņżæņØ┤ņŚ╝ņŚÉņä£ļŖö MRSA (23.0%), MSSA (19.8%), P. aeruginosa (19.4%), CNS (8.5%) ņł£ņ£╝ļĪ£ Ļ▓ĆņČ£ļÉśņŚłņ£╝ļ®░, ņ¦äņŻ╝ņóģņä▒ ņżæņØ┤ņŚ╝ņØĆ MRSA (24.1%), P. aeruginosa (20.7%), MSSA (13.8%), CNS (6.9%)ņØś ļ╣łļÅäļĪ£ ļ░░ņ¢æļÉśņ¢┤ ņĄ£ļŗż Ļ▓ĆņČ£ ĻĘĀņŻ╝ņŚÉ ņ░©ņØ┤Ļ░Ć ņŚåņŚłļŗż. ĻĖ░ņĪ┤ņØś ņŚ░ĻĄ¼ņŚÉņä£ ļ╣äņ¦äņŻ╝ņóģņä▒ ņżæņØ┤ņŚ╝Ļ│╝ ņ¦äņŻ╝ņóģņä▒ ņżæņØ┤ņŚ╝ņØĆ ņä£ļĪ£ ļŗżļźĖ ļ░£ļ│æ ĻĖ░ņĀäņŚÉļÅä ļČłĻĄ¼ĒĢśĻ│Ā ĻĘĀņŻ╝ ĻĄ¼ņä▒ņŚÉņä£ ļ╣äņŖĘĒĢ£ ņ¢æņāüņØä ļ│┤ņØ┤ļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ņ£╝ļ®░[10], ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļÅä ļ╣äņŖĘĒĢ£ Ļ▓░Ļ│╝ļź╝ ļ│┤ņśĆļŗż. ņ¦äņŻ╝ņóģņä▒ ņżæņØ┤ņŚ╝ņØś Ļ▓ĮņÜ░, ņ¦äņŻ╝ņóģ ņ×Éņ▓┤Ļ░Ć ņŻĮĻ▒░ļéś ņåÉņāüļÉ£ ņĪ░ņ¦üņ£╝ļĪ£ņä£ ļ░ĢĒģīļ”¼ņĢäņØś ņĀĆņןņåī(bacterial reservoir) ņŚŁĒĢĀņØä ĒĢśņŚ¼ Ļ░ÉņŚ╝ņŚÉ ņĘ©ņĢĮĒĢ£ ĒÖśĻ▓ĮņØä ņĪ░ņä▒ĒĢĀ ņłś ņ׳ļŗż. 16S rRNA sequencingņØä ĒåĄĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ ņ¦äņŻ╝ņóģņØä ļÅÖļ░śĒĢ£ ņżæņØ┤ņŚ╝ņŚÉņä£ ņäĖĻĘĀ ņóģņØś ĒÆŹļČĆĒĢ©Ļ│╝ ļŗżņ¢æņä▒ņØ┤ ļ╣äņ¦äņŻ╝ņóģņä▒ ņżæņØ┤ņŚ╝ņŚÉ ļ╣äĒĢ┤ ņ£ĀņØśĒĢśĻ▓ī ļåÆņØīņØ┤ ĒÖĢņØĖļÉśņŚłļŗż[12]. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņ¦äņŻ╝ņóģ ņ£Āļ¼┤ņŚÉ ļö░ļØ╝ Ļ▓ĆņČ£ļÉśļŖö ņäĖĻĘĀ ņóģļźśņØś ņ░©ņØ┤ņÖĆ Ēś╝ĒĢ®Ļ░ÉņŚ╝ ļ╣łļÅäļź╝ ļ╣äĻĄÉĒĢśņśĆņ£╝ļéś ļæÉ ĻĄ░Ļ░ä ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļŖö ņŚåņŚłļŗż(p’╝×0.05).
Staphylococcus spp.ļŖö ļ╣äņ¦äņŻ╝ņóģņä▒ ņżæņØ┤ņŚ╝Ļ│╝ ņ¦äņŻ╝ņóģņä▒ ņżæņØ┤ņŚ╝ ļ¬©ļæÉņŚÉņä£ ļåÆņØĆ ļ░░ņ¢æļźĀņØä ļ│┤ņśĆņ£╝ļ®░, ĻĘĖņżæ MRSAĻ░Ć Ļ░Ćņן ļ¦ÄņØĆ ļ╣łļÅäļĪ£ ļ░░ņ¢æļÉśņŚłļŗż. ļ¦īņä▒ ĒÖöļåŹņä▒ ņżæņØ┤ņŚ╝ņØś ņØ┤ļŻ©ļ░░ņ¢æĻ▓Ćņé¼ņŚÉņä£ MRSAņŚÉ ļīĆĒĢ£ ĻĄŁļé┤ ļ│┤Ļ│ĀņŚÉņä£ 1979ļģä Ryou ļō▒[13]ņØĆ 0%ņØś ļ░░ņ¢æļźĀņØä ļ│┤Ļ│ĀĒĢśņśĆņ£╝ļéś, 1979ļģä ParkĻ│╝ Noh [14]ļŖö 7.7%, 1986ļģä LeeņÖĆ Cho [15]ļŖö 2.7%, 1987ļģä Yang ļō▒[8]ņØĆ 4.7%, 1995ļģä Ha ļō▒[16]ņØĆ 17.9%, 1997ļģä Sim ļō▒[17]ņØĆ 18.8%ņØś ļ│┤Ļ│Āļź╝ ļ│┤ņśĆļŗż. 2000ļģäļīĆņŚÉ ņØ┤ļź┤ļ¤¼ 2004ļģä Yu ļō▒[9]ņØĆ 32.3%, 2006ļģä Myung ļō▒[18]ņØĆ 23.7%, 2007ļģä Yeo ļō▒[6]ņØĆ 24.2%, 2008ļģä Lee ļō▒[10]ņØĆ 26.4%, 2009ļģä Jung ļō▒[19]ņØĆ 15.6%ļź╝ ļ│┤Ļ│ĀĒĢśņŚ¼ MRSAņØś ņ£Āļ│æļźĀņØ┤ ņĄ£Ļ│ĀņĀÉņŚÉ ļŗ¼ĒĢśļŗż Ļ░ÉņåīĒĢśļŖö ņČöņäĖļź╝ ļ│┤ņśĆļŗż. 2017ļģäļČĆĒä░ 2022ļģäĻ╣īņ¦ĆņØś ņŗ£Ē¢ēĒĢ£ ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö 23.1%ļĪ£ Ļ│╝Ļ▒░ņÖĆ ļ╣äņŖĘĒĢśĻ▒░ļéś ļ│┤ļŗż ļåÆņØĆ Ļ▓ĆņČ£ļźĀņØä ļ│┤ņØ┤Ļ│Ā ņ׳ļŗż. ĒĢśņ¦Ćļ¦ī 2017ļģäļČĆĒä░ 2021ļģäĻ╣īņ¦Ć ņŚ░ļÅäļ│ä MRSAņØś Ļ▓ĆņČ£ļźĀņØĆ 2017ļģä 35.8%, 2021ļģä 20.5%ļĪ£ ņĀÉņ░© Ļ░ÉņåīĒĢśĻ│Ā ņ׳ļŖö Ļ▓ĮĒ¢źņØä ļ│┤ņØĖļŗż.
MRSAļŖö methicillinņŚÉ ļīĆĒĢ┤ņä£ļ¦ī ņĀĆĒĢŁņä▒ņØä ļ│┤ņØ┤ļŖö Ļ▓āņØ┤ ņĢäļŗłļØ╝ ļŗżļźĖ ĒĢŁņāØņĀ£ņŚÉļÅä ļé┤ņä▒ņØä Ļ░Ćņ¦ĆļŖö ĻĘĀņ£╝ļĪ£ ņé¼ņÜ® Ļ░ĆļŖźĒĢ£ ĒĢŁņāØņĀ£Ļ░Ć ņĀ£ĒĢ£ļÉśņ¢┤ ņ׳ļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö LN, VAN, TCPņŚÉļŖö 100%ņØś Ļ░Éņłśņä▒ņØä ļ│┤ņśĆņ£╝ļ®░, TG, SPTņÖĆ RFņŚÉ ļīĆĒĢ┤ņä£ 98.4%, 96.9%, 98.4%ņØś ņĀäņ▓┤ņĀüņ£╝ļĪ£ ļåÆņØĆ Ļ░Éņłśņä▒ņØä ļ│┤ņśĆņ£╝ļéś ĻĘĖ ņÖĖ ļŗżļźĖ ĒĢŁņāØņĀ£ņŚÉ ļīĆĒĢ┤ņä£ļŖö ļ░śņØæĒĢśņ¦Ć ņĢŖņĢśļŗż. ņäĖĒżļ▓Į ĒśĢņä▒ņØä ņĀĆĒĢ┤ĒĢśņŚ¼ ņé┤ĻĘĀņ×æņÜ®ņØä ļéśĒāĆļé┤ļŖö glycopeptideĻ│ä(VAN, TCP)ļŖö MRSAņØś ņØ╝ņ░© ņ╣śļŻīņĀ£ļĪ£ ļåÆņØĆ Ļ░Éņłśņä▒ņØ┤ ņ׳ļŖö ļ░śļ®┤ ļČäņ×Éļ¤ēņØ┤ Ēü¼ĻĖ░ ļĢīļ¼ĖņŚÉ ņĀĢņŻ╝ ņ╣śļŻīļź╝ ĒĢ┤ņĢ╝ ĒĢ£ļŗżļŖö ļŗ©ņĀÉņØ┤ ņ׳ļŗż. Oxazolidinone Ļ│äņŚ┤ ĒĢŁņāØņĀ£ņØĖ LNņØĆ 50 s ribosomeņŚÉ ņ×æņÜ®ĒĢśņŚ¼ ļŗ©ļ░▒ņ¦ł ĒĢ®ņä▒ņØä ņĀĆĒĢ┤ĒĢśļ®░, ļīĆļČĆļČä VANņŚÉ ļČĆņ×æņÜ®ņØ┤ ņ׳Ļ▒░ļéś ņ╣śļŻīņŚÉ ļ░śņØæņØ┤ ņŚåņØä ļĢī ņØ┤ņ░©ņĢĮņ£╝ļĪ£ ņé¼ņÜ®ļÉ£ļŗż. TGļŖö ņāłļĪŁĻ▓ī Ļ░£ļ░£ļÉ£ ĒĢŁĻĘĀņĀ£ļĪ£ ĻĘĖļ×īņ¢æņä▒, ĻĘĖļ×īņØīņä▒ņØś ĒśĖĻĖ░ņä▒ ņäĖĻĘĀ ļ░Å ĒśÉĻĖ░ĻĘĀņŚÉ ļīĆĒĢ┤ Ļ┤æļ▓öņ£äĒĢ£ ĒĢŁĻĘĀļĀźņØä ļéśĒāĆļé┤ņ¦Ćļ¦ī, ĻĄŁļé┤ņŚÉņä£ļŖö ļ│ĄĒĢ®ņä▒ ņżæņ”Ø ņŚ░ņĪ░ņ¦ü Ļ░ÉņŚ╝Ļ│╝ ļ│ĄĒĢ®ņä▒ ļ│ĄĻ░Ģļé┤ Ļ░ÉņŚ╝ņŚÉņä£ ņĀ£ĒĢ£ņĀüņ£╝ļĪ£ ĻĖēņŚ¼ļź╝ ņØĖņĀĢĒĢśĻ│Ā ņ׳ņ¢┤ ņżæņØ┤ņŚ╝ ņ╣śļŻīņŚÉ ņé¼ņÜ®ĒĢśĻĖ░ ņ¢┤ļĀĄļŗż. SPTļŖö ņŚĮņé░ņØś ĒśĢņä▒ ļ░Å ņØ┤ņÜ® ņ¢ĄņĀ£ļź╝ ĒåĄĒĢ£ ņĀĢĻĘĀņ×æņÜ®ņØä Ļ░Ćņ¦Ćļ®░, glycopeptidesĻ│äņÖĆļŖö ļŗ¼ļ”¼ Ļ▓ĮĻĄ¼ņÜ® ņĀ£ņĀ£Ļ░Ć ņĪ┤ņ×¼ĒĢśņŚ¼ ļ│ĄņĢĮņØ┤ Ļ░äĒÄĖĒĢśļŗżļŖö ņןņĀÉņØ┤ ņ׳ļŗż.
2002ļģä glycopeptideĻ│ä ĒĢŁņāØņĀ£ņŚÉ ļīĆĒĢśņŚ¼ ļé┤ņä▒ņØä Ļ░Ćņ¦ĆļŖö vancomycin-resistance Staphylococcus aureus (VRSA)Ļ░Ć ļ│┤Ļ│ĀļÉśņŚłņ£╝ļ®░[20], ĻĄŁļé┤ņŚÉ VRSAņØś ļ│┤Ļ│ĀļŖö ņŚåņ£╝ļéś ļ░śņĮöļ¦łņØ┤ņŗĀ ņżæļō▒ļÅäļé┤ņä▒ ĒÖ®ņāēĒżļÅäņĢīĻĘĀ(vancomycin intermediate Staphylococcus aureus) Ļ░ÉņŚ╝ņ”Ø ņŗĀĻ│ĀĻ░Ć ņ”ØĻ░ĆĒĢśĻ│Ā ņ׳ļŗż. ņØ┤ļ¤¼ĒĢ£ ĒĢŁņāØņĀ£ ļé┤ņä▒ĻĘĀņØś ņ╣śļŻīņŚÉļŖö ņāłļĪ£ņÜ┤ ĒĢŁņāØņĀ£ Ļ░£ļ░£ļ┐Éļ¦ī ņĢäļŗłļØ╝ ĻĖ░ņĪ┤ ĒĢŁĻĘĀņĀ£ņØś ņĀüņĀłĒĢ£ ņé¼ņÜ®ņØ┤ ņżæņÜöĒĢĀ Ļ▓āņØ┤ļŗż. SPTņØś Ļ▓ĮņÜ░ ņĀäņ▓┤ Staphylococcus spp.ņŚÉ ļīĆĒĢśņŚ¼ 1995ļģä Ha ļō▒[16]ņØĆ 94.5%, 2009ļģä Jung ļō▒[19]ņØĆ 91.7%ņØś Ļ░Éņłśņä▒ņØä ļ│┤Ļ│ĀĒĢśņśĆņ£╝ļ®░, MRSAņŚÉ ļīĆĒĢśņŚ¼ 2004ļģä Yu ļō▒[9]ņØĆ 88.2%, 2008ļģä Lee ļō▒[10]ņØĆ 87.7%ļź╝ ļ│┤Ļ│ĀĒĢ£ ļ░ö ņ׳ļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö MRSAņŚÉ ļīĆĒĢśņŚ¼ 96.9%ņØś Ļ░Éņłśņä▒ņØä ļ│┤ņŚ¼, ņ×äņāüņŚÉņä£ ĒØöĒĢśĻ▓ī ņé¼ņÜ®ĒĢśļŖö ņĢĮņĀ£ ņżæ ņ£ĀņØ╝ĒĢśĻ▓ī MRSAņŚÉ Ļ░Éņłśņä▒ņØä ļéśĒāĆļé┤ņŚłļŗż.
PseudomonasļŖö ļīĆļČĆļČä ļČĆņĀüņĀłĒĢ£ ĒĢŁņāØņĀ£ ņ▓śļ░®ņ£╝ļĪ£ ņØĖĒĢ┤ ļ░£ņāØĒĢśļŖö ĻĘĀņŻ╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ņ£╝ļ®░, ļÅÖņĀĢļźĀņØĆ Ēü░ ļ│ĆĒÖöņŚåņØ┤ ņØ╝ņĀĢ ņłśņżĆņ£╝ļĪ£ ļ│┤Ļ│ĀļÉśĻ│Ā ņ׳ļŗż. 1975ļģä KangĻ│╝ Noh [21]ņŚÉ ņØśĒĢ┤ 9.5% Ļ▓ĆņČ£ļźĀņØä ļ│┤ņØĖ ņØ┤Ēøä 1979ļģäļČĆĒä░ Ēśäņ×¼Ļ╣īņ¦Ć 10.4%-39.3% [16,22]ļĪ£ Ļ▓ĆņČ£ļÉśļ®░, ļ¼ĖĒŚīņŚÉ ļö░ļØ╝ ņ░©ņØ┤ļŖö ņ׳ņ£╝ļéś ļ¦īņä▒ ĒÖöļåŹņä▒ ņżæņØ┤ņŚ╝ņŚÉņä£ Ļ░Ćņן ļ¦ÄņØ┤ ļ░░ņ¢æļÉśļŖö ĻĘĀņŻ╝ļĪ£ ļ│┤Ļ│ĀļÉ£ ļ░ö ņ׳ļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ļæÉ ļ▓łņ¦ĖļĪ£ ļ¦ÄņØĆ ĻĘĀņŻ╝ļĪ£ ĒÖĢņØĖļÉśņŚłņ£╝ļ®░, 2017ļģäļČĆĒä░ 2021ļģäĻ╣īņ¦Ć 9.0%, 28.2%, 35.6%, 14.8%, 20.5%ļĪ£ 2017ļģä ņØ┤ĒøäļĪ£ ņ¦ĆņåŹņĀüņ£╝ļĪ£ ņØ╝ņĀĢņłśņżĆ ņØ┤ņāüņØś Ļ▓ĆņČ£ļźĀņØä ļ│┤ņśĆļŗż.
1980ļģäļīĆĻ╣īņ¦Ć PseudomonasņØś GMņŚÉ ļīĆĒĢ£ Ļ░Éņłśņä▒ņØĆ 64.5%-76.5% [7,8,15,23]ļĪ£ ļ│┤Ļ│ĀļÉśņŚłņ£╝ļéś, 1990ļģäļīĆļČĆĒä░ ņ¦ĆņåŹņĀüņ£╝ļĪ£ Ļ░Éņłśņä▒ņØ┤ ļé«ņĢäņ¦ĆĻ│Ā ņ׳ļŗż. Ļ░ÖņØĆ aminoglycoside Ļ│äņŚ┤ ņżæ AKņØś Ļ▓ĮņÜ░ 1980ļģäļīĆļČĆĒä░ Ēśäņ×¼Ļ╣īņ¦Ć 79.3%-100% [9,15-18,23]ļĪ£ ļ╣äĻĄÉņĀü ļåÆņØĆ Ļ░Éņłśņä▒ņØä ļ│┤Ļ│ĀĒĢśņśĆļŗż. CIPņŚÉ ļīĆĒĢ┤ 1997ļģä Ļ░Éņłśņä▒ņØ┤ 100% [17]ļĪ£ ļ│┤Ļ│ĀļÉśņŚłņ£╝ļéś, ņØ┤Ēøä ņĀÉņ░©ņĀüņ£╝ļĪ£ ļé«ņĢäņĀĖ 2004ļģä Yu ļō▒[9]ņØĆ 75.9%, 2006ļģä Myung ļō▒[18]ņØĆ 77.3%, 2007ļģä Yeo ļō▒[6]ņØĆ 39.5%, 2008ļģä Lee ļō▒[10]ņØĆ 62.3%, 2009ļģä Jung ļō▒[19]ņØĆ 53.3%ļØ╝Ļ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŗż. ņØ┤ņŚÉ ļ╣äĒĢ┤ CAZļŖö 87.1%-98.5% [6,9,10,18,19]ļĪ£ ĻŠĖņżĆĒ׳ ļåÆņØĆ Ļ░Éņłśņä▒ņØ┤ ļ│┤Ļ│ĀļÉśĻ│Ā ņ׳ļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļÅä Ļ│╝Ļ▒░ ļ│┤Ļ│ĀņÖĆ ļ╣äĻĄÉĒĢśņŚ¼ quinoloneņŚÉ ļīĆĒĢ£ ļé«ņØĆ Ļ░Éņłśņä▒(CIP 64.8%)ņØä ļ│┤ņśĆņ£╝ļéś CAZņÖĆ CFTņŚÉ ļīĆĒĢśņŚ¼ļŖö ņŚ¼ņĀäĒ׳ ļåÆņØĆ Ļ░Éņłśņä▒(100%, 96.3%)ņØä ļ│┤ņśĆļŗż. ņØ┤ļ¤¼ĒĢ£ PseudomonasņØś ĒĢŁņāØņĀ£ Ļ░Éņłśņä▒ņØś ļ│ĆĒÖöļŖö 1ņ░© ņØśļŻīĻĖ░Ļ┤ĆņŚÉņä£ ņēĮĻ▓ī ņĀæĒĢĀ ņłś ņ׳ļŖö CIPņØś Ļ▓ĮĻĄ¼ņÜ® ĒĢŁņāØņĀ£ ļ░Å ņĀÉņØ┤ņĢĪ ļō▒ ņŻ╝ļĪ£ ņé¼ņÜ®ļÉśļŖö ĒĢŁņāØņĀ£ņŚÉ ĻĖ░ņØĖĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż.
ņ¦äĻĘĀņØ┤ ļÅÖņĀĢļÉ£ Ļ▓ĮņÜ░ Candida spp.ņÖĆ Aspergillus spp.ņØś Ļ▓ĆņČ£ ņŚ¼ļČĆņŚÉ ļö░ļØ╝ ņäĖĻĘĀ-ņ¦äĻĘĀ ļÅÖņŗ£Ļ░ÉņŚ╝ņŚÉ ņ£ĀņØśĒĢ£ ņ░©ņØ┤Ļ░Ć ņ׳ļŖöņ¦Ć ĒÖĢņØĖĒĢśĻ│Āņ×É ĒĢśņśĆņ£╝ļéś ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśļ»ĖĒĢ£ Ļ▓░Ļ│╝ļź╝ ĒÖĢņØĖĒĢśņ¦Ć ļ¬╗Ē¢łļŗż. ņČöĻ░ĆļĪ£ ĒĢŁņāØņĀ£ ņé¼ņÜ®ļĀźņØ┤ ņ׳ļŖö ĻĄ░Ļ│╝ ĒĢŁņāØņĀ£ ņé¼ņÜ®ļĀźņØ┤ ņŚåļŖö ĻĄ░ņØä ļ╣äĻĄÉĒĢśņśĆĻ│Ā, ĒĢŁņāØņĀ£ ņé¼ņÜ®ļĀźņØ┤ ņ׳ļŖö ĻĄ░ņŚÉņä£ ņ¦äĻĘĀ Ļ▓ĆņČ£ ļ╣łļÅäĻ░Ć ņ£ĀņØśĒĢśĻ▓ī ļåÆņĢśļŗż. ņØ┤ļŖö ĒĢŁņāØņĀ£ ņé¼ņÜ®Ļ│╝ ņ¦äĻĘĀ Ļ▓ĆņČ£ ņé¼ņØ┤ņŚÉ ņ£ĀņØśĒĢ£ ņŚ░Ļ┤Ćņä▒ņØ┤ ņ׳ņØīņØä ņŗ£ņé¼ĒĢ£ļŗż. ĻĘĖļ¤¼ļéś ņ¦äĻĘĀņØ┤ ņŗżņĀ£ ļ│æņøÉļĀźņØ┤ ņ׳ļŖöņ¦ĆņÖĆ ņןĻĖ░Ļ░äņØś ĒĢŁņāØņĀ£ ņé¼ņÜ®ņØ┤ ņ¦äĻĘĀĻ░ÉņŚ╝ņØś ņ£äĒŚśņØä ņ”ØĻ░Ćņŗ£ĒéżļŖö ņÜöņØĖņ£╝ļĪ£ ņ×æņÜ®ĒĢśļŖöņ¦ĆļŖö ņČöĻ░ĆņĀüņØĖ ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢśļŗż.
ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ ņ¦äĻĘĀĻ░ÉņŚ╝Ļ│╝ ļÅÖļ░śļÉ£ ņżæņØ┤ņŚ╝ņØĆ ņĀäņ▓┤ ļīĆņāüņ×ÉņØś 15%ļĪ£ ĒÖĢņØĖļÉśņŚłņ£╝ļ®░, ņ¦äĻĘĀņØ┤ ĒÖĢņØĖļÉ£ Ļ▓ĮņÜ░ Ļ▓ĮĻĄ¼ ĒĢŁņāØņĀ£ ņÖĖņŚÉ ņØ┤ņ¦äĻĘĀņ”ØņŚÉ ļīĆĒĢ£ ņĀüņĀłĒĢ£ ņ╣śļŻīļź╝ ĒĢäņÜöļĪ£ Ē¢łļŗż. ņ¦äĻĘĀĻ░ÉņŚ╝ņØ┤ ļÅÖļ░śļÉ£ Ļ▓ĮņÜ░, Ēśäļ»ĖĻ▓ĮņØä ņØ┤ņÜ®ĒĢ£ ņ▓ĀņĀĆĒĢ£ ņäĖņĀĢĻ│╝ ĻĄŁņåī ĒĢŁņ¦äĻĘĀņĀ£ ņ╣śļŻīĻ░Ć ĻĖ░ļ│ĖņØ┤ ļÉ£ļŗż. Ēśäļ»ĖĻ▓Į ņāüņŚÉņä£ ĒÖĢņØĖļÉśļŖö ļ¬©ļōĀ fungal debrisļź╝ ņĀ£Ļ▒░ĒĢśļŖö Ļ▓āņØ┤ ņżæņÜöĒĢśļ®░, ĻĄŁņåī ĒĢŁņ¦äĻĘĀņĀ£ņÖĆ ĒĢ©Ļ╗ś 2% ņĢäņäĖĒŖĖņé░ņØä ĒĢ©Ļ╗ś ņØ┤ņÜ®ĒĢĀ ņłś ņ׳ļŗż. ĒÜ©Ļ│╝ņĀüņØĖ ĒĢŁņ¦äĻĘĀņĀ£ņŚÉ ļīĆĒĢ┤ ĒĢ®ņØśļÉ£ ļ░öļŖö ņŚåņ£╝ļéś, ļŗżņ¢æĒĢ£ ņóģļźśņØś ĒĢŁņ¦äĻĘĀņĀ£ ņżæ clotrimazole, miconazole ļō▒ņØ┤ ļīĆĒæ£ņĀüņ£╝ļĪ£ ņé¼ņÜ®ļÉśļ®░, ņØ┤ļ¤¼ĒĢ£ ĒĢŁņ¦äĻĘĀņĀ£ļŖö ņØ┤ņ¦äĻĘĀņ”ØņØś 1ņ░© ņĀ£ņĀ£ļĪ£ ņé¼ņÜ®ļÉśĻ│Ā ņ׳ļŗż[24]. ņØ┤ ņÖĖ gentian violetņÖĆ Ļ░ÖņØĆ ļ░®ļČĆ, ĒĢŁņŚ╝ņ”Ø, ĒĢŁņ¦äĻĘĀ ĒÖ£ņä▒ņØ┤ ņ׳ļŖö triphenylmethane dyes Ļ░ÖņØĆ ļÅäļŻīļź╝ ņé¼ņÜ®ĒĢĀ ņłś ņ׳ņ£╝ļ®░, ĻĄŁņåī ĒĢŁņ¦äĻĘĀņĀ£ņŚÉ ļ░śņØæņØ┤ ņŚåļŖö Ļ▓ĮņÜ░ ņĀäņŗĀ ĒĢŁņ¦äĻĘĀņĀ£ļĪ£ Ļ▓ĮĻĄ¼ fluconazole ļśÉļŖö voriconazoleņØä Ļ│ĀļĀżĒĢ┤ ļ│╝ ņłś ņ׳ļŗż[24]. ļśÉĒĢ£, ļ®┤ņŚŁĻĖ░ļŖźņĀĆĒĢś, ļŗ╣ļć©ļ│æ ļō▒ņØś ĻĖ░ņĀĆņ¦łĒÖśņØś Ļ┤Ćļ”¼ņÖĆ ņ╣śļŻīļÅä ņżæņÜöĒĢśļ®░, ņÖĖņØ┤ļÅäļź╝ Ļ▒┤ņĪ░ņŗ£ņ╝£ ņŖĄĻĖ░ļź╝ ļ░®ņ¦ĆĒĢśĻ│Ā ņ×ÉņŻ╝ ņ▓ŁņåīĒĢśļŖö Ļ▓āņØ┤ ļÅäņøĆņØ┤ ļÉĀ ņłś ņ׳ļŗż.
ļ¦īņä▒ ņżæņØ┤ņŚ╝ņŚÉ ļīĆĒĢ┤ ņĀüņĀłĒĢ£ ņ╣śļŻīņŚÉļÅä ļČłĻĄ¼ĒĢśĻ│Ā, 10ļ¬ģ(3.7%)ņØś ĒÖśņ×ÉņŚÉņä£ļŖö ņØ┤ļŻ©Ļ░Ć ņ¦ĆņåŹļÉśņŚłļŗż. ņ╣śļŻīņŚÉ ņŗżĒī©ĒĢ£ ĒÖśņ×ÉļōżņØĆ ņØ┤ļŻ©Ļ░Ć ņĪ░ņĀłļÉ£ ĒÖśņ×ÉļōżņŚÉ ļ╣äĒĢ┤ ĒĢŁņāØņĀ£ ļé┤ņä▒ĻĘĀ Ļ▓ĆņČ£ļźĀņØ┤ ļåÆņĢśĻ│Ā Ļ│ĀļĀ╣ņØ┤ņŚłļŗż. ļśÉĒĢ£, ņØ┤ļŻ©Ļ░Ć ņĪ░ņĀłļÉśņ¦Ć ņĢŖņØĆ ĒÖśņ×ÉņØś ņØ╝ļČĆļŖö ņĀĢĻĖ░ņĀüņØĖ ņåīļÅģņØ┤ ņ¢┤ļĀżņÜ┤ ņÖĆņāü ĒÖśņ×É, ĻĖ░ņĀĆņ¦łĒÖś ļśÉļŖö ĒÖśņ×É ņØśņé¼ļĪ£ ņØĖĒĢ┤ ņłśņłĀņĀü ņ╣śļŻīĻ░Ć ļČłĻ░ĆļŖźĒĢ£ ĒÖśņ×É, ņĢĮļ¼╝ ņł£ņØæļÅäĻ░Ć ļé«ņØĆ ĒÖśņ×ÉņØ┤Ļ▒░ļéś, ņ£Āņ¢æļÅī ņĀłņĀ£ņłĀ Ēøä Ļ│ĄļÅÖļ¼ĖņĀ£(cavity problem)ļź╝ Ļ░Ćņ¦ĆĻ│Ā ņ׳ņŚłļŗż. ņØ┤ļ¤¼ĒĢ£ ņāüĒÖ®ļōżņØĆ ļ¦īņä▒ ņżæņØ┤ņŚ╝ņŚÉņä£ ņØ┤ļŻ©Ļ░Ć ņ¦ĆņåŹļÉśļŖö ņÜöņØĖņØ┤ ļÉĀ ņłś ņ׳ņ£╝ļ®░, ņØ┤ļź╝ Ļ│ĀļĀżĒĢśņŚ¼ ļ¦īņä▒ ņżæņØ┤ņŚ╝ ņ╣śļŻīņŚÉ ļŹö ļéśņØĆ Ļ┤Ćļ”¼ ļ░®ņĢłņØä ļ¬©ņāēĒĢ┤ņĢ╝ ĒĢĀ ĒĢäņÜöĻ░Ć ņ׳ļŗż.
ļ│Ė ņŚ░ĻĄ¼ļŖö ļŗ©ņØ╝ĻĖ░Ļ┤ĆņŚÉņä£ ņŚ░ņåŹņĀüņ£╝ļĪ£ ĒÖśņ×Éļź╝ ļČäņäØĒĢ©ņŚÉ ļö░ļØ╝ ĒĢŁņāØņĀ£ ļé┤ņä▒ ĻĘĀņŻ╝ņØś ļ│ĆĒÖöņČöņØ┤ļź╝ ņØ╝Ļ┤Ćņä▒ ņ׳Ļ▓ī ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłļŗż. ĻĘĖļ¤¼ļéś ņŚ░ĻĄ¼ņŚÉ ņ░ĖņŚ¼ĒĢ£ ĒÖśņ×É ņżæ ņĀłļ░śņØ┤ņāüņØ┤ ļŗżļźĖ ņØśļŻīĻĖ░Ļ┤ĆņŚÉņä£ ĒĢŁņāØņĀ£ ņ▓śļ░®ņØä ļ░øņĢśĻĖ░ ļĢīļ¼ĖņŚÉ, ņØ┤ņĀä ĒĢŁņāØņĀ£ ņóģļźśņÖĆ ņé¼ņÜ®ļ¤ēĻ│╝ Ļ┤ĆļĀ©ļÉ£ ņ×ÉņäĖĒĢ£ ņĀĢļ│┤ļź╝ ņ¢╗ļŖö Ļ▓āņŚÉ ĒĢ£Ļ│äĻ░Ć ņ׳ņŚłļŗż. ņŗżņĀ£ļĪ£ ļ│Ė ņŚ░ĻĄ¼ņŚÉ ņ░ĖņŚ¼ĒĢ£ ļīĆņāüņ×ÉļōżņØś ņØśļ¼┤ĻĖ░ļĪØņŚÉ ņ¦äļŻīņØśļó░ņä£ļéś ņåīĻ▓¼ņä£Ļ░Ć ļō▒ļĪØļÉśņ¢┤ ņ׳ļŖö Ļ▒┤ņØ┤ 98ņśłņśĆņ£╝ļ®░, ĻĖ░ļĪØņØ┤ ņ׳ļŖö ļīĆņāüņ×É ņżæņŚÉņä£ļÅä ņŗżņĀ£ļĪ£ ĒÖśņ×ÉĻ░Ć ļ│ĄņÜ®ĒĢ£ ĒĢŁņāØņĀ£ ņóģļźśņÖĆ ĻĖ░Ļ░äņØ┤ ĻĖ░ņłĀļÉśņ¢┤ ņ׳ļŖö Ļ▓ĮņÜ░ļŖö 13ņśłņŚÉ ļČłĻ│╝ĒĢśņśĆļŗż. ņäĖĻĘĀļ░░ņ¢æ Ļ▓Ćņé¼ ņĀä ņé¼ņÜ®ĒĢ£ ĒĢŁņāØņĀ£ņØś ņóģļźśņÖĆ ĻĖ░Ļ░äņØ┤ ļ░░ņ¢æ Ļ▓░Ļ│╝ņØś ņĀĢĒÖĢņä▒Ļ│╝ Ļ▓ĆņČ£ļĀźņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣Ā ņłś ņ׳ņ¢┤ ĒĢŁņāØņĀ£ ņé¼ņÜ®ļĀźņŚÉ ļīĆĒĢ£ ņäĖļČĆņĀĢļ│┤ļź╝ ņØ╝Ļ┤äņĀüņ£╝ļĪ£ ņłśņ¦æĒĢśĻ│Ā ļČäņäØĒĢĀ ņłś ņ׳ļŖö ņČöĻ░ĆņĀüņØĖ ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢĀ Ļ▓āņØ┤ļŗż. ļśÉĒĢ£, ņŚ░ļĀ╣ļ│ä ņ£Āļ│æļźĀņØä Ļ│ĀļĀżĒĢĀ ļĢī ņåīņĢä ĒÖśņ×ÉņŚÉņä£ ņżæņØ┤ņŚ╝ ļ╣łļÅäĻ░Ć ļé«ĻĖ░ļŖö ĒĢśļéś ļ│Ė ņŚ░ĻĄ¼ņŚÉ ņ░ĖņŚ¼ĒĢ£ ņåīņĢä ļ░Å ņ▓Łņåīļģä ĒÖśņ×ÉņØś ņłśĻ░Ć ņĀüņ¢┤ ņØ╝ļ░śņ¦æļŗ©ņŚÉ ņĀüņÜ®ĒĢśĻĖ░ņŚÉļŖö ĒĢ£Ļ│äĻ░Ć ņ׳ļŗż.
ĒĢŁņāØņĀ£ ļé┤ņä▒ļ░£ņāØņØś Ļ░Ćņן ņŻ╝ņÜöĒĢ£ ņÜöņØĖņØĆ ĒĢŁņāØņĀ£ņØś Ļ│╝ļŗż ņé¼ņÜ®(ņ¢æņĀü ņ”ØĻ░Ć)Ļ│╝ ļČĆņĀüņĀłĒĢ£ ņé¼ņÜ®(Ļ┤æļ▓öņ£ä ĒĢŁņāØņĀ£ Ļ│╝ļŗżņé¼ņÜ®)ņØ┤ļŗż. ņØ┤ļ¤¼ĒĢ£ ļ¼ĖņĀ£ņĀÉņØä ĒĢ┤Ļ▓░ĒĢśĻĖ░ ņ£äĒĢ┤ ĒĢŁņāØņĀ£ ņĀüņĀĢ ņé¼ņÜ®ņØä ļ¬®Ēæ£ļĪ£ ĒĢśļŖö ĒĢŁņāØņĀ£ ņŖżĒŖ£ņ¢┤ļō£ņŗŁ ĒöäļĪ£ĻĘĖļש(antimicrobial stewardship program)ņØ┤ ņĀ£ņŗ£ļÉśņŚłļŗż[25]. ļ»ĖĻĄŁ, ņśüĻĄŁ, ĒśĖņŻ╝, ņØ╝ļ│Ė ļō▒ņŚÉņä£ļŖö ņĀĢļČĆ ņŻ╝ļÅäĒĢśņŚÉ ņØ┤ļ¤¼ĒĢ£ ĒöäļĪ£ĻĘĖļשņØä ĒÖ£ļ░£Ē׳ ņČöņ¦äĒĢśĻ│Ā ņ׳ņ£╝ļéś ĻĄŁļé┤ņŚÉņä£ļŖö ĻĄŁĻ░ĆņĀü Ļ┤Ćņŗ¼ ļ░Å ņ¦ĆņøÉņØś ļČĆņĪ▒ĒĢ£ ņāüĒÖ®ņØ┤ļŗż. ĒŖ╣Ē׳ ļ¦īņä▒ ņżæņØ┤ņŚ╝ņØś ņĢĮļ¼╝ņ╣śļŻī ļīĆļČĆļČäņØ┤ ņÖĖļלņŚÉņä£ ņØ┤ļŻ©ņ¢┤ņ¦ĆļŖö Ēśä ņŗżĒā£ļź╝ Ļ│ĀļĀżĒĢĀ ļĢī, Ē¢źĒøä ņÖĖļל ņ¦äļŻīņŚÉņä£ļÅä ĒĢŁņāØņĀ£ ņŖżĒŖ£ņ¢┤ļō£ņŗŁ ĒöäļĪ£ĻĘĖļש ņĀüņÜ®ņØä ņ£äĒĢ£ ļģĖļĀźņØ┤ ĒĢäņÜöĒĢĀ Ļ▓āņØ┤ļŗż.
Ļ▓░ļĪĀņĀüņ£╝ļĪ£, ņØ┤ļŻ©ņŚÉ ļīĆĒĢ£ ņäĖĻĘĀļ░░ņ¢æ Ļ▓Ćņé¼ņŚÉņä£ Staphylococcus spp.Ļ░Ć Ļ░Ćņן ļ¦ÄņØ┤ Ļ▓ĆņČ£ļÉśņŚłņ£╝ļ®░, MRSA (23.1%), P. aeruginosa (19.5%), MSSA (19.1%), CNS (8.3%)Ļ░Ć Ļ▓ĆņČ£ļÉśņŚłļŗż. Ļ▓ĆņČ£ļÉ£ ĻĘĀņŻ╝ļŖö ņóģņĀä ņŚ░ĻĄ¼ņÖĆ ļ╣äĻĄÉĒĢĀ ļĢī ļÜ£ļĀĘĒĢ£ ļ│ĆĒÖöļŖö ņŚåņŚłļŗż. MRSAļŖö ĻĖ░ņĪ┤ņØś ļ│┤Ļ│ĀņÖĆ ļ╣äņŖĘĒĢ£ ņłśņżĆņØś Ļ▓ĆņČ£ļźĀņØä ļ│┤ņśĆņ£╝ļ®░ 5ļģäĻ░ä Ļ░ÉņåīĒĢśļŖö Ļ▓ĮĒ¢źņØä ĒÖĢņØĖĒĢśņśĆļŗż. MRSAņŚÉ ļīĆĒĢ£ Ļ░Éņłśņä▒Ļ▓░Ļ│╝ņŚÉņä£ LN, VAN, TCP, TG, SPT, RFņŚÉ ļåÆņØĆ Ļ░Éņłśņä▒ņØä ļ│┤ņśĆļŗż. P. aeruginosaļŖö ļæÉ ļ▓łņ¦ĖļĪ£ ļ¦ÄņØ┤ Ļ▓ĆņČ£ļÉśņŚłņ£╝ļ®░, ņØ┤ņĀä ņŚ░ĻĄ¼ņÖĆ ļ╣äĻĄÉĒĢĀ ļĢī quinoloneĻ│äņŚÉ ņŚ¼ņĀäĒ׳ ļé«ņØĆ Ļ░Éņłśņä▒ņØä ļ│┤ņśĆļŗż.
ņŻ╝ĻĖ░ņĀüņ£╝ļĪ£ ļ¦īņä▒ ņżæņØ┤ņŚ╝ ļ│æņøÉĻĘĀņØś ņóģļźśņÖĆ ļ╣łļÅäļź╝ Ļ░Éņŗ£ĒĢśĻ│Ā, ĒĢŁņāØņĀ£ Ļ░Éņłśņä▒ ļ│ĆĒÖöļź╝ ĒÖĢņØĖĒĢśļŖö Ļ▓āņØ┤ ņØ╝ņ░© ņ¦äļŻīņŚÉņä£ ņĀüņĀłĒĢ£ ĒĢŁņāØņĀ£ļź╝ ņäĀĒāØĒĢśļŖö ļŹ░ņŚÉ ļÅäņøĆņØ┤ ļÉĀ Ļ▓āņØ┤ļŗż. Ē¢źĒøäņŚÉļŖö ĒĢŁņāØņĀ£ļź╝ ņé¼ņÜ®ĒĢśĻĖ░ ņĀä ĒÖśņ×ÉļōżņØä ļīĆņāüņ£╝ļĪ£ ļ¦īņä▒ ņżæņØ┤ņŚ╝ņØś ņäĖĻĘĀĒĢÖņĀü Ļ│Āņ░░ņØä ĒĢäņÜöļĪ£ ĒĢĀ Ļ▓āņØ┤ļ®░, ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ Ļ▓ĆĒåĀļÉśņ¦Ć ņĢŖņØĆ ļŗżņ¢æĒĢ£ ĒĢŁņāØņĀ£ņŚÉ ļīĆĒĢ┤ņä£ļÅä Ļ┤æļ▓öņ£äĒĢ£ Ļ░Éņłśņä▒ Ļ▓Ćņé¼Ļ░Ć ĒĢäņÜöĒĢĀ Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż.
ACKNOWLEDGMENTSThis research was supported by a grant of the Korea Health Technology R&D Project through the Korea Health Industry Development Institute (KHIDI), funded by the Ministry of Health & Welfare, Republic of Korea (grant number: HI21C1574).
NotesAuthor Contribution Conceptualization: Jae Ho Chung, Seung Hwan Lee. Data curation: Hyeon A Lee, Jae Young Jeong. Formal analysis: Hyeon A Lee, Ha Na Lee. Funding acquisition: Jae Ho Chung. Methodology: Hayoung Byun, Seung Hwan Lee. Project administration: Jae Ho Chung. Supervision: Seung Hwan Lee. Visualization: Hyeon A Lee. WritingŌĆöoriginal draft: Hyeon A Lee. WritingŌĆöreview & editing: Jae Ho Chung. Fig.┬Ā1.The portion of methicillin resistant Staphylococcus aureus (MRSA) in all Staphylococcus species and in all bacteria detected from otorrhea of chronic suppurative otitis media and chronic cholesteatomatous otitis media from 2017 to 2021. 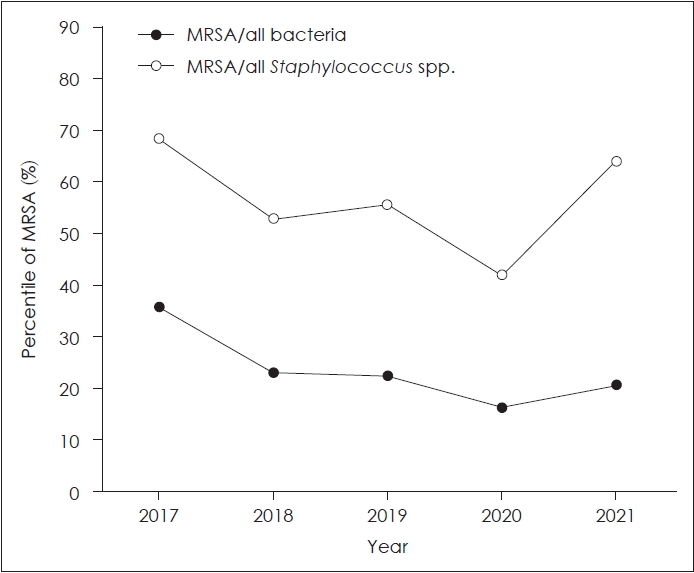
Fig.┬Ā2.The portion of Pseudomonas aeruginosa in all bacteria from otorrhea of chronic suppurative otitis media and chronic cholesteatomatous otitis media from 2017 to 2021. CSPA, ciprofloxacin-sensitive Pseudomonas aeruginosa; CRPA, ciprofloxacin-resistant Pseudomonas aeruginosa. 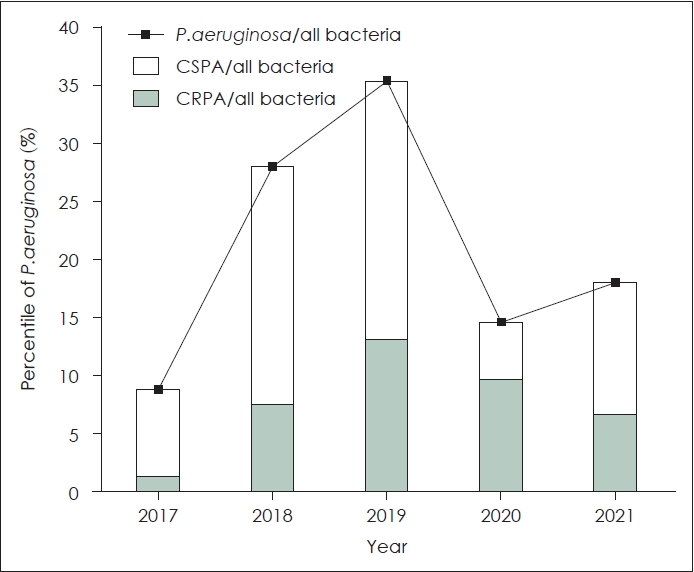
Table┬Ā1.Sociodemographic profiles of the study participants (n=272) Table┬Ā2.Cultured organisms in 272 patients with otorrhea
Table┬Ā3.Bacteriologic result of discovered organisms Table┬Ā4.Antibiotics susceptibility patterns of Staphylococcus spp. isolates Data are presented as n (%). PC, penicillin; OX, oxacillin; GM, gentamicin; CIP, ciprofloxacin; EM, erythromycin; CL, clindamycin; TG, tigecycline; LN, linezolid; TCP, teicoplanin; VAN, vancomycin; SPT, sulfamethoxazole/trimethoprim; RF, rifampin; MRSA, methicillin-resistant Staphylococcus aureus; MSSA, methicillin sensitive Staphylococcus aureus; CNS, coagulase-negative staphylococci Table┬Ā5.Antibiotic susceptibility patterns of Pseudomonas aeruginosa
Table┬Ā6.Antibiotic susceptibility patterns of Gram (-) bacteria isolates Data are presented as n (%). SAM, ampicillin-sulbactam; AMC, amoxicillin-clavulanic acid; PITA, piperacillin/tazobactam; CZ, cefazolin; CX, cefoxitin; CTX, cefotaxime; CAZ, ceftazidime; CFT, cefepime; AZM, aztreonam; IMP, imipenem; AK, amikacin; GM, gentamicin; CIP, ciprofloxacin; SPT, sulfamethoxazole/trimethoprim; TG, tigecycline Table┬Ā7.Characteristics of patients with unsuccessful otorrhea control REFERENCES1. Park M, Lee JS, Lee JH, Oh SH, Park MK. Prevalence and risk factors of chronic otitis media: the Korean National Health and Nutrition Examination Survey 2010-2012. PLoS One 2015;10(5):e0125905.
2. Health Insurance Review & Assessment Service. Medical statistics information [online] [cited 2023 Mar 31]. Available from: http://opendata.hira.or.kr/op/opc/olap3thDsInfo.do.
3. Bluestone CD. Epidemiology and pathogenesis of chronic suppurative otitis media: Implications for prevention and treatment. Int J Pediatr Otorhinolaryngol 1998;42(3):207-23.
4. World Health Organization. Chronic suppurative otitis media: Burden of illness and management options. Geneva: World Health Organization;2004.
5. Verhoeff M, van der Veen EL, Rovers MM, Sanders EA, Schilder AG. Chronic suppurative otitis media: A review. Int J Pediatr Otorhinolaryngol 2006;70(1):1-12.
6. Yeo SG, Park DC, Hong SM, Cha CI, Kim MG. Bacteriology of chronic suppurative otitis media--a multicenter study. Acta Otolaryngol 2007;127(10):1062-7.
7. Kim YB, Lee KS. Bacteriological study of chronic suppurative otitis media. Korean J Otorhinolaryngol-Head Neck Surg 1982;25(3):445-52.
8. Yang HS, Kim JR, Hyun KS, Yang HC, Kim H. Bacteriology of chronic suppurative otitis media. Korean J Otorhinolaryngol-Head Neck Surg 1987;30(3):422-8.
9. Yu YI, Cha CI, Lee IY, Byun JY, Cho JS. Current bacteriology of chronic suppurative otitis media. Korean J Otorhinolaryngol-Head Neck Surg 2004;47(7):607-11.
10. Lee SK, Yeo SG, Hong SM, Sim JS, Hong CK, Lee YC, et al. Bacteriology of chronic otitis media: Changing of detection rate of Methicillin-resistant Staphylococcus aureus and Pseudomonas aeruginosa. Korean J Otorhinolaryngol-Head Neck Surg 2008;51(1):9-15.
11. Chon KM, Yoon BN, Park SH, Lee IW, Goh EK, Wang SG, et al. Microbiologic study of the ear canal in Koreans. Korean J Otorhinolaryngol-Head Neck Surg 2005;48(1):8-12.
12. Neeff M, Biswas K, Hoggard M, Taylor MW, Douglas R. Molecular microbiological profile of chronic suppurative otitis media. J Clin Microbiol 2016;54(10):2538-46.
13. Ryou HH, Cha WB, Shim HS. Bacteriological study of chronic otitis media. Korean J Otorhinolaryngol-Head Neck Surg 1977;20(3):1-7.
14. Park SK, Noh KT. Bacteriologic study of chronic suppurative otitis media. Korean J Otorhinolaryngol-Head Neck Surg 1979;22(1):1-9.
15. Lee SW, Cho CK. Bacteriology of chronic suppurative otitis media. Korean J Otorhinolaryngol-Head Neck Surg 1986;29(1):40-9.
16. Ha JW, Kim YG, Kwoon SY, Choi KS, Kim CA. Bacteriological study of chronic suppurative otitis media. Korean J Otorhinolaryngol-Head Neck Surg 1995;38(10):1516-24.
17. Sim JH, Kim KT, Lee SH, Yun SH. Bacteriologic study of chronic suppurative otitis media. Korean J Otorhinolaryngol-Head Neck Surg 1997;40(6):819-26.
18. Myung NS, Choi CH, Kim TH, Kim HK, Koo SK. Bacteriology of otorrhea in chronic suppurative otitis media. J Clin Otolaryngol Head Neck Surg 2006;17(1):94-8.
19. Jung DH, Chin HS, Han DY, Jang WI, Park DW, Lee BD. A bacteriologic study of chronic suppurative otitis media. Korean J Audiol 2009;13(3):216-21.
20. Centers for Disease Control and Prevention (CDC). Vancomycin-resistant Staphylococcus aureus--Pennsylvania, 2002. MMWR Morb Mortal Wkly Rep 2002;51(40):902.
21. Kang JK, Noh KT. Bacteriological and histopathological studies in chronic suppurative otitis media. Korean J Otorhinolaryngol-Head Neck Surg 1975;18(2):17-27.
22. Cho CK, Cha CI, Yoon CG. Bacteriological study on chronic suppurative otitis media. Korean J Otorhinolaryngol-Head Neck Surg 1979;22(2):27-34.
23. Cho SB, Kim H, Jeong YC, Lee YK. Bacteriologic study on chronic suppurative otitis media. Korean J Otorhinolaryngol-Head Neck Surg 1984;27(6):533-8.
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 |
 |