 |
 |
AbstractAcute invasive fungal rhinosinusitis (AIFRS) is a rapidly progressing and fatal infection, primarily affecting immunocompromised individuals such as those undergoing hematopoietic stem cell transplantation, organ transplantation, and patients with diabetes. AIFRS is characterized by rapid tissue necrosis and vascular invasion, with a high mortality rate if early treatment is not initiated. Aspergillosis and Mucorales are the main causative pathogens, both of which exist in airborne spores and can infect immunocompromised individuals through the respiratory tract. Treatment requires both potent antifungal therapy and surgical resection of necrotic tissue. In this review, we comprehensively reviewed the latest medical treatment strategies for AIFRS and discuss future research and clinical application directions. According to several literature reviews, liposomal amphotericin B (L-AmB) was the most recommended as the first-line treatment for AIFRS, whereas voriconazole was used as a first-line drug, especially effective for Aspergillus infections. For Mucormycosis, L-AmB was used as the preferred treatment, and posaconazole and isavuconazole can be considered as alternative therapies. However, resistance to antifungal drugs may occur in some patients, necessitating an individualized approach and treatment for each patient. Combination antifungal therapy may be effective in certain cases, but it is generally not recommended as the treatment duration may vary depending on clinical findings and the patient’s condition. To achieve effective treatment for AIFRS in the future, further research on various causative organisms and improvements in treatment strategies are needed, with a multidisciplinary approach being crucial.
서 론급성 침습성 진균 부비동염(acute invasive fungal rhinosinusitis, AIFRS)은 빠르게 진행하는 치명적인 감염으로, 주로 면역이 저하된 조혈모세포 이식 환자, 장기 이식 환자, 혈액암 환자 및 당뇨병 환자에서 발생한다. AIFRS는 빠른 조직 괴사 및 혈관 침습을 특징으로 하며, 조기 치료가 이루어지지 않을 경우 높은 사망률을 보인다[1,2].
최근 몇 년간 면역억제 치료를 받는 환자가 증가하면서 AIFRS의 발생 빈도가 높아지고 있다. 특히 장기 이식 및 혈액 질환을 가진 환자가 증가하며 발병 빈도가 늘어나고 있으며, COVID-19 팬데믹 동안 중증 환자들에서 침습성 진균 감염의 발생이 증가하였다. 이와 같이 AIFRS의 발병 빈도가 증가함에 따라, 환자의 조기 진단과 적절한 치료 전략의 중요성이 더욱 강조되고 있다[3].
AIFRS의 대표적인 원인균으로 Aspergillosis와 Mucorales가 있으며, 이들은 공기 중 포자로 존재하며 면역력이 저하된 환자의 호흡기를 통해 감염을 유발한다. 특히 Mucormycosis은 급격한 진행 속도와 높은 치사율을 보이므로, 신속한 치료가 필수적이다[4,5]. AIFRS는 단순한 부비동 감염을 넘어 안와, 두개 내 구조물로 확산될 수 있으며, 잘 조절되지 않는 경우에 뇌농양이나 패혈증으로 이어질 수 있다[6].
AIFRS의 치료에는 강력한 항진균제 요법과 수술적 절제가 병행되어야 한다. Liposomal amphotericin B (L-AmB)는 AIFRS의 1차 치료제로 사용되며 voriconazole 및 posaconazole과 같은 azole 계열 항진균제를 사용할 수도 있다[7]. 이와 더불어 최근에는 isavuconazole과 같은 새로운 약제들이 등장하고 있다[8,9]. 약물 치료를 하면서 동시에 감염 부위의 괴사 조직을 적극적으로 제거하는 것이 치료 성과에 중요한 영향을 미치므로, 내시경적 또는 개방적 절제술이 필요하다[6].
본 종설에서는 AIFRS의 최신 약물 치료 기법을 종합적으로 고찰하고, 향후 연구 및 임상적 적용 방향에 대해서 논의하고자 한다.
병태생리 및 원인균AIFRS의 병태생리는 복잡하며, 감염 과정에서 다양한 면역학적 및 병리학적 기전이 관여한다. AIFRS의 발생 기전은 주로 숙주의 면역 기능 저하와 진균의 혈관 침습 능력에 의해 결정된다. 면역이 저하된 상태에서는 체내의 방어 기전이 약화되며, 이에 따라 진균이 비강과 부비동 점막을 통해 침입하여 빠르게 조직을 파괴하고 혈관을 침범하게 된다[3,4].
주요 원인균감염 기전AIFRS의 감염 기전은 면역 억제, 환경적 노출, 혈관 침습의 세 가지 주요 요소로 설명될 수 있다[1,2]. 조혈모세포 이식, 장기 이식, 혈액암 치료 환자와 같이 면역이 저하된 경우 AIFRS에 대한 감수성이 증가한다. 특히, 호중구 감소증이 있는 환자는 진균에 대한 방어 능력이 감소하여 감염 위험이 높아진다[11]. 스테로이드 사용 또한 면역 기능을 억제하여 AIFRS의 발생률을 증가시키는 요인 중 하나이다[12]. Aspergillosis와 뮤코르균은 주로 토양, 부패한 식물, 공기 중 포자로 존재하며, 건설 현장이나 병원 내 감염원으로 작용할 수 있다. 특히 병원 내 공기 질이 적절히 관리되지 않을 경우, 면역저하 환자에서 AIFRS가 발생할 위험이 증가한다[13]. AIFRS의 특징적인 병리 기전 중 하나는 혈관 침습이다. 진균이 혈관 내로 침범하면 혈전 형성과 허혈성 괴사가 발생하며, 이로 인해 조직이 빠르게 괴사된다. 특히 뮤코르균 감염의 경우 혈관 침습이 심하여 감염 부위의 괴사 및 색전 형성을 초래할 수 있다[14,15].
약물 치료AIFRS의 치료에서 항진균제 사용은 가장 중요한 요소 중 하나이다. 치료의 목표는 신속한 진균 제거, 감염 확산 방지, 환자의 면역 상태 개선이다. AIFRS의 주요 원인균인 Aspergillosis와 Mucorales에 대한 효과적인 약제 선택이 필수적이며, 환자의 면역 상태 및 감염 진행 정도에 따라 맞춤형 치료 전략이 필요하다. 주요 항진균제는 크게 polyenes, triazoles, echinocandins 세 가지로 분류되며(Fig. 1), 이들을 포함한 항진균제들의 작용 스펙트럼은 Table 1과 같다[16,17].
가장 널리 사용되는 폴리엔 계열 약물은 amphotericin B이며, 이는 amphotericin B deoxycholate 또는 지질 기반 제형으로 제공된다. 이 약물은 정맥주사 또는 국소 요법으로 투여할 수 있다. Amphotericin B의 주요 부작용은 신독성이며, 기타 부작용으로는 전해질 불균형과 주입 관련 반응이 있다[18].
Triazole 계열에는 voriconazole, posaconazole, isavuconazole이 포함되며, 정맥주사와 경구 복용 모두 가능하다. Triazole 계열의 주요 부작용은 간독성으로, 간 효소 수치를 주기적으로 모니터링하는 것이 중요하다. 특히 voriconazole의 경우 시각 변화, 신경 독성, 피부 독성, 그리고 심장 독성 등의 부작용이 나타날 수 있다[18]. Echinocandins 계열에는 micafungin, caspofungin, anidulafungin이 있으며, 일반적으로 정맥주사로 투여된다. 이 계열의 부작용은 대체로 경미하며, 국소 정맥염 및 간 기능 이상 등이 포함된다[19].
경험적 치료제L-AmB는 AIFRS의 1차 치료제로 권장되며, 특히 뮤코르균 감염에서 가장 효과적인 약제로 평가된다[18]. Amphotericin B를 사용할 경우, 신독성 위험 증가를 고려하여 지질 제형 L-AmB를 사용하는 것이 권장된다. 일반적으로 5 mg/kg/day의 용량으로 정맥 주사하며, 중증 감염에서는 10 mg/kg/day까지 증량이 가능하다[18,19]. Amphotericin B가 경험적 치료제로 사용되는 근거는 전문가 권고와 기본 원칙에 기반하며, 이는 amphotericin B가 Mucorales와 Aspergillosis 모두에 대해 광범위한 항진균 효과를 가지기 때문이다. 반면, Mucorales는 일부 triazole 계열 항진균제에 내성을 가지고 있으며, triazole은 Aspergillosis의 1차 치료제로 사용된다[18].
AIFRS에 대한 경험적 항진균 치료는 의심 정도가 충분히 높은 경우 고려될 수 있으나, 최종적으로는 외과적 개입을 통해 조직 검체를 확보하여 AIFRS 진단을 확정하는 것이 중요하다[5]. 병원체가 확인되면, 이에 맞는 표적 항진균 치료를 적용할 수 있다.
Aspergillosis의 약물 치료
Aspergillosis은 AIFRS의 흔한 원인균이며 일반적으로 voriconazole이 1차 치료제로 권장된다. 무작위 대조 연구에서 침습성 Aspergillosis 감염으로 치료받은 277명의 환자를 대상으로 한 결과, voriconazole을 투여받은 그룹에서 52.8%의 성공적인 치료 결과가 나타난 반면, amphotericin B 치료 그룹에서는 31%에 불과했다[20].
AIFRS 환자를 대상으로 amphotericin B와 voriconazole을 비교한 사례 연구는 두 개 뿐이었으며, 두 연구 모두 Mucormycosis와 Aspergillosis 감염 환자가 혼합되어 있었다[21,22]. Monroe 등[22]의 연구에서는 Aspergillosis 감염 환자군을 대상으로 한 하위 분석에서 voriconazole 치료를 받은 환자의 사망률이 감소하는 경향을 보였으나, 통계적으로 유의미한 차이는 나타나지 않았다. 다수의 AIFRS 증례 연구에서 다양한 항진균 치료법이 보고되었으며, 많은 연구에서 voriconazole이 사용되었다[23,24]. Voriconazole은 일반적으로 초기에 정맥주사로 투여한 후, 임상적·생화학적·영상학적 소견을 바탕으로 경구 치료로 전환된다.
Isavuconazole과 posaconazole 또한 침습성 Aspergillosis 감염의 대체 치료제이다. 침습성 Aspergillosis 감염 환자를 대상으로 수행된 두 건의 무작위 대조 연구에서는 voriconazole과 비교했을 때 유사한 치료 효과 및 부작용이 더 적다는 결과가 있었다[25,26]. Durand 등[27]은 isavuconazole 단독 치료를 받은 환자의 60%에서 임상적 성공률을 보였으며, 전체 생존율은 70%로 보고하였다. 다만 이 연구에서도 Mucormycosis 감염과 Aspergillosis 감염 환자가 각각 34%, 42%로 혼재되어 있었다. 또한 posaconazole은 특정 Aspergillosis 감염군이 아닌 여러 AIFRS 사례 연구에서 사용되었다[16,23].
Azole 내성이 확인된 경우, L-AmB가 대체 단독 치료제로 사용될 수 있다. 한 전향적 연구에서는 다양한 형태의 침습성 Aspergillosis 감염 환자에서 amphotericin B 사용 시 약 50%의 반응률이 나타났다[28]. AIFRS 환자를 대상으로 한 2개의 후향적 사례 연구와 1개의 문헌 검토 연구에서 amphotericin B 치료가 생존율 향상에 유의한 효과를 보였으나, 다변량 분석에서는 통계적으로 유의미한 차이를 보이지 않았다[1,29,30].
병합 항진균 치료는 일반적으로 권장되지 않지만, AIFRS의 중증 사례에서는 구제 요법으로 고려된다. 무작위 대조 연구에서 voriconazole과 anidulafungin 병합 치료를 voriconazole 단독 치료와 비교한 결과, 병합 치료를 받은 환자에서 예후가 더 좋았다. 또한 triazole과 ehinocandin의 병합 치료, amphotericin B 과 ehinocandin의 병합 치료에서 단독 치료와 비교하여 예후가 상대적으로 좋았다고 보고된 바 있다[31].
Mucormycosis의 약물 치료
Aspergillosis와 달리, Mucormycosis는 voriconazole에 대한 선천적 내성을 나타낸다. 따라서 최근 발표된 가이드라인에서는 L-AmB를 1차 치료제로 권장하고 있다[32]. 중추신경계 침범이 있는 경우, amphotericin B의 투여 용량을 최대 10mg/kg까지 증량할 수 있다. 대부분의 뮤코르진균증 AIFRS 사례 연구에서는 amphotericin B가 사용되었으나, amphotericin B와 다른 항진균제를 비교한 연구는 3건에 불과하다. 두 건의 후향적 사례 연구에서는 생존율 차이가 없었으며, 한 건의 대규모 체계적 문헌 검토에서는 amphotericin B와 다른 항진균제의 생존율을 비교했을 때 단변량 분석에서 유의미한 차이를 보였다[29-31]. 그러나 이러한 연구들은 Aspergillosis와 Mucormycosis를 구분하지 않고 분석하였다는 제한점이 있다.
Amphotericin B를 견디지 못하거나 약제 내성이 발생한 환자의 경우, isavuconazole과 posaconazole이 mucorales에 대한 활성을 가지고 있어 대안으로 고려될 수 있다. 두 약물 모두 다양한 형태의 Mucormycosis 환자에서 구제요법으로 효과가 입증된 바 있으나[32,33], isavuconazole만이 VITAL 연구에서 소수의 환자를 대상으로 1차 치료로서의 효과가 확인되었다[34]. 한편, Manesh 등[34]은 Mucormycosis AIFRS 환자 12명에게 posaconazole을 투여한 연구에서 66.6%의 완전 관해와 0%의 사망률(중앙 추적 관찰 기간 9개월)을 보고하였다.
Mucormycosis의 초기 치료에서 병합 요법의 이점에 대한 논란이 지속되고 있다. 2008년 소규모 후향적 연구에서는 amphotericin B과 echinocandin 병합 요법이 amphotericin B 단독 요법보다 생존율을 향상시켰음을 보고하였으나, 병합 치료를 받은 환자 수가 적다는 한계가 있다[35]. 또한, AIFRS 환자를 대상으로 한 이후의 대규모 후향적 연구들에서는 Mucorales와 Aspergillus을 포함한 감염 환자들 사이에서 병합 치료의 생존율 차이가 확인되지 않았다[36,37].
또한, Mucormycosis에 활성 있는 posaconazole 또는 isavuconazole과 amphotericin B의 병합 요법에 대한 관심도 증가하고 있다. 그러나 AIFRS 환자의 다양한 원인균을 대상으로 한 여러 연구에서, polyene과 triazole의 병합 치료가 생존율을 유의미하게 향상시키지 못했다[36,38]. 다만, 초기 병합 요법으로 azole 계열 약물을 사용하면, amphotericin B을 견디지 못하는 환자에서도 즉시 활성 치료를 지속할 수 있다는 장점이 있다. 만약 azole 계열 약물을 병합 요법으로 사용하지 않았다면, 새로운 치료제를 시작할 경우 수일간의 환자 안정 상태가 가능하다는 점에서 초기 병합 치료가 유리할 수 있다.
Amphotericin B을 이용한 유도 치료는 보통 최소 3주 이상 지속되며, 이후 경구 azole 계열 약물로 전환된다[38]. 그 후, 경구 azole 치료는 최소 3~6개월 이상 지속되며, 종종 면역 상태에 따라 더 오래 투여해야할 수 있다[32,33]. 어떠한 azole 계열 약물을 사용하여 치료를 전환할지에 대한 결정은 개별적인 기준에 따라 이루어져야 하며, 이때 약물의 부작용, 약물 농도 모니터링 필요성, 진균의 최소 억제 농도(minimum inhibitory concentration, MIC) 등을 고려해야 한다. 또한, 장기간 azole 치료 중에 침습성 진균 감염의 발생 위험이 있는지 여부도 중요한 고려 사항이다. 이 점은 특히 isavuconazole을 투여했을 때 돌파 감염이 가능하다는 점에서 중요하다. 특히 장기 이식 환자나 악성 혈액 질환 환자에서 이와 같은 감염이 발생할 수 있다[39,40].
비정형 균의 약물 치료희귀하거나 비정형 진균 병원체인 Fusarium , Scedosporium, Alternaria , Paecilomyces, Scopularopsis 등으로 인한 AIFRS는 감염내과 전문의와 함께 치료해야하고 다학제적으로 접근할 필요가 있다[41]. 이러한 비정형 균에 대한 AIFRS 치료에 대해서 현재까지 확립된 치료 방법은 없으나, 일부 대규모 연구에서는 이러한 비정형 균에 감염된 환자가 일부 포함된 경우가 있었다[42-44]. 현재 이러한 비정형 균에 대해 활성이 있는 새로운 항진균제들이 개발 단계에 있으며, 예를 들어 Oratamide, Lorofim, Fosmanogepix 등이 있다[45,46]. 이들 약물은 AIFRS 치료에서 앞으로의 하나의 치료 방법이 될 수 있다. 위의 내용과 함께 이를 정리하면 Table 2와 같다.
약물 치료 기간AIFRS에 대한 치료 기간은 근거가 충분하지 않은데, 그 이유는 진균 감염으로부터의 치료 종결 지표가 표준화되지 않았고, 진균에 대한 치료 패턴이 다르기 때문이다. 최소한, 치료는 모든 임상적 및 영상의학적 소견이 해결되고 감염 증거가 사라질 때까지 지속되어야 한다. 감염내과 전문의와의 협진이 치료 기간을 결정하는 데 중요한 역할을 할 수 있다. 치료 기간에 영향을 미치는 요소로는 AIFRS가 주변 구조물로의 침범 정도, 흡연 상태, 호중구 수 감소, 혈액학적 악성 질환, 최근 항암 화학 요법, 수술 지연 시간 등이 있다[44,47]. 비록 치료 기간에 대한 일관된 권장 사항은 없지만, 대부분의 연구에서 3주에서 12개월 사이로 추정하고 있다. 이처럼 항진균제는 비교적 장기간 투여해야 하는 경우가 많아 환자의 경제적 부담이 중요한 문제가 될 수 있다. 현재까지 침습성 진균 감염이 병리학적으로 확인된 경우에는 보험 급여가 인정되지만, 병리학적 확인이 어려운 경우에는 환자의 임상 상태, 영상학적 검사 등의 소견에 따라 급여 적용 여부가 결정된다. Invasive Aspergillosis의 치료에서는 amphotericin B와 voriconazole이 1차 약제로 보험 급여가 인정되며, L-AmB는 원칙적으로 1차 약제의 부작용 발생 또는 치료 실패 시 2차 약제로만 급여 처방이 가능하다(고시 제2022-131호).
새로운 약제악성 혈액 질환이나 유사한 위험 인자가 있는 환자에서 진균 감염에 대응하기 위한 면역조절제의 사용은 지속적으로 연구되고 있다. Granulocyte colony-stimulating factor (GCSF), interferon, 세포 면역 요법을 포함되나 진균 감염에 대한 면역조절제 사용은 아직 확립되지 않아 추후 연구가 계속 되어야 한다[21].
결 론AIFRS은 면역 억제 상태에서 발생하는 치명적인 감염으로, Aspergillus와 Mucorales는 AIFRS의 주요 원인균이며, 이들은 혈관을 침습하여 급격히 진행되는 조직 괴사 및 전신 감염을 유발할 수 있다. AIFRS의 치료는 항진균제와 수술적 절제를 병행해야 하며, 약물 치료의 선택은 환자의 면역 상태와 감염의 진행 정도에 따라 달라진다.
최신 문헌 고찰에 따르면 AIFRS의 1차 치료제로 L-AmB가 가장 권고되고 있으며, voriconazole은 Aspergillosis 감염에 특히 효과적인 1차 약물로 사용된다. Mucormycosis의 경우, L-AmB가 우선 치료제로 사용되며, posaconazole과 isavuconazole은 대체 치료제로 고려될 수 있다. 그러나 일부 환자에서는 항진균제에 대한 내성 문제가 발생할 수 있어, 각각의 환자에 대한 개별적인 접근과 치료가 필요하다.
AIFRS 치료의 핵심은 신속한 진균 제거, 감염 확산 방지 및 환자의 면역 상태 개선에 있으며, 약물 치료와 함께 적극적인 괴사 조직 제거가 중요하다. 병합 항진균 치료가 특정 경우에서 효과적일 수 있으나, 대체로 권장되지는 않으며, 치료 기간은 임상적 소견과 환자 상태에 따라 달라질 수 있다. 또한, 새로운 항진균제 개발과 면역조절제 사용에 대한 연구가 진행 중이다. 향후 AIFRS의 효과적인 치료를 위해서는 다양한 원인균에 대한 연구와 치료 전략의 개선이 필요하며, 다학제적인 접근이 중요하다.
NotesFig. 1.Mechanisms of action of antifungal agents. Polyenes interact directly with ergosterol in fungal cell membranes, creating pores that compromise membrane integrity and ultimately cause cell death. Triazoles block the activity of lanosterol 14α-demethylase, an essential enzyme in the ergosterol biosynthesis pathway, thereby disrupting membrane formation and function. Echinocandins target β-(1,3)-Dglucan synthase, an enzyme critical for fungal cell wall synthesis, resulting in structural weakening and cell lysis. Modified from Nett and Andes. Infect Dis Clin North Am 2016;30(1):51-83 [17]. 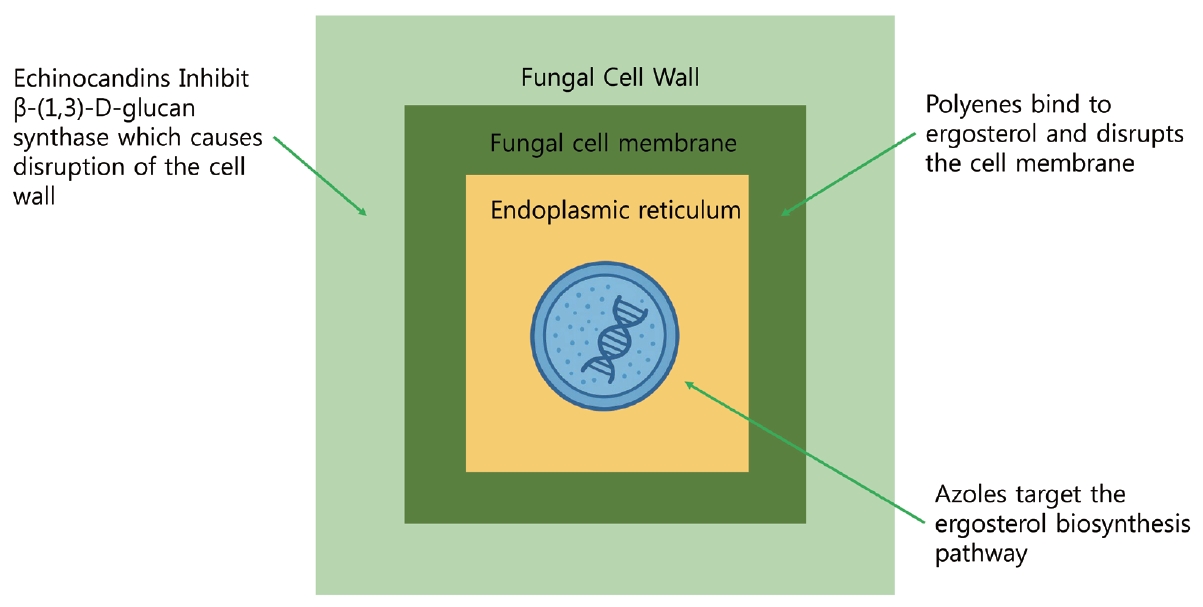
Table 1.The spectrum of activity of antifungal agents 5FC, flucytosine; AMB, amphotericin B; CAS, caspofungin; FLU, fluconazole; ISA, isavuconazole; ITR, itraconazole; POS, posaconazole; VOR, voriconazole. Modified from Nett and Andes. Infect Dis Clin North Am 2016;30(1):51-83. [17] Table 2.Differentiated pharmacological treatment of acute invasive fungal rhinosinusitis IV, intravenous. Modified from Nett and Andes. Infect Dis Clin North Am 2016;30(1):51-83. [17] REFERENCES1. Turner JH, Soudry E, Nayak JV, Hwang PH. Survival outcomes in acute invasive fungal sinusitis: a systematic review and quantitative synthesis of published evidence. Laryngoscope 2013;123(5):1112-8.
2. Bitar D, Lortholary O, Le Strat Y, Nicolau J, Coignard B, Tattevin P, et al. Population-based analysis of invasive fungal infections, France, 2001-2010. Emerg Infect Dis 2014;20(7):1149-55.
3. Pappas PG, Alexander BD, Andes DR, Hadley S, Kauffman CA, Freifeld A, et al. Invasive fungal infections among organ transplant recipients: results of the transplant-associated infection surveillance network (TRANSNET). Clin Infect Dis 2010;50(8):1101-11.
4. Cadena J, Thompson GR 3rd, Patterson TF. Invasive aspergillosis: current strategies for diagnosis and management. Infect Dis Clin North Am 2016;30(1):125-42.
5. Wandell GM, Miller C, Rathor A, Wai TH, Guyer RA, Schmidt RA, et al. A multi-institutional review of outcomes in biopsy-proven acute invasive fungal sinusitis. Int Forum Allergy Rhinol 2018;8(12):1459-68.
6. Roxbury CR, Smith DF, Higgins TS, Lee SE, Gallia GL, Ishii M, et al. Complete surgical resection and short-term survival in acute invasive fungal rhinosinusitis. Am J Rhinol Allergy 2017;31(2):109-16.
7. Taxy JB, El-Zayaty S, Langerman A. Acute fungal sinusitis: natural history and the role of frozen section. Am J Clin Pathol 2009;132(1):86-93.
8. Nam SH, Chung YS, Choi YJ, Lee JH, Kim JH. Treatment outcomes in acute invasive fungal rhinosinusitis extending to the extrasinonasal area. Sci Rep 2020;10(1):3688.
9. Ghadiali MT, Deckard NA, Farooq U, Astor F, Robinson P, Casiano RR. Frozen-section biopsy analysis for acute invasive fungal rhinosinusitis. Otolaryngol Head Neck Surg 2007;136(5):714-9.
10. Park BJ, Pappas PG, Wannemuehler KA, Alexander BD, Anaissie EJ, Andes DR, et al. Invasive non-Aspergillus mold infections in transplant recipients, United States, 2001-2006. Emerg Infect Dis 2011;17(10):1855-64.
11. Kauffman CA, Freifeld AG, Andes DR, Baddley JW, Herwaldt L, Walker RC, et al. Endemic fungal infections in solid organ and hematopoietic cell transplant recipients enrolled in the transplant-associated infection surveillance network (TRANSNET). Transpl Infect Dis 2014;16(2):213-24.
12. Bassetti M, Scudeller L, Giacobbe DR, Lamoth F, Righi E, Zuccaro V, et al. Developing definitions for invasive fungal diseases in critically ill adult patients in intensive care units. Protocol of the FUNgal infections Definitions in ICU patients (FUNDICU) project. Mycoses 2019;62(4):310-9.
13. Fisher BT, Ross RK, Localio AR, Prasad PA, Zaoutis TE. Decreasing rates of invasive candidiasis in pediatric hospitals across the United States. Clin Infect Dis 2014;58(1):74-7.
14. Lamoth F, Cruciani M, Mengoli C, Castagnola E, Lortholary O, Richardson M, et al. β-glucan antigenemia assay for the diagnosis of invasive fungal infections in patients with hematological malignancies: a systematic review and meta-analysis of cohort studies from the Third European Conference on Infections in Leukemia (ECIL-3). Clin Infect Dis 2012;54(5):633-43.
15. Hanson KE, Pfeiffer CD, Lease ED, Balch AH, Zaas AK, Perfect JR, et al. β-D-glucan surveillance with preemptive anidulafungin for invasive candidiasis in intensive care unit patients: a randomized pilot study. PLoS One 2012;7(8):e42282.
16. Pagella F, De Bernardi F, Dalla Gasperina D, Pusateri A, Matti E, Avato I, et al. Invasive fungal rhinosinusitis in adult patients: our experience in diagnosis and management. J Craniomaxillofac Surg 2016;44(4):512-20.
17. Nett JE, Andes DR. Antifungal agents: spectrum of activity, pharmacology, and clinical indications. Infect Dis Clin North Am 2016;30(1):51-83.
18. Rizk SS, Kraus DH, Gerresheim G, Mudan S. Aggressive combination treatment for invasive fungal sinusitis in immunocompromised patients. Ear Nose Throat J 2000;79(4):278-85.
19. Fadda GL, Martino F, Andreani G, Succo G, Catalani M, Di Girolamo S, et al. Definition and management of invasive fungal rhinosinusitis: a single-centre retrospective study. Acta Otorhinolaryngol Ital 2021;41(1):43-50.
20. Herbrecht R, Denning DW, Patterson TF, Bennett JE, Greene RE, Oestmann JW, et al. Voriconazole versus amphotericin B for primary therapy of invasive aspergillosis. N Engl J Med 2002;347(6):408-15.
21. Cho HJ, Jang MS, Hong SD, Chung SK, Kim HY, Dhong HJ. Prognostic factors for survival in patients with acute invasive fungal rhinosinusitis. Am J Rhinol Allergy 2015;29(1):48-53.
22. Monroe MM, McLean M, Sautter N, Wax MK, Andersen PE, Smith TL, et al. Invasive fungal rhinosinusitis: a 15-year experience with 29 patients. Laryngoscope 2013;123(7):1583-7.
23. Huang YF, Liang KL, Liang CY, Yang PC, Chen JP, Wei LC. Acute invasive fungal rhinosinusitis-related orbital infection: a single medical center experience. J Ophthalmol 2021;2021:9987871.
24. Trief D, Gray ST, Jakobiec FA, Durand ML, Fay A, Freitag SK, et al. Invasive fungal disease of the sinus and orbit: a comparison between mucormycosis and Aspergillus. Br J Ophthalmol 2016;100(2):184-8.
25. Maertens JA, Raad II, Marr KA, Patterson TF, Kontoyiannis DP, Cornely OA, et al. Isavuconazole versus voriconazole for primary treatment of invasive mould disease caused by Aspergillus and other filamentous fungi (SECURE): a phase 3, randomised-controlled, non-inferiority trial. Lancet 2016;387(10020):760-9.
26. Maertens JA, Rahav G, Lee DG, Ponce-de-León A, Ramírez Sánchez IC, Klimko N, et al. Posaconazole versus voriconazole for primary treatment of invasive aspergillosis: a phase 3, randomised, controlled, non-inferiority trial. Lancet 2021;397(10273):499-509.
27. Durand ML, Kitt TM, Song Y, Marty FM. Isavuconazole treatment of invasive fungal sinusitis: a post hoc analysis of the SECURE and VITAL trials. Clin Infect Dis 2021;73(6):e1380-3.
28. Cornely OA, Maertens J, Bresnik M, Ebrahimi R, Ullmann AJ, Bouza E, et al. Liposomal amphotericin B as initial therapy for invasive mold infection: a randomized trial comparing a high-loading dose regimen with standard dosing (AmBiLoad trial). Clin Infect Dis 2007;44(10):1289-97.
29. Raizada N, Jyotsna VP, Kandasamy D, Xess I, Thakar A, Tandon N. Invasive fungal rhinosinusitis in patients with diabetes. J Infect Dev Ctries 2018;12(9):787-93.
30. Fernandez IJ, Crocetta FM, Demattè M, Farneti P, Stanzani M, Lewis RE, et al. Acute invasive fungal rhinosinusitis in immunocompromised patients: role of an early diagnosis. Otolaryngol Head Neck Surg 2018;159(2):386-93.
31. Heinz WJ, Buchheidt D, Ullmann AJ. Clinical evidence for caspofungin monotherapy in the first-line and salvage therapy of invasive Aspergillus infections. Mycoses 2016;59(8):480-93.
32. Marty FM, Ostrosky-Zeichner L, Cornely OA, Mullane KM, Perfect JR, Thompson GR 3rd, et al. Isavuconazole treatment for mucormycosis: a single-arm open-label trial and case-control analysis. Lancet Infect Dis 2016;16(7):828-37.
33. van Burik JA, Hare RS, Solomon HF, Corrado ML, Kontoyiannis DP. Posaconazole is effective as salvage therapy in zygomycosis: a retrospective summary of 91 cases. Clin Infect Dis 2006;42(7):e61-5.
34. Manesh A, John AO, Mathew B, Varghese L, Rupa V, Zachariah A, et al. Posaconazole: an emerging therapeutic option for invasive rhino-orbito-cerebral mucormycosis. Mycoses 2016;59(12):765-72.
35. Reed C, Bryant R, Ibrahim AS, Edwards J Jr, Filler SG, Goldberg R, et al. Combination polyene-caspofungin treatment of rhinoorbital-cerebral mucormycosis. Clin Infect Dis 2008;47(3):364-71.
36. Chen CY, Sheng WH, Cheng A, Chen YC, Tsay W, Tang JL, et al. Invasive fungal sinusitis in patients with hematological malignancy: 15 years experience in a single university hospital in Taiwan. BMC Infect Dis 2011;11:250.
37. Foshee J, Luminais C, Casey J, Farag A, Prestipino A, Iloreta AM, et al. An evaluation of invasive fungal sinusitis outcomes with subsite analysis and use of frozen section analysis. Int Forum Allergy Rhinol 2016;6(8):807-11.
38. Gode S, Turhal G, Ozturk K, Aysel A, Midilli R, Karci B. Acute invasive fungal rhinosinusitis: survival analysis and the prognostic indicators. Am J Rhinol Allergy 2015;29(6):e164-9.
39. Fung M, Schwartz BS, Doernberg SB, Langelier C, Lo M, Graff L, et al. Breakthrough invasive fungal infections on isavuconazole prophylaxis and treatment: what is happening in the real-world setting? Clin Infect Dis 2018;67(7):1142-3.
40. Rausch CR, DiPippo AJ, Bose P, Kontoyiannis DP. Breakthrough fungal infections in patients with leukemia receiving isavuconazole. Clin Infect Dis 2018;67(10):1610-3.
41. Tortorano AM, Richardson M, Roilides E, van Diepeningen A, Caira M, Munoz P, et al. ESCMID and ECMM joint guidelines on diagnosis and management of hyalohyphomycosis: Fusarium spp., Scedosporium spp. and others. Clin Microbiol Infect 2014;20(Suppl 3):27-46.
42. Davoudi S, Kumar VA, Jiang Y, Kupferman M, Kontoyiannis DP. Invasive mould sinusitis in patients with haematological malignancies: a 10 year single-centre study. J Antimicrob Chemother 2015;70(10):2899-905.
43. Alejandro A, de la Torre González C, Edgar M, Perla V. Factors associated with all-cause mortality in pediatric invasive fungal rhinosinusitis. Int J Pediatr Otorhinolaryngol 2020;129:109734.
44. Drakos PE, Nagler A, Or R, Naparstek E, Kapelushnik J, Engelhard D, et al. Invasive fungal sinusitis in patients undergoing bone marrow transplantation. Bone Marrow Transplant 1993;12(3):203-8.
45. Rauseo AM, Coler-Reilly A, Larson L, Spec A. Hope on the horizon: novel fungal treatments in development. Open Forum Infect Dis 2020;7(2):ofaa016.
|
|
||||||||||||||||||||||||||||||||||||||||||||

 |
 |